






高中化学苏教版选修4 化学反应原理第三单元 盐类的水解教案配套ppt课件
展开同学们对如何把握好溶液中的三大守恒关系, 常常感到无从下手或者混淆这些问题,导致做题时常常出错。今天我们通过复习来突破该难点。
电解质溶液呈电中性。阴离子所带负电荷总数=阳离子所带的正电荷总数
书写方法:①准确找出电解质溶液中所有的阳离子与阴离子(包括H+与OH-)②弄清电荷浓度和离子浓度的关系
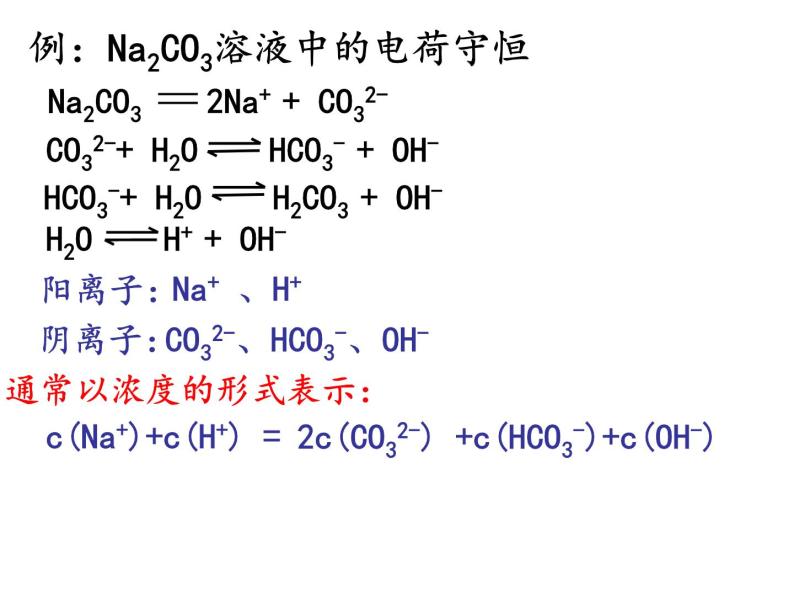
例:Na2CO3溶液中的电荷守恒
CO32-、HCO3-、OH-
c(Na+)+c(H+) =
2c(CO32-) +c(HCO3-)+c(OH-)
通常以浓度的形式表示:
Na2CO3 2Na+ + CO32-
CO32-+ H2O HCO3- + OH-
HCO3-+ H2O H2CO3 + OH-
H2O H+ + OH-
思考NaHCO3溶液的电荷守恒式
c(Na+)+c(H+)=
小结:不同溶质的溶液,只要所含离子种类相同。则电荷守恒式相同。
练习1、下列溶液中各微粒的浓度关系正确的是( )A.在Na2CO3溶液中:c(Na+) =2c(CO32-)+c(HCO3-)B.在醋酸钠溶液中:c(Na+)= c(CH3COO-)C.在硫酸溶液中加氨水直至溶液呈中性,则 c(NH4+)=2c(SO42-)D.在NaHA溶液中一定有: c(Na+) + c(H+) = c(HA-) + c(OH-) +2 c(A2-)
2.物料守恒(原子守恒)
即溶液中某一组分的原始浓度等于它在溶液中各种存在形式的浓度之和。
例:Na2CO3溶液中的物料守恒式
c(CO32-) +c(HCO3-)+c(H2CO3)
Na2CO3溶液中的物料守恒式
故碳元素以CO32-,HCO3-,H2CO3三种形式存在,钠元素以Na+形式存在
思考NaHCO3溶液的物料守恒式
c(HCO3-)+ c(CO32-)+ c(H2CO3)
练习2:已知某二元酸H2A在水中的电离方程式是 H2A H+ +HA-、HA- H+ +A2-试写出NaHA溶液的物料守恒式:
NaHA Na+ + HA-HA- H+ +A2-
故物料守恒式为:c(Na+)= c(A2-)+ c(HA-)
3.质子(H+)守恒:
即溶液中由水电离出来的H+和OH-的数目相等
例:Na2CO3溶液中的质子守恒式
c(HCO3-) +2c(H2CO3) + c(H+) = c(OH-)
Na2CO3溶液质子守恒关系式为:
2c(CO32-) +c(HCO3-)+c(OH-)
2c(HCO3-)+2c(CO32-)+2c(H2CO3)
注意:质子守恒式也可由电荷守恒和物料守恒叠加得到
c(H+)+ c(HCO3-) +2c(H2CO3) = c(OH-)
思考NaHCO3溶液的质子守恒式
c(H+)+ c(H2CO3) = c(OH-)+c(CO32-)
练习3:下列溶液中各微粒的浓度关系正确的是( )A.在0.1 ml·L-1CH3COONa溶液中: c(CH3COOH)+ c(OH-) = c(H+)B.1ml·L-1NH4Cl溶液中:c(H+)=c(NH4+)- c(OH-)C.0.2m1·L-1的Na2CO3溶液: c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)D.Na2CO3溶液中: c(Na+) =2c(CO32-)+c(HCO3-) +c(H2CO3)
1、根据题意分析确定溶液中的溶质成分
关于溶液中的三大守恒关系应按三个步骤分析:
2、列出溶液中发生变化的离子方程式
3、根据物料守恒、电荷守恒、质子守恒原理列 出有关恒等关系,对照题目作出准确的判断
课堂练习1、室温下,下列溶液中粒子浓度关系正确的是A.Na2S溶液:c(Na+) = c(S2-)+c(HS-)+c(H2S)B.Na2C2O4溶液中: c(OH-) = c(H+)+c(HC2O4-)+2c(H2C2O4)C.NH4Cl溶液:c(NH4+) = c(Cl-)D.CH3COONa溶液: c(H+) = c(OH-) +c(CH3COO-)
2、已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 ml·L-1的NaA和NaB混合溶液中,下列排序正确的是( )A.c(OH-)>c(HA)>c(HB)>c(H+)B.c(OH-)>c(A-)>c(B-)>c(H+)C.c(OH-)>c(B-)>c(A-)>c(H+)D.c(OH-)>c(HB)>c(HA)>c(H+)
3.常温下,下列溶液中的微粒浓度关系正确的是( )A.新制氯水中加入固体NaOH: c(Na+)=c(Cl-)+c(ClO-)+c(OH-)B.pH=8.3 的NaHCO3溶液: c(Na+)> c(HCO3-)> c(CO32-)> c(H2CO3)C.pH=11的氨水与pH=3的盐酸等体积混合: c(Cl-)=c(NH4+)>c(OH-)=c(H+)D.0.2 ml/L CH3COOH与0.1 ml/L NaOH溶液等体积混合: 2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
苏教版 (2019)选择性必修1第三单元 盐类的水解教案配套ppt课件: 这是一份苏教版 (2019)选择性必修1第三单元 盐类的水解教案配套ppt课件,共35页。
化学苏教版专题三 溶液中的离子反应第三单元 盐类的水解授课课件ppt: 这是一份化学苏教版专题三 溶液中的离子反应第三单元 盐类的水解授课课件ppt,共11页。PPT课件主要包含了有弱才水解,越弱越水解等内容,欢迎下载使用。
苏教版选修4 化学反应原理第一节 弱电解质的电离平衡教案配套课件ppt: 这是一份苏教版选修4 化学反应原理第一节 弱电解质的电离平衡教案配套课件ppt,共29页。PPT课件主要包含了强电解质,弱电解质,③④⑨,课堂练习,②③⑥⑦⑧⑨⑩,②③⑥⑧⑩,④酸式盐的电离,习题9,习题10,思考与交流等内容,欢迎下载使用。













