
苏教版选修4 化学反应原理第一节 弱电解质的电离平衡教案设计
展开强电解质和弱电解质 教学设计
课题名称 | 强电解质和弱电解质 | 教师姓名 | 樊云珍 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
课题来源 | □适用年级:高二 □教材版本:苏教版 □教材册(模块)名称:化学反应原理 □所属单元章节:专题3第一单元 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
教学目标 | 1. 知识与技能 (1)知道强弱电解质的概念,理解强、弱电解质在水溶液电离程度的差异; (2)知道强、弱电解质的常见物质类别; (3)知道电解质溶液导电能力与离子浓度、所带电荷数有关。
3. 情感态度与价值观 培养学生小组协助精神和科学探究精神 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
教学重点难点 | 1、强、弱电解质在水溶液中电离程度的差异及原因; 2、分析、归纳能力的培养; 3、熟练用控制变量法进行实验方案设计。
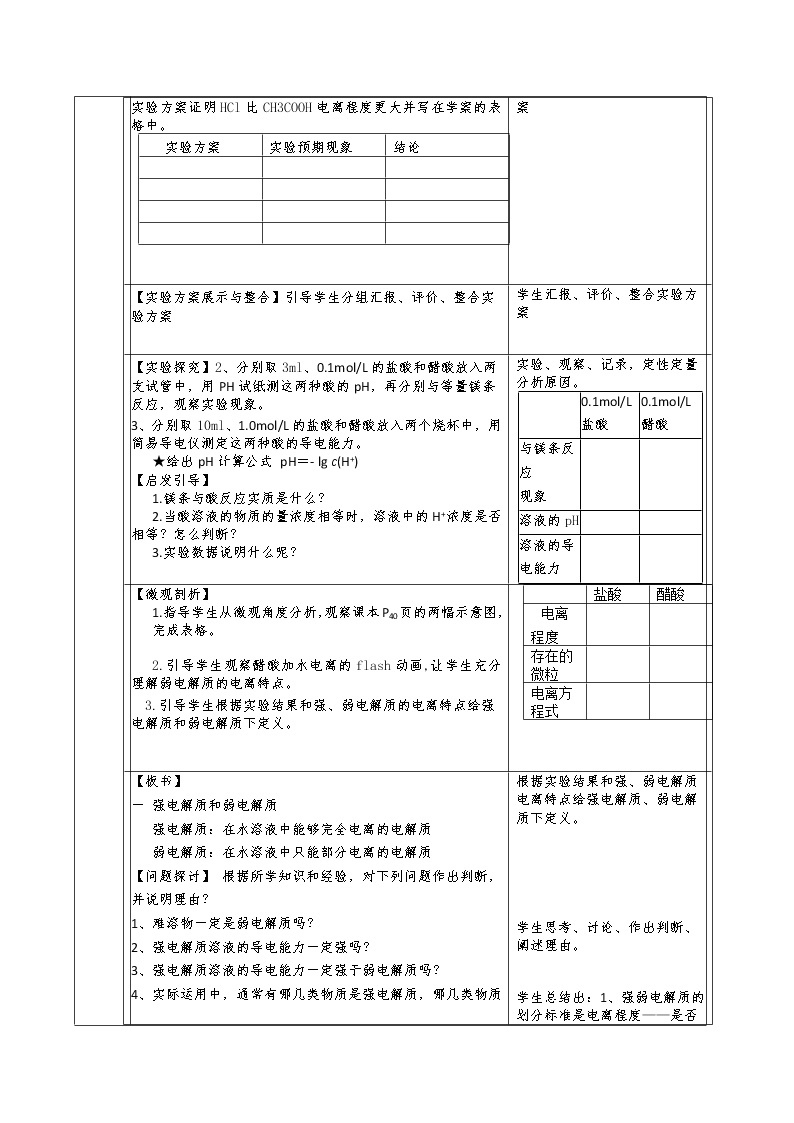
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
教学策略 | 采取多层次互动协作探究式教学 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
教学过程 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
板书设计: 强电解质和弱电解质
定义 电离符号 电解质存在微粒 物质类别
强电解质:在水溶液中完全 离子 强酸、强碱
电离的电解质 绝大多数盐
活泼金属氧
化物
弱电解质:在水溶液中部分 离子和分子 弱酸、弱碱
电离的电解质 水、极少数盐
化学第四单元 沉淀溶解平衡教学设计: 这是一份化学第四单元 沉淀溶解平衡教学设计,共2页。教案主要包含了设计思路,教学目标,教学重点,教学方法等内容,欢迎下载使用。
苏教版选修4 化学反应原理第二单元 溶液的酸碱性教案设计: 这是一份苏教版选修4 化学反应原理第二单元 溶液的酸碱性教案设计,共2页。教案主要包含了学习目标,教学重点,教学难点,例题讲解,思考讨论,巩固练习,问题解决,反馈与应用等内容,欢迎下载使用。
高中化学苏教版选修4 化学反应原理第一节 弱电解质的电离平衡教学设计及反思: 这是一份高中化学苏教版选修4 化学反应原理第一节 弱电解质的电离平衡教学设计及反思,共4页。教案主要包含了教学内容分析,教学目标,学习者特征分析,教学策略选择与设计,教学重点及难点,教学过程,教学评价设计,板书设计等内容,欢迎下载使用。













