化学选修4 化学反应原理第一节 弱电解质的电离平衡第2课时教案
展开1.化学平衡状态的特征有哪些?
提示:(1)动态平衡;(2)达到平衡时,正、逆反应速率相等;(3)平衡时,各物质的浓度保持不变;当条件改变时,平衡被破坏,可能发生移动。
2.化学平衡移动原理的内容是什么?
提示:改变影响化学平衡的一个因素,平衡将向着能够减弱这种改变的方向移动。
3.影响化学平衡常数的因素是什么?
提示:温度。
4.强、弱电解质的电离差异是什么?
提示:强电解质在水溶液中完全电离,弱电解质在水溶液中部分电离。
[新知探究]
探究1 弱电解质电离平衡的建立
(1)弱电解质电离平衡的建立图示:
(2)电离平衡概念:
在一定条件(如温度、浓度一定)下,当弱电解质在水溶液中电离达到最大程度时,电离过程并没有停止,此时弱电解质电离成离子的速率和离子结合成弱电解质分子的速率相等,溶液中各分子和离子的浓度都不再发生变化,就达到了电离平衡。
探究2 电离平衡的特征
探究3 电离平衡常数和电离度
(1)电离平衡常数(K):
(2)电离度(α):
[必记结论]
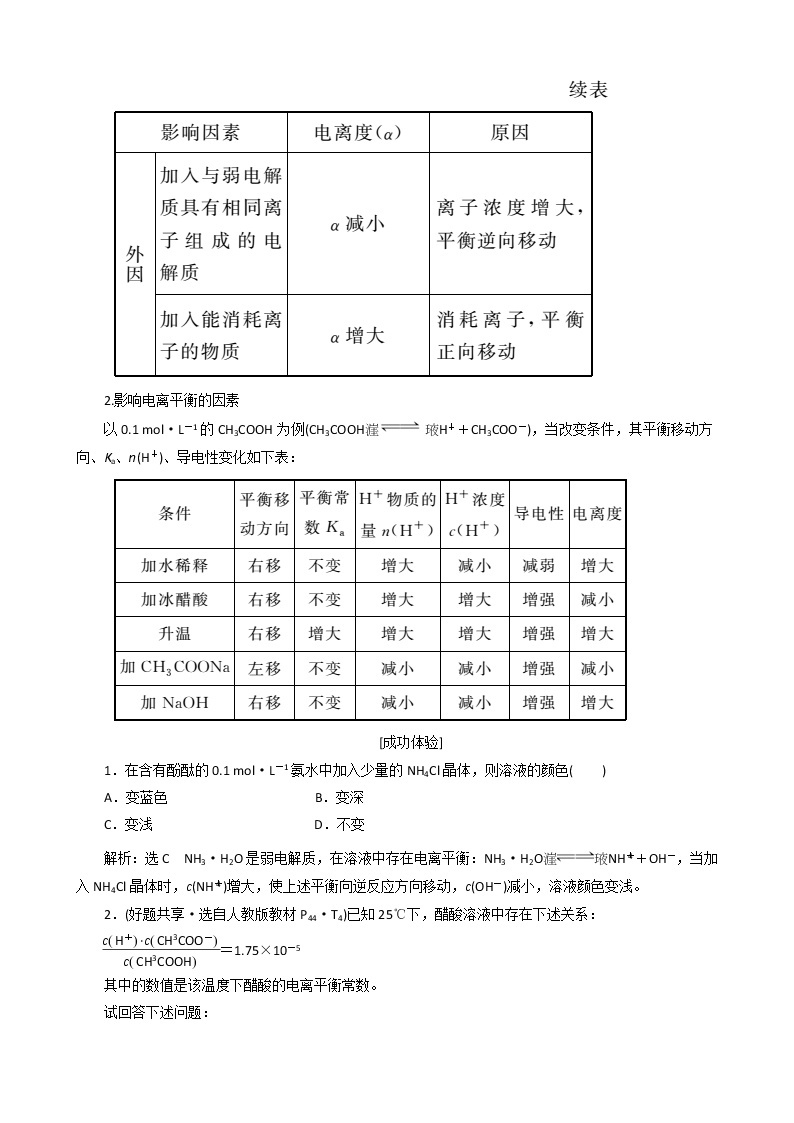
1.影响电离度的因素
2.影响电离平衡的因素
以0.1 ml·L-1的CH3COOH为例(CH3COOHH++CH3COO-),当改变条件,其平衡移动方向、Ka、n(H+)、导电性变化如下表:
[成功体验]
1.在含有酚酞的0.1 ml·L-1氨水中加入少量的NH4Cl晶体,则溶液的颜色( )
A.变蓝色 B.变深
C.变浅 D.不变
解析:选C NH3·H2O是弱电解质,在溶液中存在电离平衡:NH3·H2ONHeq \\al(+,4)+OH-,当加入NH4Cl晶体时,c(NHeq \\al(+,4))增大,使上述平衡向逆反应方向移动,c(OH-)减小,溶液颜色变浅。
2.(好题共享·选自人教版教材P44·T4)已知25℃下,醋酸溶液中存在下述关系:
eq \f(cH+·cCH3COO-,cCH3COOH)=1.75×10-5
其中的数值是该温度下醋酸的电离平衡常数。
试回答下述问题:
(1)当向该溶液中加入一定量的盐酸时,上式中的数值是否发生变化?为什么?
(2)若醋酸的起始浓度为0.010 ml/L,平衡时氢离子浓度c(H+)是多少?(提示:醋酸的电离常数很小,平衡时的c(CH3COOH)可近似视为仍等于0.010 ml/L。)
解析:设醋酸电离的物质的量浓度为c,则有
CH3COOH CH3COO-+H+
开始:0.010 ml·L-1 0 0
平衡:(0.010 ml·L-1-c) c c
≈0.010 ml·L-1(因电离非常微弱)
由题意知:eq \f(cH+·cCH3COO-,cCH3COOH)=1.75×10-5,
即eq \f(c·c,0.010)=1.75×10-5,c=4.18×10-4ml·L-1。
答案:(1)当加入盐酸时,醋酸的电离平衡常数不变。影响电离平衡常数的因素是温度,与溶液的酸碱性及浓度无关。
(2)c(H+)=4.18×10-4ml·L-1。
[新知探究]
探究1 水的电离和水的离子积常数
(1)水的电离:
水是一种弱电解质,存在如下形式电离:2H2OH3O++OH-,简写为:H2OH++OH-,水的电离常数表达式为:K=eq \f(cH+·cOH-,cH2O)
(2)水的离子积常数:
①表达式:KW=c(H+)·c(OH-),
②影响因素:水的离子积KW只受温度影响,升高温度,KW增大。
③适用范围:KW不仅适用于纯水,还适用于稀的酸性、碱性溶液,25℃时,水的离子积为1×10-14。
探究2 弱酸(或弱碱)的强弱与电离常数的关系
(1)常见的弱酸:HF、CH3COOH、HClO、HCN、H2CO3、H2SO3等。
(2)常见的弱碱:NH3·H2O等。
(3)常用电离常数表示弱酸、弱碱的相对强弱,电离常数越大,弱酸、弱碱的酸性或碱性越强。
[必记结论]
影响水的电离平衡的因素
[成功体验]
3.判断正误(正确的打“√”,错误的打“×”)。
(1)HCl溶液中无OH-。( )
(2)在稀NaOH溶液中:c(H+)·c(OH-)=1×10-14(25℃下)。( )
(3)升高温度,水的电离程度增大,c(H+)>c(OH-)。( )
(4)向水中加入NaHSO4固体,水的电离程度减小,KW减小。( )
解析:(1)任何物质的水溶液中都存在H2O的电离平衡,即都存在H+和OH-;(2)KW不仅适用于纯水,也适用于酸、碱、盐的稀水溶液;(3)升温后水的电离程度增大,但c(H+)始终等于c(OH-);(4)KW只与温度有关。
答案:(1)× (2)√ (3)× (4)×
4.[双选题]能抑制水的电离,并使溶液中c(H+)>c(OH-)的操作是( )
A.将水加热煮沸 B.向水中投入一小块金属钠
C.向水中通CO2 D.加入NaHSO4(s)
解析:选C、D 加热煮沸后,水的电离程度增大,但c(H+)=c(OH-);加入金属Na后水的电离程度增大,但c(OH-)>c(H+);通入CO2或加入NaHSO4(s)水的电离程度减小;
c(H+)>c(OH-)。
———————————————[关键语句小结]————————————————
1.三个计算式(1)电离常数:如醋酸电离常数为:Ka=eq \f(cCH3COO-cH+,cCH3COOH);
(2)水的离子积常数:KW=c(OH-)·c(H+),温度一定,KW一定,25℃时,KW=1.0×10-14。
(3)电离度:α=eq \f(c电离,c初始)×100%。
2.弱电解质的电离平衡也是一种动态平衡,影响电离平衡的因素有温度、浓度、酸、碱及相关离子等。其中升高温度、加水稀释均能使电离平衡右移。
3.电离常数和水的离子积常数是动态平衡常数,只受温度影响。相同条件下,弱酸的电离常数越大,酸性越强。
[例1] 在0.1 ml·L-1CH3COOH溶液中存在如下电离平衡:CH3COOHCH3COO-+H+,对于该平衡,下列叙述中,正确的是( )
A.加入水时,平衡向左移动
B.加入少量NaOH固体,平衡向右移动
C.加入少量0.1 ml·L-1HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
解析:选B 加水稀释,平衡向右移动,A错;加入NaOH固体,中和H+,平衡向右移动,B对;因为0.1 ml·L-1CH3COOH溶液中c(H+)<0.1 ml·L-1,而0.1 ml·L-1HCl溶液中c(H+)=0.1 ml·L-1,故使溶液中c(H+)增大,C错;加入少量CH3COONa固体,使
c(CH3COO-)增大,平衡向左移动,D错。
电离平衡属于化学平衡,可用勒夏特列原理分析弱电解质的电离平衡,促进弱电解质电离平衡向右移动的因素:①升温;②加水;③加入消耗弱电解质电离出离子的物质。
1.例1中,(1)若要使c(CH3COO-)增大,但c(H+)减小,可采取哪些措施?
(2)若要使c(H+)增大,且平衡向右移动,可采取哪些措施?加水稀释可以吗?
答案:(1)符合条件的措施应为消耗H+,促进平衡向正反应方向移动,故可加入铁粉,少量NaHCO3固体、CH3COONa固体等。
(2)可加热,促进平衡向右移动,c(H+)增大;加水稀释时,平衡向右移动,但c(H+)减小,不符合要求。
[例2] 已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:
NaCN+HNO2===HCN+NaNO2
NaCN+HF===HCN+NaF
NaNO2+HF===HNO2+NaF
由此可判断下列叙述不正确的是( )
A.K(HF)=7.2×10-4
B.K(HNO2)=4.9×10-10
C.相同条件下,HF的电离度最大
D.K(HCN)
K(HF)=7.2×10-4,K(HNO2)=4.6×10-4,
K(HCN)=4.9×10-10,又因为三者均为一元弱酸,故K越大,酸性越强,电离度越大。
电离常数的应用
(1)比较弱电解质的相对强弱。相同温度下,弱酸的Ka越大,则酸性越强,物质的量浓度相同时,c(H+)越大,电离度越大。
(2)比较计算多元弱酸溶液中c(H+)大小。多元弱酸是分步电离的,且K1≫K2≫K3,原因是第一步电离产生H+对第二步、第三步电离起到抑制作用,比较溶液中c(H+)大小时,只考虑第一步电离即可。
(3)Ka大的酸能与Ka小的酸的盐反应,反之不反应。
(4)计算电离度(以一元弱酸HA为例)
HAH+ + A-
起始: c酸 0 0
平衡: c酸(1-α) c酸·α c酸·α
K电离=eq \f(c酸·α2,c酸·1-α)=eq \f(c酸·α2,1-α),因为α很小,
所以(1-α)=1,即K电离=c酸·α2。
所以α=eq \r(\f(K电离,c酸))。
2.例2中,(1)若相同条件下HA的电离常数为1.8×10-5,判断HCN+NaA===HA+NaCN正确吗?
(2)据该题中判断出的HCN的电离常数计算该条件下0.1 ml·L-1的HCN的电离度。
答案:(1)不正确,因电离常数HA>HCN,酸性HA>HCN,故该反应不能进行。
(2)α=eq \r(\f(K电离,c酸))=eq \r(\f(4.9×10-10,0.1))=7×10-5=7×10-3%。
(1)中性溶液:c(H+)=c(OH-)=1×10-7 ml·L-1。
(2)溶质为酸的溶液:H+来源于酸和水的电离,而OH-只来源于水,c(H+)水=c(OH-)。如0.1 ml·L-1的HCl溶液中c(H+)水=c(OH-)=1×10-13 ml·L-1。
(3)溶质为碱的溶液:OH-来源于碱和水的电离,而H+只来源于水。c(OH-)水=c(H+)。如0.1 ml·L-1的NaOH溶液中c(H+)=c(OH-)水=1×10-13 ml·L-1。
[例3] (四川高考改编)25 ℃时,在等体积的
①0.5 ml/L的H2SO4溶液中,②0.05 ml/L Ba(OH)2溶液中,③1 ml/L NaCl溶液中,
④纯水中发生电离的水的物质的量之比是( )
A.1∶10∶107∶107 B.107∶107∶1∶1
C.107∶106∶2∶2 D.107∶106∶2×107∶2
解析:选A 25 ℃时,0.5 ml/L H2SO4溶液中c(H+)=1 ml/L,由水电离出的c(H+)水=10-14 ml/L,0.05 ml/L Ba(OH)2溶液中,c(OH-)=0.1 ml/L,由水电离出的c(H+)水=10-13 ml/L,NaCl和纯水中由水电离出的c(H+)水均为10-7 ml/L。则等体积的上述四种溶液中由水电离出的n(H+)(即电离水的物质的量)之比为10-14∶10-13∶10-7∶10-7=1∶10∶107∶107。
25℃时,0.01 ml·L-1 的H2SO4溶液中,由水电离出的c(H+)是( )
A.0.01 ml·L-1
B.0.02 ml·L-1
C.1×10-12 ml·L-1
D.5×10-13 ml·L-1
解析:选D H2SO4电离出的c(H+)=0.02 ml·L-1,故溶液中c(H+)水=c(OH-)水=eq \f(1×10-14,0.02)=5×10-13 ml·L-1。
[课堂双基落实]
1.下列有关“电离平衡”的叙述中正确的是( )
A.电解质在溶液里达到电离平衡时,各种分子的浓度和离子的浓度相等
B.电离平衡时,由于各种分子和离子的浓度不断发生变化,所以说电离平衡是动态平衡
C.电离平衡是相对的、暂时的,外界条件改变时,平衡就会发生移动
D.电解质达到电离平衡后,各种离子的浓度相等
解析:选C 电离达到平衡时,各种分子的浓度和离子的浓度不一定相等,A错;各种分子和离子的浓度一定,并不是不断发生变化,B错;各种离子的浓度不一定相等,D错。
2.稀释0.1 ml/L的醋酸溶液时,始终保持增大趋势的是( )
A.c(H+)
B.c(H+)/c(CH3COOH)
C.c(H+)/c(CH3COO-)
D.c(CH3COOH)/c(H+)
解析:选B 稀释时平衡向电离的方向移动,n(H+)增大,n(CH3COOH)减小,eq \f(nH+,nCH3COOH)=eq \f(cH+,cCH3COOH),所以B正确。
3.能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是( )
A.向水中投入一小块金属钠
B.将水加热煮沸
C.向水中通入二氧化硫气体
D.向水中加食盐晶体
解析:选C A项加金属钠跟水反应生成NaOH,c(OH-)>c(H+),错误;B项加热促进水的电离,但c(H+)=c(OH-),错误;D项对水的电离平衡没有影响,c(H+)=c(OH-),错误。
4.关于水的离子积常数,下列说法不正确的是( )
A.蒸馏水中,c(H+)·c(OH-)=1×10-14
B.纯水中,25 ℃时,c(H+)·c(OH-)=1×10-14
C.25 ℃时,任何以水为溶剂的稀溶液中,
c(H+)·c(OH-)=1×10-14
D.KW值随温度升高而增大
解析:选A KW只与温度有关,升高温度,KW增大,25 ℃时,纯水和任何物质的水溶液中KW=c(H+)·c(OH-)=1×10-14。
5.将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为__________。经测定溶液中含CH3COO-为1.4×10-3 ml·L-1,此温度下醋酸的电离常数Ka=__________。温度升高,Ka将________(填“变大”“不变”或“变小”)。
解析:c(CH3COOH)=eq \f(6 g,60 g·ml-1×1 L)
=0.1 ml·L-1。
因为 CH3COOH CH3COO-+H+
起始/ml·L-1 0.1 0 0
平衡/ml·L-1 0.1-1.4×10-3 1.4×10-3 1.4×10-3
所以Ka=eq \f(cCH3COO-·cH+,cCH3COOH)
=eq \f(1.4×10-3×1.4×10-3,0.1-1.4×10-3)≈1.96×10-5。
答案:0.1 ml·L-1 1.96×10-5 变大
苏教版选修5 有机化学基础第一单元 卤代烃教学设计: 这是一份苏教版选修5 有机化学基础第一单元 卤代烃教学设计,共16页。
高中化学苏教版选修4 化学反应原理第三单元 化学平衡的移动教案: 这是一份高中化学苏教版选修4 化学反应原理第三单元 化学平衡的移动教案,共13页。
高中化学苏教版选修5 有机化学基础专题1 认识有机化合物第一单元 有机化学的发展与应用教学设计: 这是一份高中化学苏教版选修5 有机化学基础专题1 认识有机化合物第一单元 有机化学的发展与应用教学设计,共8页。