
人教版 (2019)必修 第一册第一节 铁及其化合物学案
展开课时1 铁的单质、氧化物和氢氧化物
发 展 目 标 | 体 系 构 建 |
1.了解铁的存在、应用、认识、应用铁的化学史,增强文化自信,培养学生“社会责任与科学精神”的核心素养。 2.能用氧化还原反应原理认识铁的化学性质,同时根据实验事实探究Fe与H2O(g)的反应,培养学生“实验探究与证据推理”的核心素养。 3.通过物质的属类和实验探究铁的氧化物和氢氧化物的主要性质和Fe(OH)2的制备探究,培养学生“科学探究与宏观辨识”的核心素养。 |
一、铁的单质
1.铁元素的存在
铁元素在地壳中的含量仅次于氧、硅和铝,居第四位,主要是以+2价和+3价化合物的形态存在于矿石中。
2.铁的冶炼
(1)铁是目前产量最大,使用最广泛的金属。春秋初年,我国已掌握冶铁技术。
(2)工业炼铁的原理是用还原方法把铁从铁矿石中提炼出来。高炉炼铁是用CO还原铁矿石(如Fe2O3)的化学方程式为Fe2O3+3CO2Fe+3CO2。
3.物理性质
铁有延展性和导热性。铁能导电,但其导电性不如铜和铝。铁能被磁体吸引。
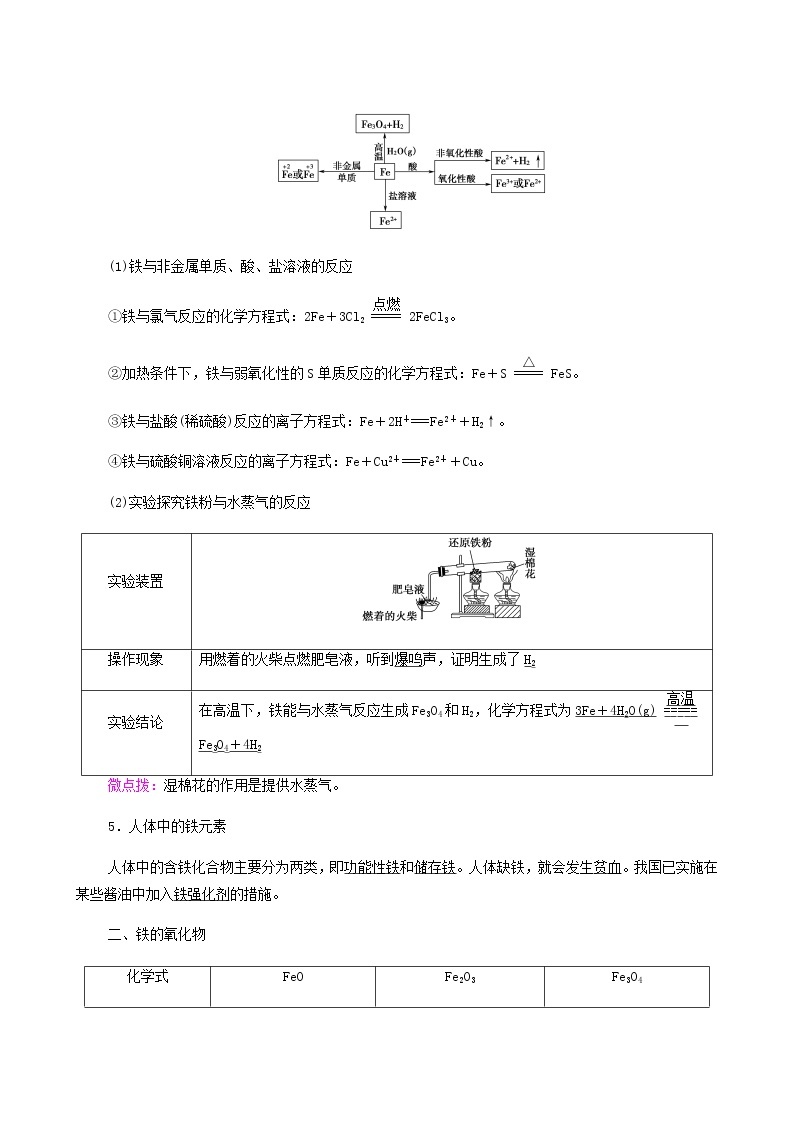
4.铁的化学性质
铁的化学性质比较活泼,有较强的还原性,主要化合价为+2价和+3价。
(1)铁与非金属单质、酸、盐溶液的反应
①铁与氯气反应的化学方程式:2Fe+3Cl22FeCl3。
②加热条件下,铁与弱氧化性的S单质反应的化学方程式:Fe+SFeS。
③铁与盐酸(稀硫酸)反应的离子方程式:Fe+2H+===Fe2++H2↑。
④铁与硫酸铜溶液反应的离子方程式:Fe+Cu2+===Fe2++Cu。
(2)实验探究铁粉与水蒸气的反应
实验装置 | |
操作现象 | 用燃着的火柴点燃肥皂液,听到爆鸣声,证明生成了H2 |
实验结论 | 在高温下,铁能与水蒸气反应生成Fe3O4和H2,化学方程式为3Fe+4H2O(g)Fe3O4+4H2 |
微点拨:湿棉花的作用是提供水蒸气。
5.人体中的铁元素
人体中的含铁化合物主要分为两类,即功能性铁和储存铁。人体缺铁,就会发生贫血。我国已实施在某些酱油中加入铁强化剂的措施。
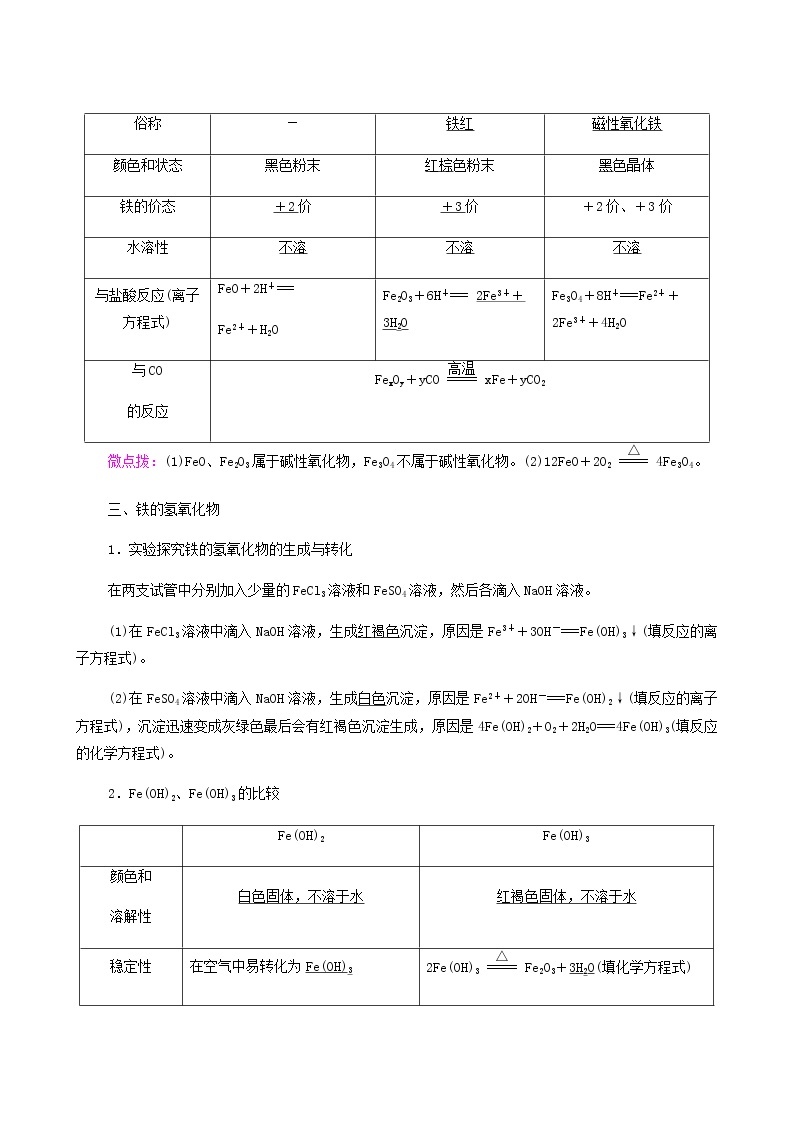
二、铁的氧化物
化学式 | FeO | Fe2O3 | Fe3O4 |
俗称 | - | 铁红 | 磁性氧化铁 |
颜色和状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
铁的价态 | +2价 | +3价 | +2价、+3价 |
水溶性 | 不溶 | 不溶 | 不溶 |
与盐酸反应(离子方程式) | FeO+2H+=== Fe2++H2O | Fe2O3+6H+=== 2Fe3++3H2O | Fe3O4+8H+===Fe2++2Fe3++4H2O |
与CO 的反应 | FexOy+yCOxFe+yCO2 | ||
微点拨:(1)FeO、Fe2O3属于碱性氧化物,Fe3O4不属于碱性氧化物。(2)12FeO+2O24Fe3O4。
三、铁的氢氧化物
1.实验探究铁的氢氧化物的生成与转化
在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。
(1)在FeCl3溶液中滴入NaOH溶液,生成红褐色沉淀,原因是Fe3++3OH-===Fe(OH)3↓(填反应的离子方程式)。
(2)在FeSO4溶液中滴入NaOH溶液,生成白色沉淀,原因是Fe2++2OH-===Fe(OH)2↓(填反应的离子方程式),沉淀迅速变成灰绿色最后会有红褐色沉淀生成,原因是4Fe(OH)2+O2+2H2O===4Fe(OH)3(填反应的化学方程式)。
2.Fe(OH)2、Fe(OH)3的比较
| Fe(OH)2 | Fe(OH)3 |
颜色和 溶解性 | 白色固体,不溶于水 | 红褐色固体,不溶于水 |
稳定性 | 在空气中易转化为Fe(OH)3 | 2Fe(OH)3Fe2O3+3H2O(填化学方程式) |
与盐酸 反应 | Fe(OH)2+2H+===Fe2++2H2O | Fe(OH)3+3H+===Fe3++3H2O |
1.判断正误(正确的打“√”,错误的打“×”)
(1)Fe在空气中燃烧生成黑色的Fe2O3。 ( )
(2)Fe与所有酸可以反应均生成Fe3+。 ( )
(3)FeO、Fe2O3、Fe3O4均为碱性氧化物。 ( )
(4)Fe(OH)2易转化为Fe(OH)3,表现强氧化性。 ( )
[答案] (1)× (2)× (3)× (4)×
2.下列关于铁与水蒸气反应的说法中不正确的是( )
A.反应中有氢气产生
B.此反应需在高温条件下才能发生
C.生成的铁的化合物中铁全部呈+3价
D.该反应中水作氧化剂
[答案] C
3.下列物质与铁反应只生成+2价铁化合物的是________(填序号)
①稀硫酸 ②CuCl2溶液 ③Cl2 ④S ⑤O2 ⑥H2O(g)
[答案] ①②④
铁的主要性质归纳 |
1.Fe与所有酸反应均生成Fe2+吗?请分析。
[答案] Fe与一般酸(如HCl、稀硫酸、CH3COOH等)反应生成Fe2+与H2,Fe与强氧化性酸(如HNO3)反应可以生成Fe3+,不能放出H2。
2.如下图所示
(1)实验时,是先加热湿棉花还是先加热还原铁粉?
(2)点燃肥皂液时有什么现象?
(3)该实验中湿棉花的作用是什么?
[答案] (1)先加热湿棉花,让水蒸气充满装置。
(2)爆鸣声,也可能燃烧。
(3)提供水蒸气。
1.铁的主要性质
(1)Fe
(2)Fe
(3)FeFe3O4
2.铁与H2O(g)反应应注意
(1)实验结束时,先将导气管撤出,再移动酒精灯,以防止倒吸。
(2)铁不能与冷水、热水反应,但高温下能与水蒸气反应。
(3)铁与水蒸气反应的实验中,湿棉花的作用是加热时产生水蒸气。
1.在一定条件下,铁与有关物质的反应,所得产物错误的是( )
A.FeFeCl3 B.FeFeS
C.FeFe(OH)3 D.FeFe3O4
C [Cl2是强氧化剂,可将Fe氧化成FeCl3,故A正确;S是弱氧化剂,可将Fe氧化成FeS,故B正确;Fe与H2O(g)反应生成Fe3O4,而不是Fe(OH)3,故C错误;Fe在O2中燃烧生成Fe3O4,故D正确。]
2.用如图所示装置进行Fe与水蒸气反应的实验,下列有关说法不正确的是( )
A.装置A的作用是为实验提供持续不断的水蒸气
B.装置B中反应的化学方程式是2Fe+3H2O(g)Fe2O3+3H2
C.装置C中加入的固体干燥剂可能是碱石灰
D.点燃装置D处的气体前必须检验气体的纯度
B [装置A是将液态H2O转化为气态,与装置B中的铁粉在高温下发生反应,A项正确;铁粉与H2O(g)在高温下发生反应,生成Fe3O4和H2,B项错误;因生成的H2中含有较多的水蒸气,故需要用碱石灰等不与H2反应的干燥剂进行干燥,C项正确;不纯的H2在点燃时可能会发生爆炸,故在点燃H2前必须检验其纯度,D项正确。]
Fe(OH)2的性质及其制备 |
1.向FeSO4溶液中滴加NaOH溶液,生成的白色沉淀迅速变为灰绿色,不能得到白色沉淀Fe(OH)2,为什么?
[答案] Fe(OH)2具有强还原性,遇O2被氧化。
2.实验室要制取Fe(OH)2,关键是什么?
[答案] 关键是避免生成的Fe(OH)2接触O2。
1.防止Fe(OH)2被氧化的方法
(1)将配制溶液的蒸馏水煮沸,除去其中的氧气。
(2)将盛有NaOH溶液的胶头滴管尖端插入试管内的亚铁盐溶液底部,并慢慢挤出NaOH溶液。
(3)在亚铁盐溶液上面充入保护气,如H2、N2、稀有气体等。
(4)在亚铁盐溶液上面加保护层,如苯、植物油等。
2.实验装置的改进
【典例】 如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6 mol·L-1的硫酸,其他试剂任选。
填写下列空白:
(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是________,A中反应的离子方程式是_________________________。
(2)实验开始时先将止水夹E________(填“打开”或“关闭”),C中收集到气体的主要成分是________。
(3)简述生成Fe(OH)2的操作过程:_________________。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:__________________________________。
[解析] 实验开始时先打开止水夹E,让生成的H2把A、B装置中的空气排出,让Fe(OH)2在H2气氛中生成,以便较长时间观察Fe(OH)2的颜色。H2充满B后关闭止水夹E,A中的FeSO4溶液沿竖直长导管进入B瓶,与NaOH反应。
[答案] (1)铁屑 Fe+2H+===Fe2++H2↑ (2)打开 H2 (3)关闭止水夹E,A中压强增大,把FeSO4溶液压入B瓶中进行反应 (4)4Fe(OH)2+O2+2H2O===4Fe(OH)3
3.实验室用FeCl2和烧碱制备Fe(OH)2,为了使生成的产物不容易被氧化,下列说法不正确的是( )
A.配制FeCl2溶液和烧碱溶液所用的蒸馏水通常要煮沸
B.可在FeCl2溶液的上面加一层苯,以隔绝空气
C.向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入溶液内
D.产生Fe(OH)2沉淀后,不能振荡试管
C [A对,FeCl2溶液和烧碱溶液要现用现配,且配制溶液的蒸馏水要煮沸以除去氧气,确保Fe(OH)2在无氧环境中生成。B对,在FeCl2溶液的上面加一层苯或一层油,以隔绝空气。C错,向FeCl2溶液中滴加烧碱溶液时,要将胶头滴管的尖嘴伸入FeCl2溶液中,防止氢氧化钠溶液在滴入时接触空气而溶有氧气。D对,产生Fe(OH)2沉淀后,若振荡试管,会增大沉淀与空气接触的机会,使沉淀更易被氧化。]
4.在如图所示装置中,用不含O2的NaOH溶液、铁屑和稀硫酸制备。
(1)在试管Ⅰ中加入的试剂是_______________。
(2)在试管Ⅱ中加入的试剂是____________。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和试管Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是______________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_____________________________________________________。
[解析] 试管Ⅱ是开口式的,无法利用产生的气体将溶液压入试管Ⅰ中,所以制取FeSO4应在试管Ⅰ中进行,而在试管Ⅱ中应加入不含O2的NaOH溶液。当把Fe与稀硫酸放入试管Ⅰ后,产生的H2可通过试管Ⅰ内的短导管排出试管Ⅰ内的空气,然后经过止水夹进入试管Ⅱ中,再排尽试管Ⅱ内的空气。最后关闭止水夹,试管Ⅰ内产生的H2无法逸出,H2产生的压强将试管Ⅰ内生成的FeSO4溶液通过长导管压入试管Ⅱ内,在此过程中,液体都处于H2氛围中,从而避免了溶解在溶液中的O2将反应生成的Fe(OH)2氧化成Fe(OH)3。
[答案] (1)稀硫酸、铁屑 (2)不含O2的NaOH溶液 (3)检验试管Ⅱ出口处排出的H2的纯度,当排出的H2纯净时,再夹紧止水夹 (4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入装置
1.常温下,将铁片放入下列溶液中,不发生反应的是( )
A.稀硫酸 B.氯水
C.氢氧化钠溶液 D.硫酸铜溶液
C [铁与稀硫酸反应:Fe+H2SO4===FeSO4+H2↑;氯水呈酸性、强氧化性可以和铁反应; 铁与硫酸铜发生置换反应:Fe+CuSO4===FeSO4+Cu;铁与氢氧化钠溶液不发生反应,C项符合题意。]
2.下列说法正确的是( )
A.铁与酸反应一定生成盐和氢气
B.铁与氯气反应的产物与二者的量有关
C.铁的氧化物属于金属氧化物,也属于碱性氧化物
D.铁与水蒸气在高温下的反应属于置换反应,故一定是氧化还原反应
D [Fe与盐酸、稀硫酸等非氧化性酸反应生成盐和H2,但与HNO3等氧化性酸反应不产生H2,A项错误;Fe与Cl2在加热时反应生成FeCl3,与二者的量无关,B项错误;Fe3O4是金属氧化物,但不符合碱性氧化物的定义,故不属于碱性氧化物,C项错误;置换反应一定属于氧化还原反应,D项正确。]
3.下列关于铁的氧化物说法错误的是( )
A.铁的氧化物在通常状况下都是有色固体
B.四氧化三铁是一种复杂的铁的氧化物,它与盐酸反应后的溶液中同时存在Fe2+和Fe3+
C.氧化铁是铁锈的主要成分,因此氧化铁俗称铁锈
D.工业上常使用铁的氧化物作原料冶炼铁
C [铁的氧化物在通常状况下都是有色固体,如氧化铁是红棕色固体,氧化亚铁和四氧化三铁都是黑色固体,故A正确;四氧化三铁是一种复杂的铁的氧化物,可看作是由FeO、Fe2O3组成的化合物,它与盐酸反应后的溶液中同时存在Fe2+和Fe3+,B正确;铁锈的主要成分Fe2O3·xH2O,故C错误;工业上常使用铁的氧化物作原料,用一氧化碳冶炼铁,故D正确。]
4.将一小块钠投入盛5 mL FeCl2的试管里,不可能观察到的现象是( )
A.钠熔成小球并在液面上游动
B.有无色无味的气体生成
C.溶液底部有银白色物质生成
D.溶液中产生的沉淀最终为红褐色
C [钠与水反应生成氢氧化钠和氢气,反应放热,钠密度小于水,所以钠熔成小球并在液面上游动,氢氧化钠与FeCl2溶液反应最终生成红褐色氢氧化铁。]
5.(素养题)应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”。
请回答该实验中的问题。
(1)实验开始首先进行的操作为_______________。
(2)硬质玻璃管中发生反应的化学方程式为_____________。
(3)圆底烧瓶中盛装的是水,该装置受热后的主要作用是_____________________________________________________;
烧瓶底部放置了几片碎瓷片,碎瓷片的作用是_____________________________________。
(4)酒精灯和酒精喷灯点燃的顺序是________________。
(5)干燥管中盛装的物质可以是________,作用是_________________________________________________________。
(6)如果要在A的玻璃导管口处点燃该气体,则必须对该气体进行________,这一操作的目的是______________________。
[解析] (1)为了防止漏气,实验开始首先检查气密性。(4)点燃加热仪器的顺序要考虑实验的安全性和对实验结果的影响,在本实验中为了防止铁与空气中的氧气在加强热的条件下反应,应该先点燃酒精灯,产生水蒸气后,再点燃酒精喷灯。(5)干燥管中盛装的物质可以是碱石灰,作用是除去反应产生的氢气中的水蒸气。
[答案] (1)检查装置气密性 (2)3Fe+4H2O(g)Fe3O4+4H2 (3)为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气 防止暴沸 (4)先点燃酒精灯,产生水蒸气后,再点燃酒精喷灯 (5)碱石灰 除去产物H2中的水蒸气 (6)验纯 防止H2不纯而发生爆炸
人教版 (2019)必修 第一册第一节 铁及其化合物学案设计: 这是一份人教版 (2019)必修 第一册第一节 铁及其化合物学案设计,共12页。
【暑假初升高】人教版化学初三(升高一)暑假预习-第13讲 铁的单质 氧化物和氢氧化物 讲学案: 这是一份【暑假初升高】人教版化学初三(升高一)暑假预习-第13讲 铁的单质 氧化物和氢氧化物 讲学案,文件包含暑假初升高人教版化学初三升高一暑假预习-第13讲铁的单质氧化物和氢氧化物解析版docx、暑假初升高人教版化学初三升高一暑假预习-第13讲铁的单质氧化物和氢氧化物原卷版docx等2份学案配套教学资源,其中学案共32页, 欢迎下载使用。
高中化学人教版 (2019)必修 第一册第一节 铁及其化合物第1课时学案设计: 这是一份高中化学人教版 (2019)必修 第一册第一节 铁及其化合物第1课时学案设计,文件包含第3章第1节第1课时铁的单质氧化物和氢氧化物学案教师版2022-2023学年高一化学人教版2019必修第一册docx、第3章第1节第1课时铁的单质氧化物和氢氧化物学案学生版2022-2023学年高一化学人教版2019必修第一册docx等2份学案配套教学资源,其中学案共20页, 欢迎下载使用。













