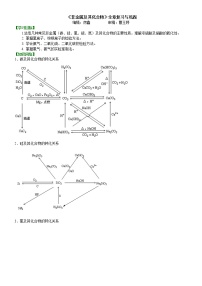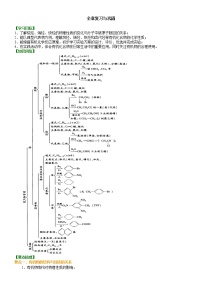


高中化学第三章 金属及其化合物综合与测试导学案
展开《金属及其化合物》全章复习与巩固
编稿:宋杰 审稿:曹玉婷
【学习目标】
1、了解钠、铝、铁、铜等金属及其重要化合物的主要性质;
2、通过金属及其化合物性质的实验,培养实验意识、操作技能、观察能力和分析问题的能力;
3、以金属知识的学习为线索,培养获取知识及信息加工的能力。通过比较、归纳等,逐步掌握学习元素化合物的一般方法。
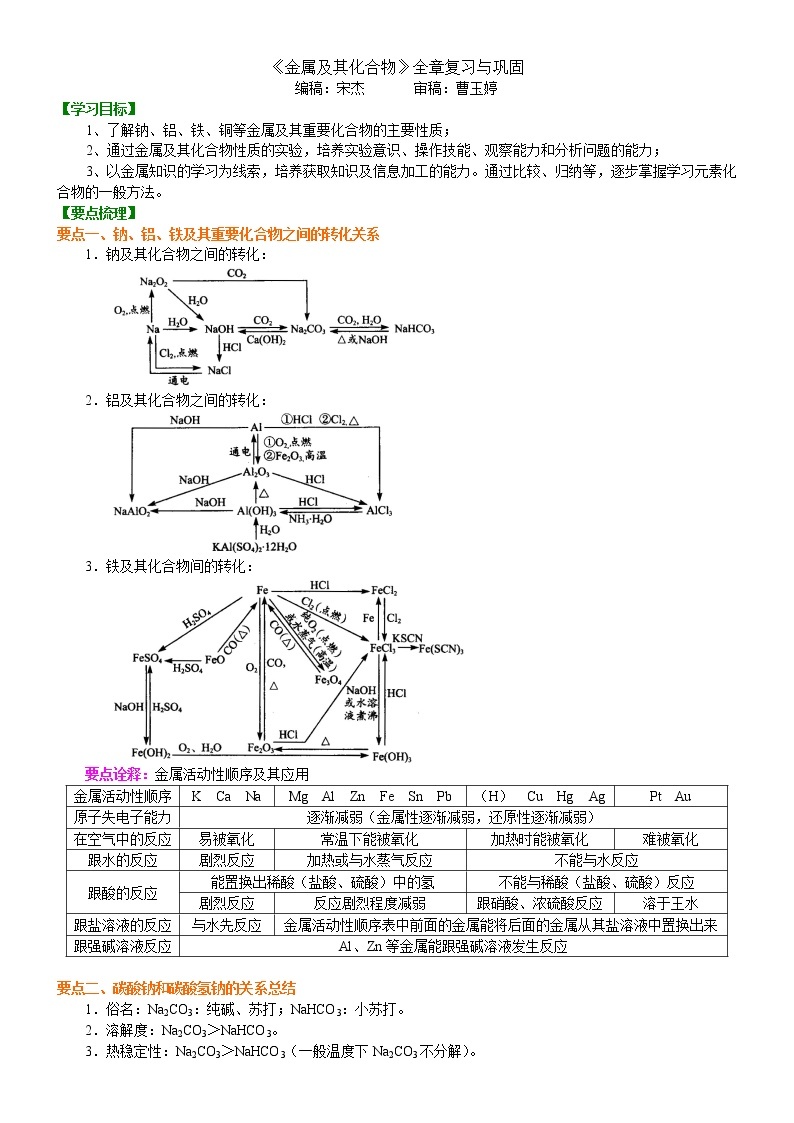
【要点梳理】
要点一、钠、铝、铁及其重要化合物之间的转化关系
1.钠及其化合物之间的转化:
2.铝及其化合物之间的转化:
3.铁及其化合物间的转化:
要点诠释:金属活动性顺序及其应用
金属活动性顺序 | K Ca Na | Mg Al Zn Fe Sn Pb | (H) Cu Hg Ag | Pt Au |
原子失电子能力 | 逐渐减弱(金属性逐渐减弱,还原性逐渐减弱) | |||
在空气中的反应 | 易被氧化 | 常温下能被氧化 | 加热时能被氧化 | 难被氧化 |
跟水的反应 | 剧烈反应 | 加热或与水蒸气反应 | 不能与水反应 | |
跟酸的反应 | 能置换出稀酸(盐酸、硫酸)中的氢 | 不能与稀酸(盐酸、硫酸)反应 | ||
剧烈反应 | 反应剧烈程度减弱 | 跟硝酸、浓硫酸反应 | 溶于王水 | |
跟盐溶液的反应 | 与水先反应 | 金属活动性顺序表中前面的金属能将后面的金属从其盐溶液中置换出来 | ||
跟强碱溶液反应 | Al、Zn等金属能跟强碱溶液发生反应 | |||
要点二、碳酸钠和碳酸氢钠的关系总结
1.俗名:Na2CO3:纯碱、苏打;NaHCO3:小苏打。
2.溶解度:Na2CO3>NaHCO3。
3.热稳定性:Na2CO3>NaHCO3(一般温度下Na2CO3不分解)。
4.其固体跟同浓度的盐酸反应产生气体的速率:Na2CO3<NaHCO3。
5.将稀盐酸逐滴加入到Na2CO3、NaHCO3的水溶液中,发生的反应与现象分别为:
Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=CO2↑+H2O+NaCl。
现象:开始无气体产生,盐酸滴加一定量后(Na2CO3全部转化为NaHCO3),才开始产生气体。
NaHCO3溶液:NaHCO3+HCl=CO2↑+H2O+NaCl。
现象:立即产生气体。
说明:该方法可用于鉴别Na2CO3与NaHCO3的水溶液。
6.除杂(括号内为杂质)
Na2CO3(NaHCO3):加热即可。
NaHCO3(Na2CO3):将混合物溶于水后通入足量CO2气体(Na2CO3+CO2+H2O=2NaHCO3),然后将溶液低温蒸干即得NaHCO3晶体。
要点三、铝三角中的图像及其相互转化问题
铝元素有三种存在形式:它们之间的转化关系可用铝三角表示为:
在Al3+、Al(OH)3、AlO2-的相互转化反应中,都有特定的数量关系。用坐标图形式可把其中的定量关系概括如下。
1.向AlCl3溶液中滴加氨水至过量,离子方程式为:
Al3++3NH3·H2O=Al(OH)3↓+3NH4+。
图像如下图所示
2.向AlCl3溶液中滴加NaOH至过量,离子方程式为:
Al3++3OH-=Al(OH)3↓,
Al(OH)3+OH-=AlO2-+2H2O。
图像如下图所示
3.KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量。离子方程式为:
Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O。
图像如下图所示。
要点诠释:图像题是考查铝的一类重要题型,在解答此类试题时,应该数形结合,综合分析计算进而求出答案。而要对化学图像进行分析,应该抓住有关化学原理、物质的性质和图像的意义,尤其是图像的特点,即图像的四点(起点、交点、拐点、终点)。
要点四、离子的鉴别
1.Fe2+、Fe3+的鉴别。
(1)KSCN法:加入KSCN或其他可溶性硫氰化物溶液,呈红色的是Fe3+的溶液,而Fe2+的溶液无此现象。离子方程式为Fe3++3SCN-=Fe(SCN)3。
要点诠释:此处是溶液而不是沉淀,不能用于除杂。若要除杂,Fe2+(Fe3+)可加铁粉,Fe3+(Fe2+)可加H2O2、O3。
(2)观察法:其溶液呈黄色的是Fe3+,呈浅绿色的是Fe2+。
(3)碱液法:加入氨水等碱液,生成红褐色沉淀的是Fe3+;生成白色沉淀并迅速变成灰绿色,最后变成红褐色沉淀的是Fe2+。
(4)淀粉KI试纸法:能使淀粉碘化钾试纸变蓝的是Fe3+溶液,无明显现象的是Fe2+。
2.焰色反应注意事项。
(1)蘸取待测物的金属丝:铂丝或铁、铬、钨丝等,因为它们在火焰上灼烧无颜色,同时熔点高,不易被氧化。
(2)焰色反应所用火焰本身颜色要浅,否则会干扰实验的观察。采用煤气灯较理想,若用酒精灯,则要使用其外焰的侧面。
(3)金属丝使用前用稀盐酸将其表面的氧化物洗净,然后在火焰上灼烧至无颜色,这是因为金属氯化物灼烧时易气化而挥发,以除去能起焰色反应的少量杂质。
(4)操作步骤:可归纳为六个字:即:洗→烧→蘸→烧→洗→烧。
要点五、金属及其化合物推断题常见的突破口
1、特殊颜色
(1)焰色反应:Na+(黄色)、K+(紫色)
(2)有色溶液
含有的离子 | Fe2+ | Fe3+ | Cu2+ | MnO4- |
颜色 | 浅绿色 | 黄色 | 蓝色 | 紫红色 |
(3)有色固体
红色:Cu、Fe2O3(红棕色)
红褐色:Fe(OH)3
绿色:Cu2(OH)2CO3、FeSO4·7H2O
蓝色:Cu(OH)2、CuSO4·5H2O
黑色:CuO、FeO、MnO2、炭黑
浅黄色:Na2O2、AgBr
白色:Fe(OH)2、CaCO3、BaSO4、AgCl、Al(OH)3、Mg(OH)2
2、特殊性质
(1)在一定条件下能漂白有色物质的淡黄色固体只有Na2O2。
(2)遇SCN-显红色的只有Fe3+。
(3)常见的可溶于NaOH溶液的白色沉淀有Al(OH)3,可溶于NaOH溶液的金属氧化物有Al2O3。
(4)不溶于水又不溶于稀盐酸或稀硝酸的化合物有:BaSO4(白色)、AgCl(白色)。
3、特征反应
(1)能与强酸反应产生气体的物质:活泼的金属,如Na、Al、Zn等;不稳定的弱酸盐,如碳酸盐、碳酸氢盐等。
(2)能与强碱反应产生气体的物质:单质,如Al等;盐类,如铵盐等。
(3)既能与强酸又能与强碱溶液反应的物质:金属单质,如Al等;两性氧化物,如Al2O3等;两性氢氧化物,如Al(OH)3等;弱酸的铵盐,如NH4HCO3、(NH4)2CO3等;弱酸的酸式盐,如NaHCO3、KHS等。
(4)能与水反应产生气体的物质:活泼的金属单质,如Na、K、Mg(加热)、Fe(高温生成Fe3O4)等;金属过氧化物,如Na2O2等。
4、特殊的转换关系
(1)特征转换:
如NaNa2ONa2O2NaOH
(2)三角转换
【典型例题】
类型一:金属及金属材料
例1 铁和铁合金是生活中常用的材料。下列说法正确的是( )。
A.不锈钢是铁合金,只含金属元素
B.一定条件下,铁粉可与水蒸气反应
C.铁与盐酸反应,铁合金不与盐酸反应
D.在空气中,铁板比镀锌铁板更耐腐蚀
【思路点拨】铁虽然不能跟冷水甚至热水反应,但在高温下可以和水蒸气反应生成Fe3O4,3Fe+4H2O(g)Fe3O4+4H2。
【答案】B
【解析】不锈钢中除含金属元素外,还含有C、Si等非金属元素;在高温条件下,Fe和水蒸气发生反应生成Fe3O4和H2;铁和铁合金均和盐酸发生反应;镀锌铁由于锌比铁活泼,锌首先失电子,将铁板保护,因此铁板比镀锌板易被腐蚀,因此只有B正确。
【总结升华】金属材料的性质和合金是常见的考点,在学习过程中要重点了解。
举一反三:
【变式1】下列关于地壳中含量最多的金属元素与地壳中含量最多的非金属元素的说法中,不正确的是( )
A.题中所指的元素分别是Al和O
B.题中所指的元素分别是Fe和O
C.这两种元素组成的化合物的相对分子质量是102
D.这两种元素组成的化合物能与酸反应
【答案】B
【解析】地壳中含量最多的金属元素与地壳中含量最多的非金属元素分别为Al和O,它们所形成的化合物的化学式是Al2O3,其相对分子质量是102,Al2O3能与酸反应。
类型二:金属及其化合物的性质
例2 现有浓度各为1 mol·L-1的FeCl3、FeCl2、CuCl2混合溶液100 mL,加入一定量的铁粉,按下列情况填空。
(1)反应完毕后,铁粉有剩余。
①反应完毕后,溶液中一定含有________阳离子,为________mol,一定没有________阳离子;
②固体物质干燥后,其中一定有________,与反应前加入铁粉的质量相比________(填“多”或“少”)________g。
(2)反应完毕后,有铜生成,铁粉无剩余。则反应完毕后溶液中一定含有________阳离子,该阳离子在溶液中的物质的量的范围是________。
【思路点拨】溶液中三种阳离子的氧化性顺序为:Fe3+>Cu2+>Fe2+,所以加入铁粉时,反应的顺序为:Fe+2Fe3+=3Fe2+ Fe+Cu2+=Fe2++Cu,然后再展开讨论各种量的关系。
【答案】(1)①Fe2+ 0.35 Fe3+、Cu2+ ②Fe、Cu 少 2
(2)Fe2+ 0.25 mol<n (Fe2+)≤0.35 mol
【解析】(1)当铁粉有剩余时,说明溶液中Fe3+、Cu2+都全部被转化为Fe2+,其中由Fe3+转化生成的Fe2+为0.15 mol,由Cu2+转化生成的Fe2+为0.1 mol,原溶液中含Fe2+为0.1 mol,所以反应完毕后,溶液中共有Fe2+ 0.35 mol。此过程共溶解铁粉,而生成的铜0.1mol×64 g·mol-1=6.4g,所以与反应前加入的铁粉对比,共减少了8.4 g-6.4 g=2 g。
(2)反应完毕后有铜生成、无铁粉剩余时,说明Fe3+已全部反应完毕,而Cu2+可能部分被还原,也可能恰好全部被还原。所以溶液中一定会含有Fe2+,最少时为Fe3+恰好反应时,为0.1 mol+0.1 mol×=0.25 mol,最多时为Cu2+恰好完全反应时,为0.1 mol+0.25 mol=0.35 mol,所以其范围为0.25 mol<n(Fe2+)≤0.35 mol(由于必须有铜生成,所以0.25 mol取不到)。
【总结升华】铁粉与多种离子反应时,首先要弄清反应的顺序,然后才能逐一展开讨论,找出各种情况下各种量的关系。
举一反三:
【变式1】锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为________(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式________。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是________。
①Al2(SO4)3和NaOH ②Al2(SO4)3和NH3·H2O
③ZnSO4和NaOH ④ZnSO4和NH3·H2O
(4)写出可溶性铝盐与氨水反应的离子方程式:________。试解释在实验室不适宜用可溶性锌盐与氨水制备氢氧化锌的原因________。
【答案】(1)AlO2-[或Al(OH)4-]
(2)Zn+2NaOH=Na2ZnO2+H2↑或[Zn+2NaOH+2H2O=Na2Zn(OH)4+H2↑] (3)①③④
(4)Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中生成Zn(NH3)42+,氨水的用量不易控制
【解析】(2)中利用Al与碱反应,推导出Zn+2NaOH=Na2ZnO2+H2↑[或Zn+2NaOH+2H2O=Na2Zn(OH)4+H2↑];(3)利用题干信息可知Al(OH)3和Zn(OH)2溶于强碱液,Al(OH)3不溶于氨水,而Zn(OH)2能溶于氨水,可判断①③④滴加顺序不同,现象也不一样;而②不论怎样滴加现象只有一个,即产生白色沉淀。(4)中氨水为弱碱,不能溶解生成的Al(OH)3,故生成物为Al(OH)3和NH4+。又因Zn(OH)2能溶于过量氨水,不易控制氨水的量,故不适宜在实验室用可溶性锌盐与氨水反应制备Zn(OH)2。
【总结升华】本题依据锌、铝性质的相似性,考查学生运用类比推理,进行正向迁移的能力。
类型三:金属及其化合物的推断
例3 下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略)
(1)A、B、C、D代表的物质分别为________、________、________、________(填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是________;
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是________、________(填化学式);
(4)反应③产物中K的化学式为________;
(5)反应④的离子方程式为________。
【思路点拨】做推断题时抓住突破口,本题的突破口为“B为非金属单质(一般是黑色粉末)”、“C是常见的无色无味液体”、“D是淡黄色的固体化合物”,利用这些信息分别推出B、C、D,再顺藤摸瓜,推测其他物质。
【答案】(1)Al C H2O Na2O2
(2)2Na2O2+2H2O=4NaOH+O2↑ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(3)CO2 CO (4)Na2CO3
(5)CO2+AlO2-+OH-+H2O=CO32-+Al(OH)3↓
【解析】(1)由C是常见无色无味液体,推知为H2O;D是淡黄色固体化合物,推知D为Na2O2,C、D反应后生成NaOH,并且又能和常见金属单质A反应,可知A为Al;由B为黑色非金属单质,猜测为碳。
(2)分步书写,减少错误。先写出Na2O2与H2O的反应,生成的NaOH再与Al发生反应。
(3)根据C和O2反应的物质的量,两者比值为4∶4时产物为CO2。比值为4∶2时,产物为CO,现在比值为4∶3,所以产物为CO2和CO的混合物。
(4)反应③Na2O2和CO2反应生成Na2CO3和O2。
(5)反应④溶液甲的成分为NaOH和NaAlO2,通入CO2后,CO2可以和NaAlO2溶液反应生成Al(OH)3沉淀,同时CO2又和NaOH反应生成Na2CO3,两者相加,即得总方程式,然后再拆为离子方程式。
【总结升华】本题为推断题,题目文字表述简洁明了,主要考查元素化合物间的相互转化关系和对知识进行归纳分析、综合比较判断的能力。
举一反三:
【变式1】A、C、E是中学化学中常见的单质,A是固体,C、E是无色无味的气体,D是黑色晶体,它们之间的转化关系如图所示:
(1)写出A、B、C的化学式:
A、________ B、________ C、________
(2)写出A、B转化为D、E的化学方程式:
__________________________。
(3)写出D与浓盐酸反应的离子方程式:
_____________________________。
【答案】(1)Fe H2O O2
(2)3Fe+4H2O (g)Fe3O4+4H2
(3)Fe3O4+8H+=Fe2++2Fe3++4H2O
高中化学人教版 (新课标)必修1第二章 化学物质及其变化综合与测试学案: 这是一份高中化学人教版 (新课标)必修1第二章 化学物质及其变化综合与测试学案,共10页。学案主要包含了学习目标,要点梳理,典型例题,思路点拨,总结升华等内容,欢迎下载使用。
人教版 (新课标)必修1第三章 金属及其化合物综合与测试导学案: 这是一份人教版 (新课标)必修1第三章 金属及其化合物综合与测试导学案,共9页。学案主要包含了学习目标,要点梳理,典型例题,思路点拨,总结升华等内容,欢迎下载使用。
人教版 (新课标)必修1第四章 非金属及其化合物综合与测试学案设计: 这是一份人教版 (新课标)必修1第四章 非金属及其化合物综合与测试学案设计,共12页。学案主要包含了学习目标,知识网络,要点梳理,典型例题解析,思路点拨,总结升华等内容,欢迎下载使用。