
人教版 (新课标)必修1第四章 非金属及其化合物综合与测试学案设计
展开《非金属及其化合物》全章复习与巩固
编稿:房鑫 审稿:曹玉婷
【学习目标】
1.总结几种常见非金属(碳、硅、氯、硫、氮)及其化合物的主要性质,理解浓硫酸及硝酸的氧化性。
2. 掌握氯离子、铵根离子的检验方法。
3. 学会氨气、二氧化硫、二氧化碳的检验方法。
4. 掌握氯气、氨气的实验室制法。
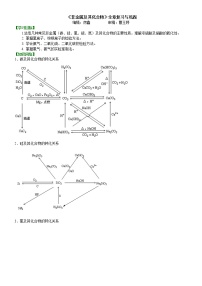
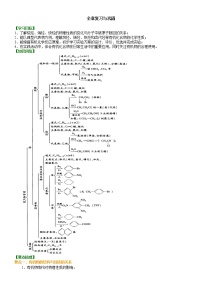
【知识网络】
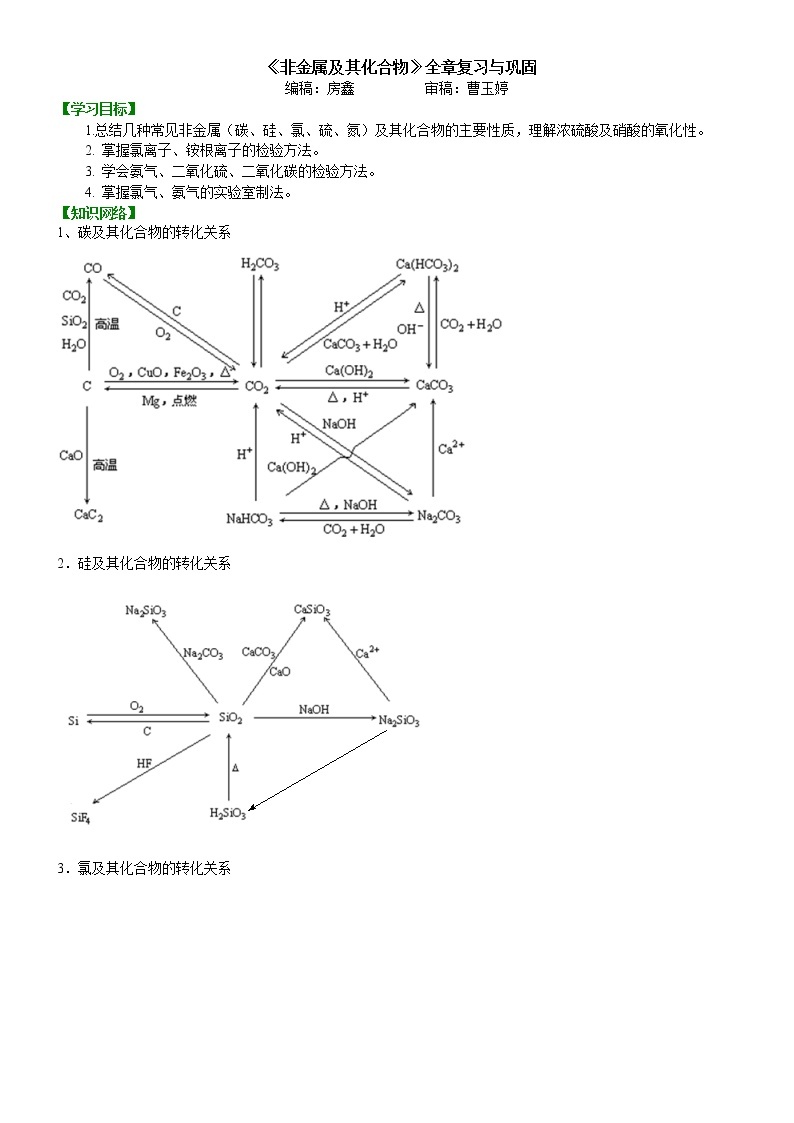
1、碳及其化合物的转化关系
2.硅及其化合物的转化关系
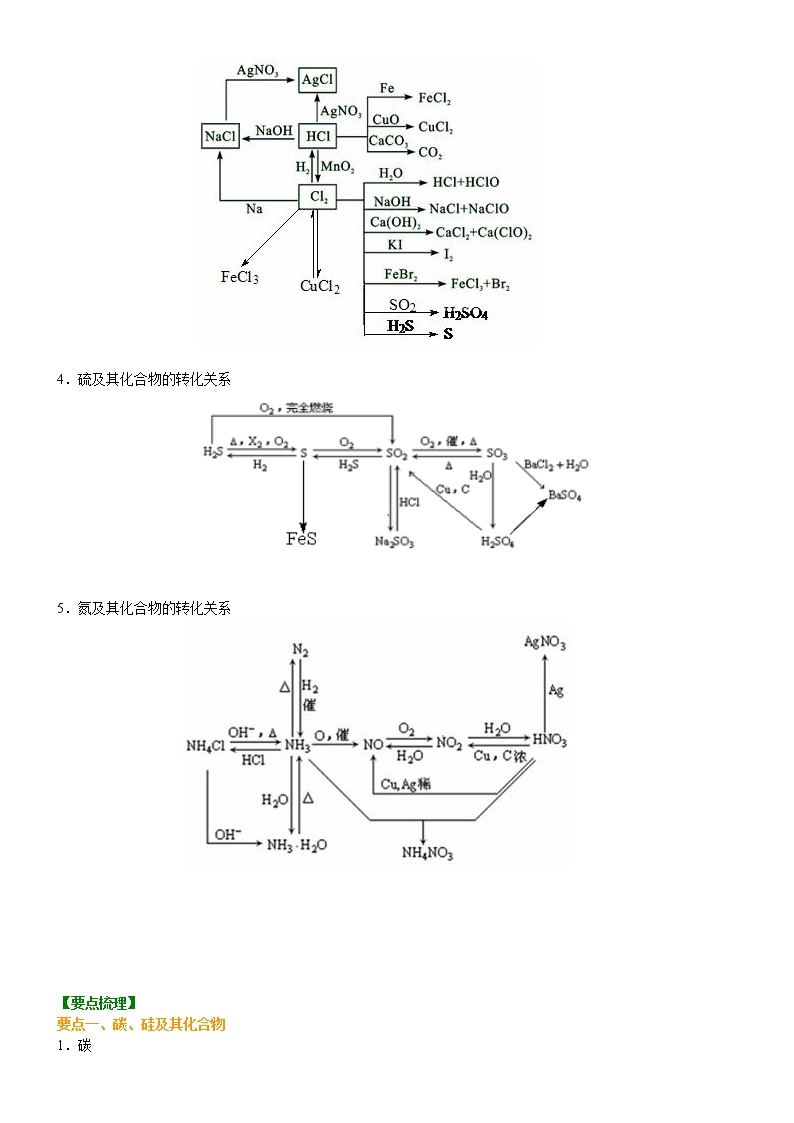
3.氯及其化合物的转化关系
4.硫及其化合物的转化关系
5.氮及其化合物的转化关系
【要点梳理】
要点一、碳、硅及其化合物
1.碳
碳在常温下非常稳定,但在高温条件下活动性增强,主要表现为还原性。
(1)与非金属单质反应
2C+O22CO C+O2CO2
(2)与某些氧化物反应
C+CO22CO C+H2O(g)CO+H2
2C+SiO2Si+2CO↑
C+2CuO2Cu+CO2↑
(3)与氧化性酸反应
C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
C+4HNO3(浓)CO2↑+4NO2↑+2H2O
2.碳的氧化物
(1)CO:主要表现还原性
2CO+O22CO2
3CO+Fe2O32Fe+3CO2
CO+H2OCO2+H2
(2)CO2
①弱氧化性:CO2+C2CO
②酸性氧化物的三点通性
CO2+H2OH2CO3
CO2+Ca(OH)2=CaCO3↓+H2O
CO2+CaOCaCO3
其它性质:
CO2+H2O+CaCO3=Ca(HCO3)2
2CO2+Ca(OH)2=Ca(HCO3)2
Na2SiO3 +CO2 +H2O ==H2SiO3↓+ Na2CO3 (CO2少量)
Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO
2Na2O2+2CO2=2Na2CO3+O2
3.碳酸盐
(1)溶解性
正盐中只有碱金属的碳酸盐和铵盐溶于水,所有酸式盐均溶于水。一般酸式盐比相应正盐易溶,但碱金属的碳酸氢盐比碳酸盐的溶解度小。
(2)热稳定性
一般规律:可溶性碳酸正盐>不溶性碳酸正盐>酸式碳酸盐。如:
Na2CO3>CaCO3>NaHCO3
(3)正盐与酸式盐的相互转化
4.硅单质
地壳中含量最高的两种元素分别是氧和硅。硅是一种亲氧元素,在自然界中它总是与氧相互化合,硅主要以熔点很高的氧化物及硅酸盐的形式存在。硅原子结构和碳原子结构相似。硅元素是构成岩石与许多矿物的基本元素,碳元素是构成有机物的必要元素。
(1)硅的性质:还原性为主
Si+2Cl2SiCl4(无色液体)
Si+O2SiO2
(2)硅的制取:工业上用碳在高温下还原二氧化硅可得粗硅:SiO2+2CSi+2CO↑
(3)硅的用途
硅是一种重要的非金属单质,用途非常广泛,作为良好的半导体材料,硅可用来制造集成电路、晶体管、硅整流器、半导体器件。硅还可制成太阳能电池。
5.二氧化硅
(1)酸性氧化物的通性
SiO2+CaOCaSiO3
SiO2+2NaOH==Na2SiO3+H2O
盛放碱性溶液的试剂瓶不能用玻璃塞
SiO2不溶于水,与水不反应
(2)氧化性
SiO2+CaOCaSiO3
(3) SiO2和HF反应:SiO2+4HF=SiF4↑+2H2O(特性)
玻璃中含有SiO2,可以用HF来刻蚀玻璃。盛放氢氟酸不能用玻璃瓶,可以用塑料瓶。
(4)SiO2用途
天然二氧化硅有结晶形和无定形两大类,统称硅石。它的硬度较大,熔点较高。以SiO2为主要成分的沙子是基本的建筑材料。纯净的SiO2是现代光学及光纤制品的基本原料(光导纤维的成分是二氧化硅)。石英、玛瑙(成分SiO2)用于制作饰物和工艺品。
6.硅酸
硅酸是一种溶解度很小的弱酸,酸性比碳酸弱,只能通过硅酸盐与酸反应制取。
Na2SiO3 + 2HCl==H2SiO3(胶体)+2NaCl
要点二、氯及其化合物
氯原子很容易得到一个电子而形成氯离子(Cl-),表现为典型的氧化性。
1.氯气的化学性质
(1)与金属反应:
Cl2+2Na2NaCl 3Cl2+2Fe2FeCl3 Cl2+CuCuCl2
(2)与非金属反应:
Cl2+H22HCl
点燃的氢气在氯气瓶中继续燃烧,产生苍白色火焰,瓶口有大量的白雾(HCl气体和空气中的水形成盐酸酸雾)。
(3)与水反应 Cl2+H2O HCl+HClO
新制的氯水
久置的氯水
成分
分子:Cl2、H2O、HClO
离子:H+、Cl-、ClO-、OH-
分子:H2O
离子:H+、Cl-、OH-
颜色
黄绿色
无色
性质
酸性、漂白性
酸性且酸性增强、无漂白性
原因
新制的氯水中存在Cl2+H2OHClO+H++Cl-
久置的氯水中HClO完全分解为O2而消耗,最后成为HCl溶液
(4)与碱反应:
①工业制漂白粉或漂粉精2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
漂白粉的主要成分为:CaCl2+Ca(ClO)2;有效成分为:Ca(ClO)2
漂白粉的使用:Ca(ClO)2+ 2HCl=CaCl2+2HClO
Ca(ClO)2+ H2O+CO2=CaCO3↓+2HClO
通过此反应可比较得出酸性强弱:H2CO3>HClO
②氯气的尾气处理
Cl2+2NaOH=NaCl+NaClO+H2O
(5)与某些盐溶液反应
Cl2+2KI=I2+2KCl
Cl2+2Fe2+=2Fe3++2Cl—
Cl2+ SO2+2H2O=2HCl+ H2SO4
2.氯气的实验室制备
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
3.次氯酸、漂白粉的性质
(1)HClO是一种弱酸,H2CO3>HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
(2) HClO和ClO-都具有强氧化性,无论酸性、碱性条件下都可以跟亚铁盐、碘化物、硫化物等发生氧化还原反应,能使品红溶液褪色。
(3)HClO见光易分解:2HClO2HCl+O2↑。
4.氯离子的检验
在被检物质的溶液中,先滴入少量的稀硝酸,将其酸化,排除CO32-等离子的干扰,然后再滴入AgNO3溶液,如产生白色沉淀,则可判断该溶液中含有Cl-。
要点三、硫及其重要化合物的主要性质
1.S:
游离态的硫存在于火山口附近或地壳的岩层里。俗称硫磺,是一种黄色晶体,硫不溶于水,微溶于酒精,易溶于二硫化碳。
(1) 氧化性:
①和金属Fe+SFeS(黑色) 2Cu+SCu2S(黑色)
②和非金属S+H2H2S
(2)还原性:S+O2SO2
2.SO2
二氧化硫是无色、有刺激气味的有毒气体,密度比空气大,易溶于水。二氧化硫是形成酸雨的主要气体,排放到大气中有很大危害。
(1)酸性氧化物的通性
①与H2O反应:SO2+H2OH2SO3
②与碱反应:SO2+2NaOH=Na2SO3+H2O
SO2+Na2SO3+H2O= 2NaHSO3
SO2+Ca(OH)2=CaSO3↓+H2O
SO2+CaSO3+H2O=Ca(HSO3)2
(CO2,SO2均可使澄清石灰水变浑浊)
③与碱性氧化物的作用
SO2+CaO =CaSO3
(2)氧化性和还原性
SO2中的S元素化合价为+4价,处于中间价态,表现出双重性,但以还原性为主。
例:SO2 +2H2S=3S↓+2H2O ——氧化性
SO2+I2+2H2O=H2SO4+2HI ——还原性
SO2可使酸性KMnO4溶液褪色
SO2可以被O2、Cl2、Br2、I2、KMnO4、HNO3、Fe3+等所氧化
(3)特性:漂白性
二氧化硫有漂白性,它能与某些有色物质化合生成不稳定的无色物质。这种物质容易分解而使有色物质恢复原来的颜色。因此,二氧化硫气体可使品红溶液褪色,加热后溶液又恢复原来的颜色。
小结所学的漂白剂及其漂白原理
漂白剂
漂白原理
活性炭
物理吸附
HClO、O3、H2O2
强氧化作用
SO2
结合生成不稳定的无色物质,加热又复色
3.浓硫酸
硫酸是一种强酸,其稀溶液具有酸的通性。但浓硫酸还具有三大特性:
(1)吸水性:可做气体干燥剂。
(2)脱水性:按水的组成比脱去有机物中的氢、氧元素,生成水。浓硫酸对皮肤有强腐蚀性。
(3)强氧化性
2H2SO4(浓)+ CCO2↑ + 2H2O + 2SO2↑
2H2SO4(浓) + Cu CuSO4 + 2H2O +SO2↑
常温时, Fe、Al与浓硫酸作用,使金属表面生成致密氧化膜(钝化)。
要点四、氮及其重要化合物的主要性质
1.氮气
氮气占空气体积的78%左右,氮的化学性质稳定,不活泼,但在一定条件下可以和氧气、氢气发生反应:
N2+O2 2NO
2.NO和NO2
NO
NO2
物
理性质
色态味
无色、无味、气体
红棕色、刺激性气味、气体
密度
略大于空气
大于空气
熔沸点
低
低
溶解性
不溶于水
易溶于水并反应
毒性
有毒
有毒
化学性质
与水
不反应
3NO2+H2O=2HNO3+NO
NO2既是氧化剂,又是还原剂
与碱
不反应
2NO2+2NaOH=NaNO3+NaNO2+H2O
与氧气
2NO+O2=2NO2
不反应
实验室制法
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3.氨气(NH3)
(1)与酸反应
NH3+HCl=NH4Cl(白烟)
NH3+HNO3=NH4NO3( 白烟)
2NH3+H2SO4=(NH4)2SO4
(2)与水反应:
氨气是无色有刺激气味的气体,极易溶于水并发生反应,常温下,1体积水大约可溶解700体积氨气。实验室可以用氨气做喷泉实验。氨的水溶液是氨水,
NH3+H2ONH3 ·H2ONH4++OH- (NH3·H2O是弱碱)
所以,氨水中的微粒共有六种:
分子:NH3·H2O、H2O、NH3;
离子:NH4+ 、OH-、H+
(3)还原性
在催化剂作用下氨气可以被氧化成一氧化氮:
因此,氨经一系列反应可以得到硝酸:
NH3NONO2HNO3
此外,氨还可与Cl2反应:
8NH3+3Cl2=2N2+6NH4Cl(氨过量)
(4)氨气的实验室制法
①原理: 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
②装置:固-固反应加热装置(同制O2)
③干燥:碱石灰(或固体NaOH、固体CaO)
(不能用浓H2SO4、CaCl2干燥,因CaCl2与NH3反应:CaCl2+8NH3= CaCl2·8 NH3)
④收集:向下排空气法收集
⑤验满:用湿润的红色石蕊试纸(变蓝)或蘸有浓HCl的玻璃棒接近瓶口(产生白烟)。
⑥尾气吸收:水(防止倒吸)
4.铵盐
(1)铵盐都是离子化合物,都易溶于水
(2)铵盐的化学性质
①不稳定性,受热易分解
NH4Cl NH3 ↑+ HCl↑(用于除去或分离铵盐)
NH4HCO3 NH3 ↑+ H2O + CO2↑
②与碱反应NH4++OH-NH3↑+H2O(用于NH4+的检验)
③NH3与NH4+的相互转化
5.硝酸
(1)酸的通性:(石蕊、金属、碱、碱性化合物、某些盐)
(2)氧化性:
①与金属单质的反应:
a.活泼金属
b.Al、Fe钝化
常温浓硝酸可使铝、铁钝化,但加热能使它们发生剧烈的化学反应。
Al+6HNO3(浓)Al(NO3)3+3NO2↑+3H2O
c.不活泼金属
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
②与非金属单质的反应:
C+4HNO3(浓)CO2+4NO2↑+2H2O
③与还原性物质的反应:如可使下列变化发生
Fe2+→Fe3+ ;SO32-→SO42- ; I-→I2
(3)不稳定性:
(浓硝酸应保存在棕色瓶中,并置于阴凉处)
【典型例题解析】
类型一:氯及其化合物
例1、下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是( )
A.CuCl2 B.FeCl2 C.FeCl3 D.AlCl3
【思路点拨】具有可变价态的金属(如Fe、Cu等)与氯气反应,生成高价态金属氯化物;活泼的金属与盐酸反应,生成低价态金属氯化物,而不活泼的金属与盐酸不反应。
【答案】D
【解析】铜与氯气反应,生成CuCl2,与盐酸不反应,所以A错误;铁与氯气反应生成FeCl3,与盐酸反应生成FeCl2,所以B、C错误;铝与氯气反应生成AlCl3,与盐酸反应生成AlCl3和H2,所以D正确。
【总结升华】氯气与大多数金属反应,生成高价态金属氯化物;只有金属活动顺序表中氢以前的金属,才能跟盐酸反应,并且一般生成低价态金属氯化物和氢气,所以符合题意的是具有不变价态、且在金属活动顺序表中排在氢以前的金属的氯化物。
举一反三:
【变式】下列物质中,不能使干燥的有色布条褪色的是
A.Cl2 B.氯水 C.NaClO溶液 D.H2O2
【答案】A
类型二:硫及其化合物
例2、某学生课外活动小组利用下图所示装置,分别做如下实验:(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是 _____________ 溶液;加热时溶液由红色逐渐变浅的原因是: _______________________________________。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色。冷却后恢复无色,则此溶液可能是_______溶液。加热时溶液由无色变为红色的原因是:______________________ 。
【思路点拨】注意颜色的变化,以此作为突破口进行推测。
【答案】(1)稀氨水和酚酞;稀氨水中的NH3逸出,所以溶液的颜色变浅。
(2)溶有SO2的品红;SO2气体逸出,品红溶液恢复红色。
【解析】(1)认真观察实验装置的特点:试管口上套有气球,说明加热时会有气体逸出,一下就使“红色溶液”的范围缩小:溶有酸性气体的石蕊溶液或溶有碱性气体的酚酞溶液。而前者加热后,红色变为紫色,不符合“溶液颜色逐渐变浅”的条件,结论只有稀氨水和酚酞。
(2)由无色溶液气体+溶液变红气体+溶液无色。联想无色溶液虽多,但加热后放出气体且溶液变红不多,又冷却后该气体可使红色溶液褪色——显然该气体有漂白作用,并是一可逆过程,符合条件的无色溶液只能是SO2漂白过的品红溶液。
【总结升华】颜色的变化是此题的突破口,在中学教材中还有许多物质有特殊的颜色,这些特征颜色往往是解题的关键,要注意积累归纳。
举一反三:
【变式1】能鉴别CO2和SO2的试剂是( )
A.品红溶液 B.澄清石灰水
C.紫色石蕊试液 D.氯化钡溶液和氯水混合液
【答案】AD
【解析】CO2与SO2溶于水可得碳酸和亚硫酸,均可电离出氢离子,均可使紫色石蕊试剂变红。它们与澄清石灰水均可生成白色沉淀,且过量后均可溶解。CO2与SO2在还原性方面不同。SO2具有还原性可以被氯单质氧化而在水溶液中生成硫酸根离子,可与氯化钡生成硫酸钡白色沉淀,而CO2不能。SO2有漂白性,CO2没有。
【变式2】三位同学设计了下述三个方案,并都认为:如果观察到的现象和自己设计的方案一致,即可确证试液中有SO42-。
试评价上述方案是否严密,并分别说明理由。
方案甲:_________;
方案乙:_________;
方案丙:_________。
【答案】甲:不合理,因试液中如含有Ag+,而不含SO42-的无色溶液同样产生白色沉淀。
乙:合理,加稀HCl排除CO32-、SO32-的干扰,同时无白色沉淀说明原无色溶液中无Ag+,再加入BaCl2产生白色沉淀说明原溶液肯定有SO42-。
丙:不合理,如含有SO32-不含SO42-,强氧化性的酸HNO3会把SO32-氧化成SO42-,从而和Ba(NO3)2反应生成BaSO4白色沉淀。
【解析】对检验SO42-干扰的离子有Ag+、CO32-、SO32-来进行分析。检验SO42-的方法是:先用HCl(HNO3)酸化再用钡盐滴定。如果有Ag+干扰可用HNO3酸化,如果有SO32-用稀HCl酸化,既有Ag+也有SO32-应用稀HCl酸化。
类型三:氮及其化合物
例3、如图表示,A、B、C、D、E五种含氮物质相互转化的关系图,其中A、B、C、D常温下都是气体,B为红棕色,写出A、B、C、D、E的化学式和各步反应的化学方程式。
(1)各物质的化学式为:
A、__________,B、___________,C、__________,D、__________,E、___________。
(2)各步反应的化学方程式为:
A→C:____________________________________ ;
D→C:____________________________________ ;
B→E:____________________________________ ;
E→C:____________________________________ 。
【思路点拨】把B为红棕色气体作为突破口,根据框图中的反应条件进行推测。
【答案】(1)A:N2 B:NO2 C:NO D:NH3 E:HNO3
(2)A→C:N2+ O22NO D→C:4NH3+5O24NO+6H2O
B→E:3NO2+H2O=2HNO3+NO
E→C 3Cu+8HNO3(稀)=3Cu(NO3)+2NO↑+4H2O
【解析】解题的突破口是B 为红棕色气体,则B为NO2,C与O2能生成气体B,故C为NO。E在常温下不是气体,故E为稀HNO3。由图转化关系进一步分析可知:A为N2、 D为NH3。
【总结升华】做推断题时要以特殊性质或现象作为突破口,特殊性质包括颜色、状态、气味等,在学习的过程中要加以积累、记忆。
举一反三:
【变式1】已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如下图示:
(1)D的化学式(分子式)是____________,E的化学式(分子式)是______________。
(2)A和B反应生成C的化学方程式是_______________________________________。
(3)E和F反应生成D、H和G的化学方程式是_________________________________。
【答案】(1)NH3 NH4Cl (2)H2+Cl22HCl
(3)2NH4Cl+Ca(OH)2 2NH3↑+2H2O+CaCl2
【解析】此题综合考查了元素化合物知识,是典型的框图推断题,要求对元素化合物知识要有全面的掌握,较难。在解答此题时要紧密结合物质的状态及已知物G进行假设。从题知:A、B、C、D为气态,E、F为固态,则H为液态;由最后生成D气体、H液体和固体CaCl2,再联想常见的生成液体为H2O,结合E、F为固体可猜测是实验室制NH3的反应,即D为NH3,则E、F分别为NH4Cl和Ca(OH)2;由于E是气态D(氨气)、C形成的,所以E为NH4Cl,C为HCl,F为Ca(OH)2;又由于C为HCl,所以A、B分别为H2和Cl2。验证假设的内容,发现符合框图,所以假设成立。
类型四:碳、硅及其化合物
例4、在一定条件下,下列物质不能与二氧化硅反应的是( )
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤浓硝酸 ⑥烧碱溶液 ⑦氧化钙 ⑧氮气
A.③⑤⑦⑧ B.⑤⑦⑧ C.⑤⑧ D.⑤
【思路点拨】掌握SiO2与一些物质反应的条件及化学方程式,就可迅速解题。
【答案】C
【解析】二氧化硅是酸性氧化物,不与强酸反应,因此⑤浓硝酸不会与二氧化硅反应;氮气的化学性质不活泼,很能与一些物质反应,不会与二氧化硅反应,故选C。
【总结升华】二氧化硅的化学性质很稳定,常温下只与氢氟酸、强碱溶液反应,在加热条件下可体现二氧化硅酸性氧化物的通性。 作为酸性氧化物,SiO2可与强碱和碱性氧化物反应,在常温下SiO2可与氢氟酸反应,在加热时SiO2可被焦炭还原,可与碳酸钙、纯碱反应。
举一反三:
【变式1】不能用磨口玻璃塞的试剂瓶贮存的一组物质是( )
A.溴水、氯水、碘水
B.氢溴酸、盐酸、氢硫酸
C.浓硝酸、浓硝酸、高氯酸
D.NaOH溶液、KOH溶液、Na2SiO3溶液
【答案】D
【变式2】向下列物质的浓溶液中缓慢地通入过量CO2气体,整个过程中无明显现象的是( )
A.水玻璃 B.氯化钙
C.漂白粉 D.饱和碳酸钠
【答案】B
【解析】CO2溶于水生成碳酸,碳酸的酸性比盐酸弱,而比硅酸、次氯酸强。根据酸与盐反应的规律(弱酸不能制强酸),过量CO2通入硅酸钠溶液中有白色沉淀H2SiO3生成;CO2通入氯化钙溶液无明显现象; CO2通入次氯酸钙溶液过程中会生成碳酸钙白色沉淀,CO2过量最终沉淀会消失;过量CO2通入饱和碳酸钠溶液会生成碳酸氢钠,碳酸氢钠溶解度比碳酸钠溶解度小而结晶析出。
类型五:气体的实验室制法
例5、实验室用二氧化锰和浓盐酸加热来制取氯气,反应的化学方程式为________________,其中二氧化锰的作用是____________。按上述方法制得的氯气中,可能含有的杂质气体有________、________。若需制得纯净、干燥的氯气,应将由发生装置导出的气体依次通过分别盛有________、________的洗气瓶。为防止氯气污染空气,多余的氯气通常可用________吸收,这个反应的离子方程式为________________。
【思路点拨】本题考查氯气的实验室制法,在除杂过程中抓住每个杂质气体的特殊性质进行处理。
【答案】MnO2+4HCl (浓)MnCl+Cl2+2H2O 氧化剂 HCl H2O(g) 饱和食盐水 浓硫酸 NaOH溶液 Cl2+2OH-==Cl-+ClO-+H2O
【解析】实验室制取氯气的反应为:MnO2+4HCl (浓)MnCl2+Cl2↑+2H2O,由此分析从气体发生装置出来的氯气中有HCl和H2O(g)杂质,所以需用饱和食盐水洗去HCl,用浓硫酸干燥氯气;由氯气的密度和溶解性,可选择向上排空气法收集氯气;根据氯气的性质,可用湿润的KI淀粉试纸检验集气瓶是否充满,剩余的氯气可用NaOH溶液吸收。
【总结升华】要善于运用所学的实验知识和氯气的性质,通过分析整理出有关气体的实验室制法的七个方面的内容,使之成为理性记忆分析能力。
举一反三
【变式1】下图是某同学设计的实验室制备干燥的Cl2及吸收多余氯气的实验装置,根据图中的装置和有关试剂回答下列问题。
(1)指出上述装置中的各处错误:
①_________________;②_________________;③_________________;
④_________________;⑤_________________
(2)在改正过来的装置中,下列物质的作用分别是:
①饱和食盐水_________________;②浓硫酸_________________;
③NaOH溶液_________________;④MnO2_________________;
【答案】(1)①不能用稀盐酸,应改用浓盐酸;②没有酒精灯;③盛有浓硫酸和饱和食盐水的位置颠倒;④缺少石棉网;⑤收集氯气的集气瓶的进气管和出气管接反
(2)①除去氯气中的HCl ②除去氯气中的H2O(g) ③吸收多余的氯气 ④作氧化剂
【解析】对气体的实验室制法,一般应从以下几个方面考虑分析:①反应原理 ②反应装置及仪器 ③除杂装置 ④干燥装置 ⑤气体收集方法及装置 ⑥验满方法 ⑦余气处理装置。
【变式2】实验室用下列两种方案制取氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量的浓盐酸反应。则所得氯气( )
A.①多 B.②多 C.一样多 D.无法比较
【答案】B
【解析】问题①MnO2足量,反应后期浓盐酸变稀,稀盐酸与MnO2不反应,反应自动停止。
高中化学人教版 (新课标)必修1第二章 化学物质及其变化综合与测试学案: 这是一份高中化学人教版 (新课标)必修1第二章 化学物质及其变化综合与测试学案,共10页。学案主要包含了学习目标,要点梳理,典型例题,思路点拨,总结升华等内容,欢迎下载使用。
高中化学人教版 (新课标)必修1第一章 从实验学化学综合与测试学案: 这是一份高中化学人教版 (新课标)必修1第一章 从实验学化学综合与测试学案,共9页。学案主要包含了学习目标,知识网络,要点梳理,典型例题,思路点拨,总结升华等内容,欢迎下载使用。
高中化学第三章 金属及其化合物综合与测试导学案: 这是一份高中化学第三章 金属及其化合物综合与测试导学案,共6页。学案主要包含了学习目标,要点梳理,典型例题,思路点拨,总结升华等内容,欢迎下载使用。