
高中化学苏教版选修4 化学反应原理第三单元 盐类的水解第1课时课时作业
展开提示:不一定。如Na2CO3、NaHCO3溶液均呈碱性。
2.影响水电离的因素有哪些?
提示:加酸或碱抑制水的电离,加热、加入很活泼的金属(如Na)促进水的电离。
3.写出CH3COOH、NH3·H2O的电离方程式,从上述电离方程式逆过程分析,可得出什么结论?
提示:CH3COOHCH3COO-+H+,NH3·H2ONHeq \\al(+,4)+OH-。CH3COOH、NH3·H2O分别是弱酸、弱碱,CH3COO-、NHeq \\al(+,4)分别是其酸根阴离子、阳离子,从电离的逆过程可知,弱酸的酸根阴离子和弱碱的阳离子能分别与H+、OH-结合生成弱酸、弱碱,即弱电解质。
[新知探究]
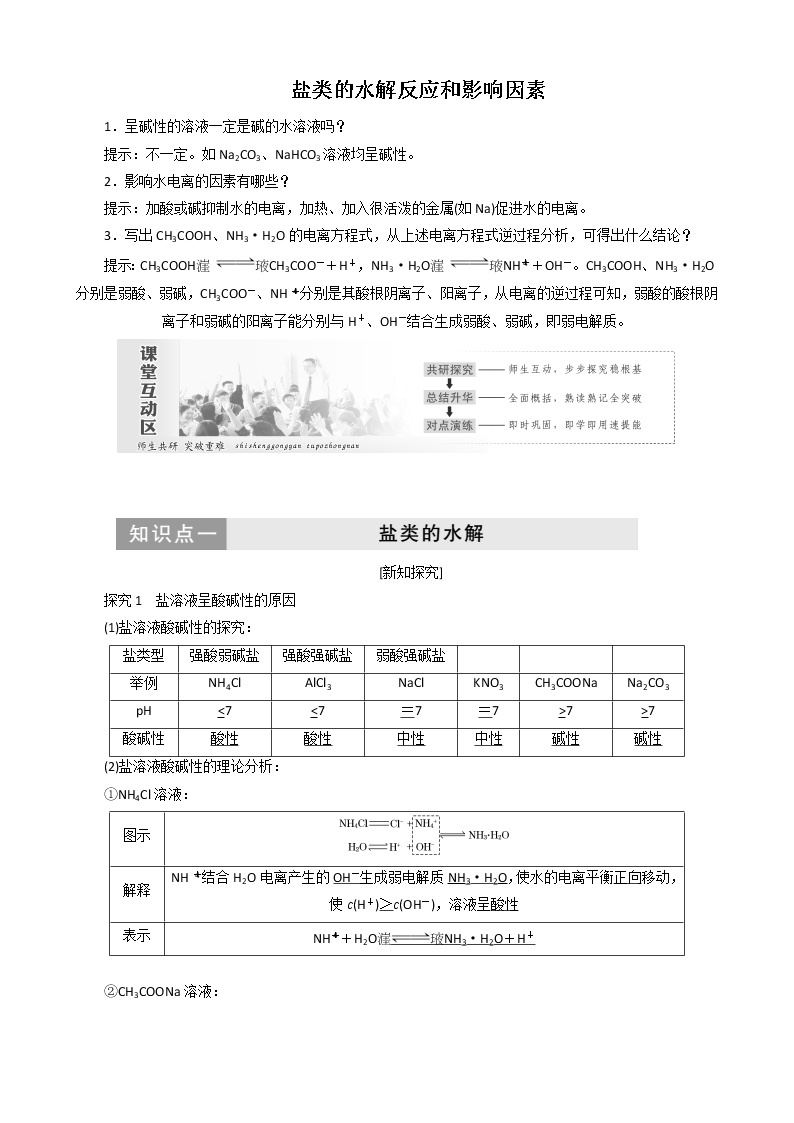
探究1 盐溶液呈酸碱性的原因
(1)盐溶液酸碱性的探究:
(2)盐溶液酸碱性的理论分析:
①NH4Cl溶液:
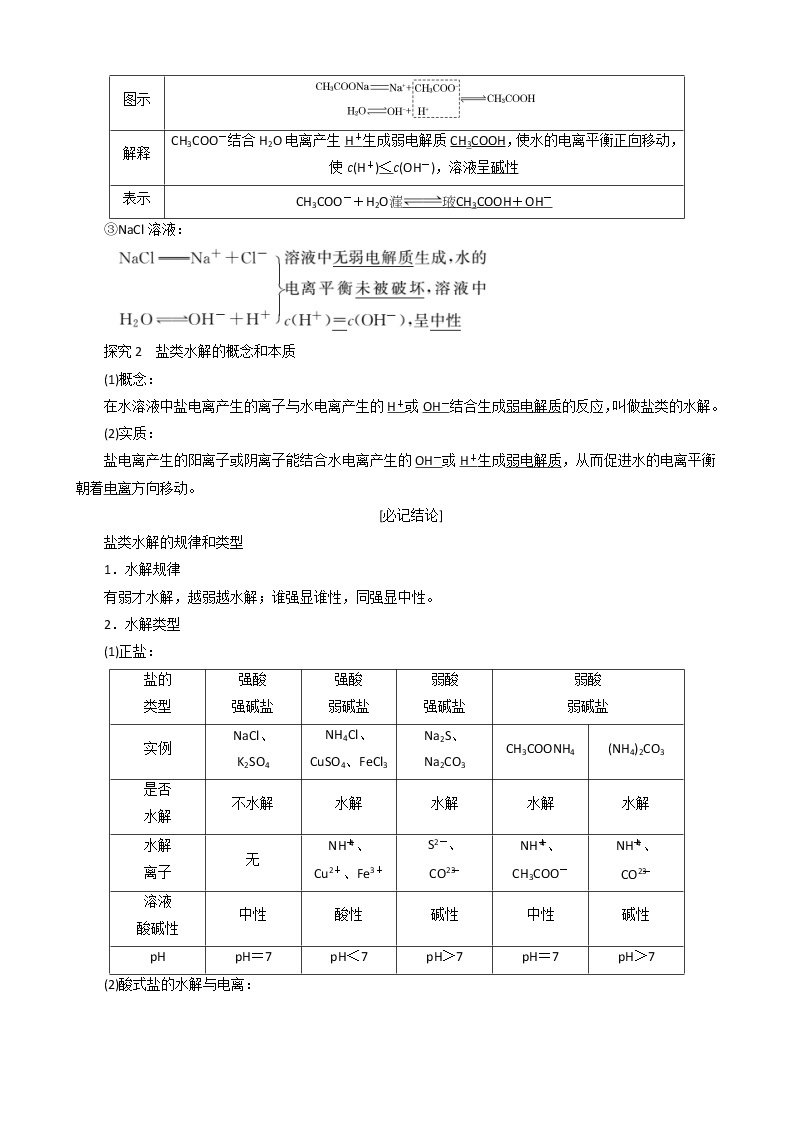
②CH3COONa溶液:
③NaCl溶液:
探究2 盐类水解的概念和本质
(1)概念:
在水溶液中盐电离产生的离子与水电离产生的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
(2)实质:
盐电离产生的阳离子或阴离子能结合水电离产生的OH-或H+生成弱电解质,从而促进水的电离平衡朝着电离方向移动。
[必记结论]
盐类水解的规律和类型
1.水解规律
有弱才水解,越弱越水解;谁强显谁性,同强显中性。
2.水解类型
(1)正盐:
(2)酸式盐的水解与电离:
多元弱酸的酸式酸根离子既有水解倾向又有电离倾向,其盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小:
①若水解程度大于电离程度,溶液呈碱性。如NaHCO3、NaHS、Na2HPO4溶液呈碱性。
②若电离程度大于水解程度,溶液呈酸性。如NaHSO3、NaH2PO4溶液呈酸性。
[成功体验]
1.下列有关盐类水解的说法不正确的是( )
A.盐类水解过程破坏了纯水的电离平衡
B.盐类水解反应是酸碱中和反应的逆反应
C.盐类水解的结果使溶液不一定呈中性
D.Na2S溶液中c(Na+)是c(S2-)的2倍
解析:选D 由于盐电离出的离子与水电离出的H+或OH-结合,从而促进了水的电离,使溶液不一定呈中性;盐类水解与酸碱中和反应互为逆反应;D项中,Na2S溶液中若无S2-水解,则c(Na+)=2c(S2-)成立,由于S2-的水解,故c(Na+)>2c(S2-),因此应选D。
2.(好题共享·选自人教版教材P59·T2)物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX、HZ、HY B.HZ、HY、HX
C.HX、HY、HZ D.HY、HZ、HX
解析:选C 酸越弱,阴离子水解程度越大,pH变化越大,可直接推知Z-水解程度最大,HZ酸性最弱,而HX的酸性最强。则三种酸的酸性强弱的顺序是HX、HY、HZ。
[新知探究]
探究 影响盐类水解的内因和外因
1.内因——盐本身的性质
2.外因
(1)温度:
①规律:升高温度,盐类水解程度增大;
②原因:盐类的水解反应ΔH>0。
(2)浓度:
规律:加水稀释,盐类水解程度增大。
(3)溶液的酸碱性:
①加入H+,可促进阴离子的水解,抑制阳离子的水解;
②加入OH-,可促进阳离子的水解,抑制阴离子的水解。
(4)相关离子:如果Na2CO3溶液中加入CaCl2或BaCl2溶液,由于COeq \\al(2-,3)与Ca2+或Ba2+反应,导致COeq \\al(2-,3)的水解平衡左移。
[必记结论]
1.盐类水解平衡的移动
以氯化铁的水解为例具体分析如下:氯化铁水解的离子方程式是Fe3++3H2OFe(OH)3+3H+,溶液呈酸性。当改变下列条件时,对氯化铁水解平衡的影响情况见下表:
2.“越弱越水解”
HA的酸性越弱(即其电离常数越小),则其强碱盐如NaA水解程度越大。
例如:电离常数:K(HNO2)>K(CH3COOH)>K(HClO),水解程度:NaNO2<CH3COONa<NaClO,则碱性大小为:NaNO2<CH3COONa<NaClO。
[成功体验]
3.在一定条件下,Na2CO3溶液存在水解平衡:COeq \\al(2-,3)+H2OHCOeq \\al(-,3)+OH-。下列说法正确的是( )
A.稀释溶液,水解平衡常数增大
B.通入CO2,平衡朝正反应方向移动
C.升高温度,eq \f(cHCO\\al(-,3),cCO\\al(2-,3))减小
D.加入NaOH固体,溶液pH减小
解析:选B 水解平衡是化学平衡,其常数只与温度有关,温度不变,平衡常数不变,A不正确。通入CO2,发生反应CO2+2OH-===COeq \\al(2-,3)+H2O,OH-的浓度降低,平衡向正反应方向移动,B正确。水解反应吸热,升高温度,平衡向正反应方向移动,eq \f(cHCO\\al(-,3),cCO\\al(2-,3))增大,C不正确。加入NaOH固体,OH-浓度增大,溶液pH增大,D不正确。
4.(好题共享·选自人教版教材P59·T8)推测等浓度的Na2CO3和NaHCO3溶液的pH的相对大小,并说明原因。
答案:pH(Na2CO3)>pH(NaHCO3),HCOeq \\al(-,3)的酸性小于H2CO3的,根据“越弱越水解”知COeq \\al(2-,3)水解程度大,溶液碱性强。
———————————————[关键语句小结]————————————————
1.盐类水解的实质是盐电离出来的离子与水电离的H+或OH-结合生成弱电解质,打破了水的电离平衡,往往导致c(H+)≠c(OH-),而引起溶液酸碱性的变化。
2.水解离子方程式的书写:①“水解程度小,式中可逆号,水解产物少,状态不用标。”②多元弱酸盐的水解是分步进行的,且以第一步为主。
3.盐类水解的规律:有弱才水解,越弱越水解;谁强显谁性,同强显中性。
4.外界条件对盐类水解平衡的影响遵循勒夏特列原理。常见的影响因素有温度、浓度、溶液的酸碱性和相关离子。
[例1] 物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是( )
A.Na2CO3 NaHCO3 NaCl NH4Cl
B.Na2CO3 NaHCO3 NH4Cl NaCl
C.(NH4)2SO4 NH4Cl NaNO3 Na2S
D.NH4Cl (NH4)2SO4 Na2S NaNO3
解析:选C 弱酸强碱盐水解显碱性,强酸强碱盐不水解呈中性,强酸弱碱盐水解呈酸性,且第一步水解大于第二步水解,因此,pH:NH4Cl<NaCl<NaHCO3<Na2CO3,A、B错误;又因为(NH4)2SO4比NH4Cl中NHeq \\al(+,4)浓度大,水解所得H+浓度大,故pH:(NH4)2SO4<NH4Cl<NaNO3<Na2S,C正确。
等物质的量浓度各类溶液酸碱性的判断方法
(1)先把所给溶液按酸、碱、盐分类;
(2)盐溶液酸碱性:强酸弱碱盐呈酸性,强酸强碱盐呈中性,弱酸强碱盐呈碱性。
(3)排序(按pH由小到大的顺序):
二元强酸<一元强酸<一元弱酸<强酸弱碱盐<强酸强碱盐<弱酸强碱盐<一元弱碱<一元强碱<二元强碱
如H2SO4
A.Ba(OH)2、Na2SO3、FeCl3、KCl
B.Na2SiO3、Na2CO3、KNO3、NH4Cl
C.NH3·H2O、H3PO4、Na2SO4、H2SO4
D.NaHCO3、CH3COOH、C2H5OH、HCl
解析:选B KCl、KNO3、Na2SO4均为强酸强碱盐,不水解,溶液显中性,而A中Na2SO3、FeCl3分别水解而使溶液显碱性和酸性;B中由于酸性H2SiO3<H2CO3,根据越弱越水解可判断溶液碱性Na2SiO3>Na2CO3,NH4Cl水解显酸性;C中pH应为NH3·H2O>Na2SO4>H3PO4>H2SO4;D中NaHCO3水解大于电离而显碱性,C2H5OH对水的电离平衡无影响,pH=7。故只有B项是pH由大到小排列的。
[例2] (重庆高考)对滴有酚酞试液的下列溶液,操作后颜色变深的是( )
A.明矾溶液加热
B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl固体
D.小苏打溶液中加入少量NaCl固体
解析:选B 本题考查水解平衡和电离平衡等知识,溶液颜色变深的原因是溶液的碱性增强,抓住这一本质寻找答案。A选项,明矾溶液中铝离子水解使溶液呈酸性,加热铝离子的水解程度增大,溶液的酸性增强,无颜色变化;B选项,醋酸钠溶液中醋酸根离子水解使溶液呈碱性,加热,醋酸根离子的水解程度增大,溶液的碱性增强,溶液的颜色加深;C选项,加入氯化铵固体,氨水的电离程度减弱,碱性减弱,溶液颜色变浅;D选项,溶液的酸碱性不变,溶液的颜色没有变化。
化学平衡、弱电解质的电离平衡,H2O的电离平衡和盐类的水解平衡均遵循勒夏特列原理。
(1)因为弱电解质的电离和盐类的水解均属于吸热反应,故升温时,电离平衡及水解平衡都向右移动。
(2)向弱电解质溶液中加入相应的盐或向盐溶液中加入相应的弱电解质遵循“加什么什么大”的原则。如向NH3·H2O中加入NH4Cl固体,虽然NH4Cl电离出NHeq \\al(+,4)抑制了NH3·H2O的电离,但据勒夏特列原理知溶液中c(NHeq \\al(+,4))增大;同理,向NH4Cl溶液中加入NH3·H2O,虽然抑制了NHeq \\al(+,4)的水解,但据勒夏特列原理知溶液中c(NH3·H2O)增大。
(3)向酸性溶液中加水稀释,原溶液中离子浓度均减小,但c(OH-)增大;向碱性溶液中加水稀释,原溶液中离子浓度减小,但c(H+)增大。
例2中,(1)A项若加水稀释,则eq \f(cH+,cAl3+)如何变化?
(2)D项若改为“向小苏打溶液中”通入少量HCl气体,则溶液颜色如何变化?
答案:(1)加水稀释,促进了Al3+的水解,故虽然c(H+)、c(Al3+)均减小,但c(H+)减小的程度小,故比值增大。
(2)变浅。因为HCl气体溶于水电离出H+中和了HCOeq \\al(-,3)水解得到的OH-生成H2O,使
c(OH-)减小,碱性减弱,故红色变浅。
盐类水解离子方程式的书写
(1)一般盐类水解程度很小,水解产物很少,通常不生成沉淀和气体,因此不标“↓”或“↑”,也不把生成物(如NH3·H2O、H2CO3等)写成其分解产物的形式,盐类水解的离子方程式一般不写“===”,而写“”。
(2)多元弱酸的酸根离子水解是分步进行的,以第一步水解为主;多元弱碱的阳离子水解复杂,可一步写出。
例如Na2CO3的水解:
第一步:COeq \\al(2-,3)+H2OHCOeq \\al(-,3)+OH-(主要)
第二步:HCOeq \\al(-,3)+H2OH2CO3+OH-(次要)
Fe3+的水解:Fe3++3H2OFe(OH)3+3H+
(3)多元弱酸的酸式酸根离子既有水解倾向又有电离倾向,水解程度大于电离程度的,溶液显碱性;电离程度大于水解程度的,溶液显酸性。
例如:HS-、HCOeq \\al(-,3)水解程度大于电离程度,其盐溶液显碱性,HSOeq \\al(-,3)、H2POeq \\al(-,4)电离程度大于水解程度,其盐溶液显酸性。
(4)某些盐溶液在混合时,一种盐的阳离子和另一种盐的阴离子,在一起都发生水解,相互促进对方的水解,水解趋于完全。可用“===”连接反应物和生成物,水解生成的难溶物或挥发性物质可加“↓”或“↑”等。
例如:将Al2(SO4)3溶液和NaHCO3溶液混合,立即产生白色沉淀和大量气泡,离子方程式为:
Al3++3HCOeq \\al(-,3)===Al(OH)3↓+3CO2↑。
[例3] 下列反应不属于水解反应或水解方程式不正确的是( )
①HCl+H2OH3O++Cl-
②ZnCl2+H2O===Zn(OH)2+2HCl
③Na2CO3+H2OH2CO3+2NaOH
④Al2(CO3)3+6H2O2Al(OH)3↓+3H2CO3
A.①② B.③④
C.①②④ D.全部
解析:选D ①不是水解反应,是HCl的电离反应:HCl===H++Cl-、
H++H2O===H3O+,该电离是完全的,不是可逆的,正确的写法是HCl+H2O===H3O++Cl-;②不正确。ZnCl2水解是可逆的,应写“”,不应写“===”,正确的写法是:ZnCl2+2H2OZn(OH)2+2HCl,或Zn2++2H2OZn(OH)2+2H+。③不正确。多元弱酸根的水解是分步进行的,以第一步为主,以后各步逐渐减弱,可分步写,一般只写第一步,不可多步合为一步写。正确的写法是:Na2CO3+H2ONaHCO3+NaOH,NaHCO3+H2OH2CO3+NaOH。④不正确。因为Al2(CO3)3的水解相互促进,能进行到底,故正确写法应为:Al2(CO3)3+3H2O===2Al(OH)3↓+3CO2↑。
(1)不能把电离方程式看成水解方程式。
如HS-的电离:HS-+H2OS2-+H3O+;
HS-的水解:HS-+H2OH2S+OH-。
(2)书写盐类水解方程式常见的错误有:
①把“”误写为“===”。
如Fe3++3H2O===Fe(OH)3+3H+是错误的,
正确的为Fe3++3H2OFe(OH)3+3H+。
②水解产物量很小时,标上“↑”或“↓”。
如Al3++3H2OAl(OH)3↓+3H+是错误的,
正确的为Al3++3H2OAl(OH)3+3H+。
2.下列各式中,水解反应的离子方程式正确的是( )
A.NHeq \\al(+,4)+H2ONH3·H2O+H+
B.S2-+2H2OH2S+2OH-
C.CH3COOH+H2OCH3COO-+H3O+
D.CH3COOH+OH-CH3COO-+H2O
解析:选A B为多元弱酸根的水解,要分步书写,故错误,C为电离方程式,D为酸碱中和反应。
[课堂双基落实]
1.下列物质的水溶液由于水解而呈碱性的是( )
A.NaHSO4 B.Na2SO4
C.NaHCO3 D.NH3
解析:选C 本题考查水解的实质及规律。A项,NaHSO4是强酸的酸式盐,不发生水解;B项,Na2SO4是强酸强碱盐,不水解;C项是弱酸的酸式盐,水解使溶液呈碱性;D项NH3是非电解质,溶于水后生成弱碱。故选C。
2.pH=4的醋酸和氯化铵溶液中,水的电离程度的关系前者与后者比较( )
A.大于 B.小于
C.等于 D.无法确定
解析:选B 在醋酸溶液中,由于醋酸电离出的c(H+)会抑制水的电离,使水的电离程度小于纯水的电离程度,在氯化铵溶液中,由氯化铵完全电离出的铵根离子会与水电离出的OH-结合成弱电解质NH3·H2O,从而促进了水的电离,使水的电离程度大于纯水中水的电离程度,故前者小于后者。
3.下列各物质常温下发生水解,对应离子方程式正确的是( )
A.Na2CO3:COeq \\al(2-,3)+2H2OH2O+CO2↑+OH-
B.NH4Cl:NHeq \\al(+,4)+H2ONH3·H2O+OH-
C.CuSO4:Cu2++2H2OCu(OH)2+2H+
D.NaF:F-+H2O===HF+OH-
解析:选C A项中Na2CO3水解时COeq \\al(2-,3)分步水解,由于水解程度小,不能产生CO2。COeq \\al(2-,3)+H2OHCOeq \\al(-,3)+OH-,HCOeq \\al(-,3)+H2OH2CO3+OH-。B项中产物应生成H+。D项中应写可逆符号。
4.向三份0.1 ml·L-1 CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为( )
A.减小、增大、减小 B.增大、减小、减小
C.减小、增大、增大 D.增大、减小、增大
解析:选A 醋酸根离子水解使CH3COONa溶液显碱性,NHeq \\al(+,4)和Fe3+水解均使溶液显酸性,SOeq \\al(2-,3)水解使溶液呈碱性,故加入NH4NO3和FeCl3固体均能促进CH3COONa的水解,导致溶液中CH3COO-浓度减小,加入Na2SO3固体抑制CH3COONa的水解,导致溶液中CH3COO-浓度增大,故选项A正确。
5.(1)相同温度下,等浓度的CH3COONa和Na2CO3溶液,________的碱性强。
(2)升高温度,使盐类的水解平衡向________移动,即升高温度________(填“促进”或“抑制”)盐类的水解。
(3)盐溶液的浓度越小,盐就越________水解,即加水________(填“促进”或“抑制”)盐类的水解。
(4)向CH3COONa溶液中加入盐酸,其水解平衡向________移动,加入NaOH溶液,则平衡向________移动,即加酸能________(填“促进”或“抑制”)强碱弱酸盐的水解,加碱能________(填“促进”或“抑制”)强碱弱酸盐的水解。
解析:决定盐类水解程度大小的因素是自身的性质,即水解生成的电解质的性质,生成的电解质电离程度越小,水解程度越大。
答案:(1)Na2CO3 (2)正方向 促进 (3)容易 促进
(4)正方向 逆方向 促进 抑制
盐类型
强酸弱碱盐
强酸强碱盐
弱酸强碱盐
举例
NH4Cl
AlCl3
NaCl
KNO3
CH3COONa
Na2CO3
pH
<7
<7
=7
=7
>7
>7
酸碱性
酸性
酸性
中性
中性
碱性
碱性
图示
解释
NHeq \\al(+,4)结合H2O电离产生的OH-生成弱电解质NH3·H2O,使水的电离平衡正向移动,使c(H+)>c(OH-),溶液呈酸性
表示
NHeq \\al(+,4)+H2ONH3·H2O+H+
图示
解释
CH3COO-结合H2O电离产生H+生成弱电解质CH3COOH,使水的电离平衡正向移动,使c(H+)<c(OH-),溶液呈碱性
表示
CH3COO-+H2OCH3COOH+OH-
盐的
类型
强酸
强碱盐
强酸
弱碱盐
弱酸
强碱盐
弱酸
弱碱盐
实例
NaCl、
K2SO4
NH4Cl、
CuSO4、FeCl3
Na2S、
Na2CO3
CH3COONH4
(NH4)2CO3
是否
水解
不水解
水解
水解
水解
水解
水解
离子
无
NHeq \\al(+,4)、
Cu2+、Fe3+
S2-、
COeq \\al(2-,3)
NHeq \\al(+,4)、
CH3COO-
NHeq \\al(+,4)、
COeq \\al(2-,3)
溶液
酸碱性
中性
酸性
碱性
中性
碱性
pH
pH=7
pH<7
pH>7
pH=7
pH>7
苏教版选修4 化学反应原理第一单元 化学反应速率第1课时课后作业题: 这是一份苏教版选修4 化学反应原理第一单元 化学反应速率第1课时课后作业题,共10页。试卷主要包含了3 ml·-1等内容,欢迎下载使用。
苏教版选修4 化学反应原理专题一 化学反应与能量变化第三单元 金属的腐蚀与防护第3课时同步达标检测题: 这是一份苏教版选修4 化学反应原理专题一 化学反应与能量变化第三单元 金属的腐蚀与防护第3课时同步达标检测题,共8页。试卷主要包含了金属腐蚀由快到慢的顺序等内容,欢迎下载使用。
人教版 (新课标)选修4 化学反应原理第二节 影响化学反应速率的因素第2课时课堂检测: 这是一份人教版 (新课标)选修4 化学反应原理第二节 影响化学反应速率的因素第2课时课堂检测,共14页。试卷主要包含了催化剂误区,碘在科研与生活中有重要应用等内容,欢迎下载使用。