
2021学年第三节 原子的构成优质课教案及反思
展开学习目标
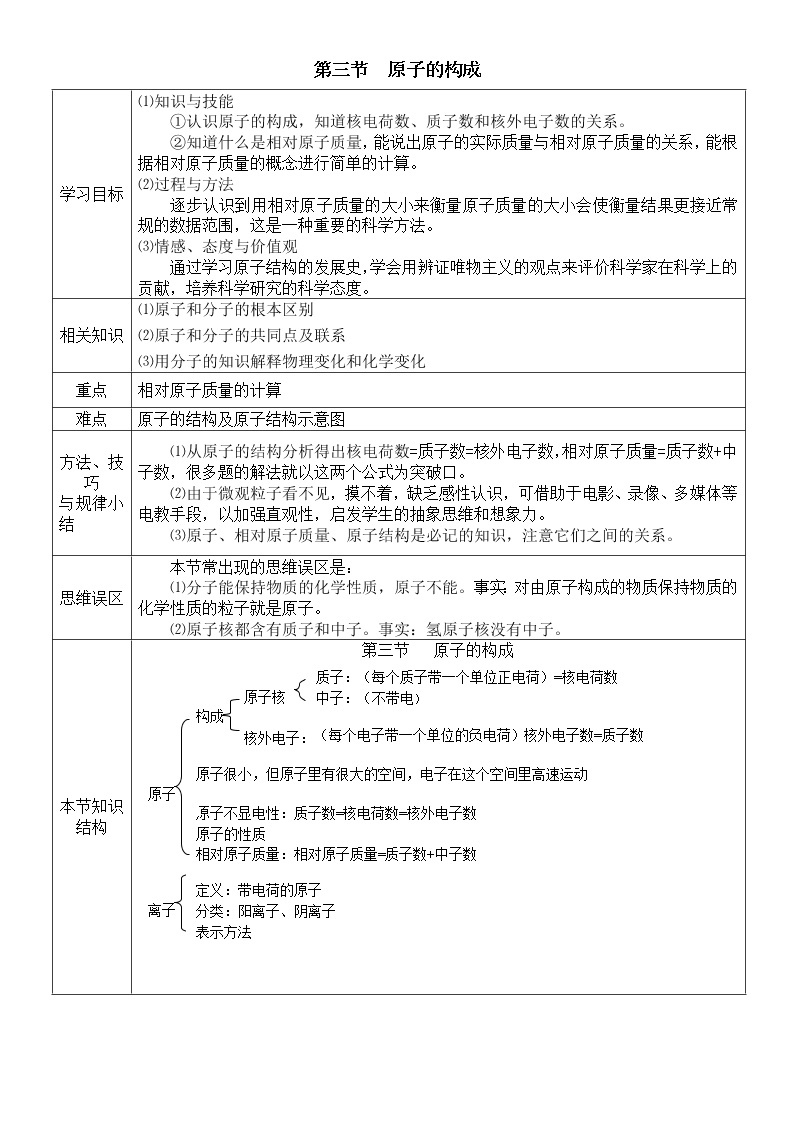
⑴知识与技能
①认识原子的构成,知道核电荷数、质子数和核外电子数的关系。
②知道什么是相对原子质量,能说出原子的实际质量与相对原子质量的关系,能根据相对原子质量的概念进行简单的计算。
⑵过程与方法
逐步认识到用相对原子质量的大小来衡量原子质量的大小会使衡量结果更接近常规的数据范围,这是一种重要的科学方法。
⑶情感、态度与价值观
通过学习原子结构的发展史,学会用辨证唯物主义的观点来评价科学家在科学上的贡献,培养科学研究的科学态度。
相关知识
⑴原子和分子的根本区别
⑵原子和分子的共同点及联系
⑶用分子的知识解释物理变化和化学变化
重点
相对原子质量的计算
难点
原子的结构及原子结构示意图
方法、技巧
与规律小结
⑴从原子的结构分析得出核电荷数=质子数=核外电子数,相对原子质量=质子数+中子数,很多题的解法就以这两个公式为突破口。
⑵由于微观粒子看不见,摸不着,缺乏感性认识,可借助于电影、录像、多媒体等电教手段,以加强直观性,启发学生的抽象思维和想象力。
⑶原子、相对原子质量、原子结构是必记的知识,注意它们之间的关系。
思维误区
本节常出现的思维误区是:
⑴分子能保持物质的化学性质,原子不能。事实:对由原子构成的物质保持物质的化学性质的粒子就是原子。
⑵原子核都含有质子和中子。事实:氢原子核没有中子。
本节知识结构
第三节 原子的构成
原子不显电性:质子数=核电荷数=核外电子数
原子的性质
相对原子质量:相对原子质量=质子数+中子数
原子
构成
原子核
核外电子:
原子很小,但原子里有很大的空间,电子在这个空间里高速运动
质子:(每个质子带一个单位正电荷)=核电荷数
中子:(不带电)
(每个电子带一个单位的负电荷)核外电子数=质子数
离子
定义:带电荷的原子
分类:阳离子、阴离子
表示方法
课 题
第三节 原子的构成
课 型
新 授
第1课时
第 周
年 月 日
教
学
目
标
1.认识原子的构成,知道核电荷数、质子数和核外电子数的关系
2.通过讨论与交流,启发学生的思维,逐步养成良好的学习习惯和学习方法。
3.进一步认识物质的可分性,逐步培养学生树立辨证唯物主义的观点,培养学生的观察能力、分析综合能力和抽象思维能力。
学情分析
学生已掌握了有关分子的性质、化合反应与分解反应的知识,这是引导学生从分子知识认识原子的有效方式,通过物质的分解反应可以从宏观上观察物质的生成,再从“分子是保持物质化学性质的微粒”来分析,推断出分子是可分的,从而引出原子能否可分的问题。
重 点
原子的内部结构
难 点
对“原子不显电性”的理解。
关 键 点
原子内部数量关系
教学媒体
多媒体素材
教学方法
自学研究法、讲述法、谈话法、讨论法、对比法
板 书 设 计
第三节 原子的构成
一、原子的结构
1.
原子(不显电性)
原子核(+)
核外电子(一个电子带有一个单位的负电荷)
质子(一个质子带有一个单位的正电荷)
中子(不显电性)
数量关系:质子数=核外电子数=核电荷数
原子不显电性原因:电性相反,电量相等
教 学 过 程
知 识 点
教 师 活 动
学 生 活 动
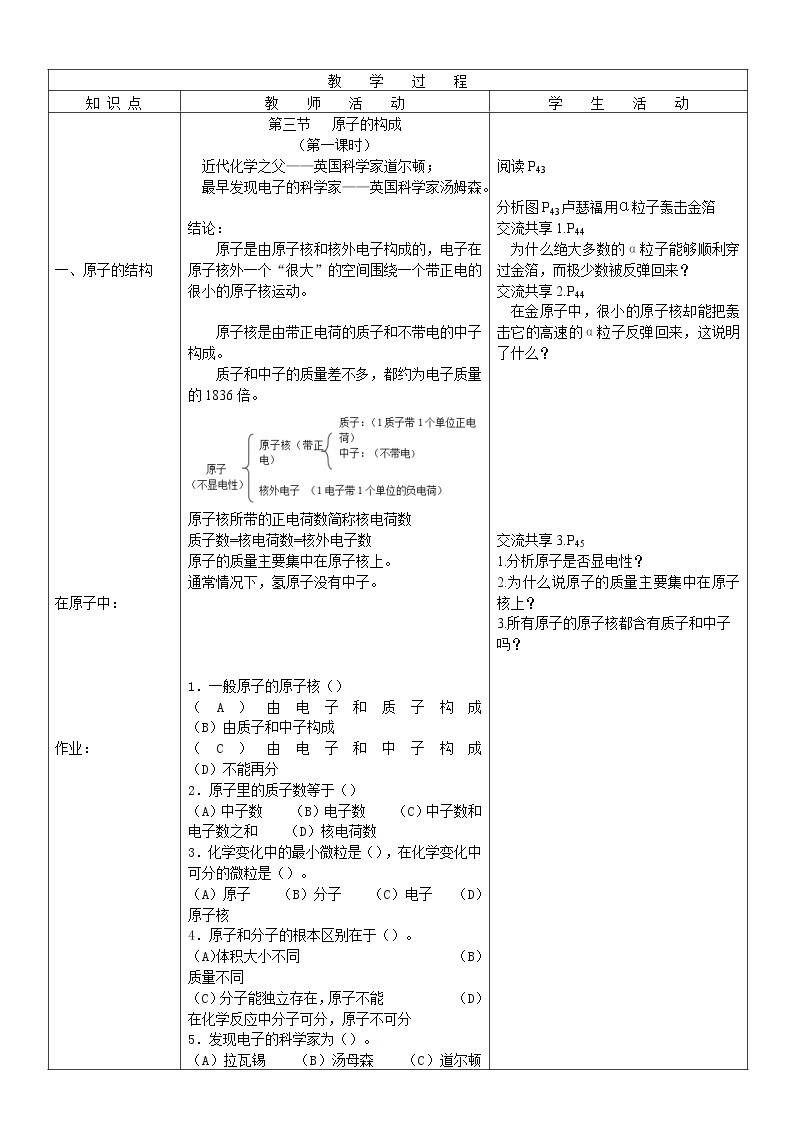
一、原子的结构
在原子中:
作业:
第三节 原子的构成
(第一课时)
近代化学之父——英国科学家道尔顿;
最早发现电子的科学家——英国科学家汤姆森。
结论:
原子是由原子核和核外电子构成的,电子在原子核外一个“很大”的空间围绕一个带正电的很小的原子核运动。
原子核是由带正电荷的质子和不带电的中子构成。
质子和中子的质量差不多,都约为电子质量的1836倍。
原子核所带的正电荷数简称核电荷数
质子数=核电荷数=核外电子数
原子的质量主要集中在原子核上。
通常情况下,氢原子没有中子。
1.一般原子的原子核()
(A)由电子和质子构成 (B)由质子和中子构成
(C)由电子和中子构成 (D)不能再分
2.原子里的质子数等于()
(A)中子数 (B)电子数 (C)中子数和电子数之和 (D)核电荷数
3.化学变化中的最小微粒是(),在化学变化中可分的微粒是()。
(A)原子 (B)分子 (C)电子 (D)原子核
4.原子和分子的根本区别在于()。
(A)体积大小不同 (B)质量不同
(C)分子能独立存在,原子不能 (D)在化学反应中分子可分,原子不可分
5.发现电子的科学家为()。
(A)拉瓦锡 (B)汤母森 (C)道尔顿 (D)舍勤
6.下列关于原子的叙述正确的是()。
(A)原子一定比分子小 (B)原子是不能再分的粒子
(C)一切物质都是由原子直接构成的 (D)原子是化学变化中的最小粒子
7.一个二氧化碳分子是由两个氧原子和一个碳原子构成的。已知氧原子的质子数为8,碳原子的质子数为6,则该分子中共有 个原子核、 个质子和 个电子。
阅读P43
分析图P43卢瑟福用α粒子轰击金箔
交流共享1.P44
为什么绝大多数的α粒子能够顺利穿过金箔,而极少数被反弹回来?
交流共享2.P44
在金原子中,很小的原子核却能把轰击它的高速的α粒子反弹回来,这说明了什么?
交流共享3.P45
1.分析原子是否显电性?
2.为什么说原子的质量主要集中在原子核上?
3.所有原子的原子核都含有质子和中子吗?
课 题
第三节 原子的构成
课 型
新 授
第2课时
第 周
年 月 日
教
学
目
标
1.了解原子的实际质量和相对原子质量的关系,理解相对原子质量的概念。
2.学会计算原子的相对原子质量。
学情分析
通过前面的学习,学生已知道分子、原子的基本性质;原子的质量主要集中在原子核上。但使用、书写、记忆都不方便,所以引入相对原子质量的概念。
重 点
相对原子质量的概念
难 点
相对原子质量的意义
关 键 点
理解“相对”的含义
教学媒体
多媒体素材
教学方法
自学研究法、讲述法、谈话法、讨论法、练习法
板 书 设 计
第三节 原子的构成
二、相对原子质量
相对原子质量=
公式1
公式2
相对原子质量=质子数+中子数
填表:
原子种类
质子数
中子数
核外电子数
相对原子质量
氢
1
0
氧
8
16
镁
12
12
铁
26
56
教 学 过 程
知 识 点
教 师 活 动
学 生 活 动
三、相对原子质量
公式1
相对原子质量=
公式2
相对原子质量=质子数+中子数
第三节 原子的构成
(第二课时)
复习:
1.原子的结构
2.原子结构示意图
3.原子的质量主要集中在什么地方?
1个氧原子的质量为2.657×10-26Kg
1个铁原子的质量为9.288×10-26Kg
书写、记忆、使用都不方便
以质子数和中子数都是6的碳原子(碳12)的质量的1/12(约1.66×10-27Kg)作为标准,其他原子的质量跟它的比值,就是这种原子的相对原子质量。
原子的质量主要集中在原子核上,那么,原子的相对原子质量也是由原子核决定的。
总结:.
请看下表,按要求回答问题
原子种类
质子数
中子数
核外电子数
相对原子质量
氢
1
0
氧
8
16
镁
12
12
铁
26
56
个别回答、书写
下列说法是否正确?
1.相对原子质量就是原子的真实质量。
2.相对原子质量的单位是g或Kg
3.原子的实际质量越大,其相对原子质量越大。
观察P48几种常见原子的相对原子质量,并与原子结构相比较。
在线测试P481.,2.
长话短说P48
讨论:
科学家发现相对原子质量为1、2、3的三种氢原子,你认为它们在结构上有什么异同。
挑战自我P49 1,2,3
⑴请把左图中的空白处填完整。
⑵通过填表,分析数据,你从中得出什么规律(至少写两条)
①
②
③
课 题
第三节 原子的构成
课 型
新 授
第3课时
第 周
年 月 日
教
学
目
标
1.了解原子、分子和离子的异同点和相互关系,会用原子和分子的观点说明化学反应的发生过程。
2.知道原子结构示意图的含义,了解离子的形成过程。
3.分析推断能力的培养
学情分析
核外电子排布内容,比较抽象,学生不好理解,需要创设情境帮助学生突破。
重 点
核外电子排布
难 点
核外电子排布
关 键 点
理解“分层排布”的含义
教学媒体
多媒体素材
教学方法
自学研究法、讲述法、谈话法、讨论法、练习法
板 书 设 计
第三节 原子的构成
二、原子中的电子
1.核外的电子是分层排布的
(排布规律)
2.原子结构示意图
3.原子的分类
⑴金属原子
⑵非金属原子
⑶稀有气体原子
4.离子
书写
分类
5.元素周期表
6.原子序数
7.电子云
教 学 过 程
知 识 点
教 师 活 动
学 生 活 动
二、原子中的电子
1.核外的电子是分层排布的
(排布规律)
2.原子结构示意图
3.原子的分类
4.离子
书写
分类
阳离子
阴离子
5.元素周期表
6.原子序数
7.电子云
⑴在多电子的原子中,核外电子的能量不同,能量高的离核远,能量低的离核近;⑵电子尽可能在离原子核近的电子层上运动;⑶每层最多容纳2n2个电子(n为电子层);⑷最外层电子数不超过8个电子(离原子核最近的为第一层,第一层为最外层时电子数不超过2个)。
图中小圆圈表示原子核,圈内数字表示核内质子数,“+”表示原子核带正电,弧线表示电子层,弧线上的数字表示该层上的电子数。
⑴金属原子,最外层电子数一般少于4个,不稳定,易失去电子,带正电荷。
⑵非金属原子,最外层电子数一般多于4个,不稳定,易得到电子,带负电荷。
⑶稀有气体原子,最外层电子数一般为8个,(氦是2个),稳定,既不易失去、也不易得到电子。
在化学反应中,原子核是不变的,发生改变的是核外电子(最外层电子数)。
也是构成物质的一种微粒。
(带电荷的原子或原子团)
在元素符号的右上方,标出带几个单位的什么电荷。如:Mg2+,Al3+ ,F-,O2-
带正电荷的离子叫阳离子,如Na+,Mg2+,Al3+,H+等。
带负电荷的离子叫阴离子,如:F-,O2-,Cl-,S2-等。
决定原子化学性质的是原子的最外层上的电子数。
组成世界万物的元素,只有一百多种,它们的原子核内的质子数是连续的,核外电子排布和原子的性质还有明显的规律性。
共7个横行(即7个周期),18个纵行,每个纵行为一个族(8、9、10三个纵行共同组成一个族)。
原子序数=质子数=核电荷数
小结:
1.原子的结构
2.原子结构示意图
3.离子的分类及符号表示
4.熟记元素周期表中前18种元素的名称、顺序及符号。
了解排布规律
记忆1~18号(即H~Ar)元素的顺序、名称和符号
分析P45氧原子的结构示意图
练习画出下列原子的结构示意图
H、C、N、F、S、Cl、Na、Mg、Al、K、He、Ne、Ar
并分析在结构上的特点。
结论
分析P46NaCl的形成过程
分析:
离子所带的电荷数与原子结构的关系?
观察离子符号的书写,
交流共享:
构成物质的基本微粒——分子、原子、离子有何异同?它们之间有什么关系?
你能看出原子的性质与原子的核外电子排布有什么关系?
观察附录 元素周期表
记忆1~18号元素的名称、顺序及符号。
思考:决定原子序数的是什么?
多识一点P47
能力提高:
某微粒的结构示意图为下图所示,你能确定X的值吗?它可以表示哪些微粒,试一一写出。
初中鲁教版第三节 原子的构成精品教案: 这是一份初中鲁教版第三节 原子的构成精品教案,共5页。教案主要包含了知识与技能,过程与方法等内容,欢迎下载使用。
化学第三节 原子的构成教案: 这是一份化学第三节 原子的构成教案,共4页。教案主要包含了教学设计思路分析, 教材内容分析,教学目标,教学重点,教学难点,教学过程,复习回顾 导入新课,板书课题等内容,欢迎下载使用。
初中化学鲁教版九年级上册第三节 原子的构成教学设计及反思: 这是一份初中化学鲁教版九年级上册第三节 原子的构成教学设计及反思,共2页。教案主要包含了教学目标,教学重难点,教学过程等内容,欢迎下载使用。