

2022届高三化学二轮复习:考点突破 科学探究 word版含答案
展开2022届高三化学二轮复习:考点突破
科学探究
1. 探究Na2SO3固体的热分解产物。
资料:①4Na2SO3Na2S+3Na2SO4
②Na2S能与S反应生成Na2Sx,Na2Sx与酸反应生成S和H2S。
③BaS易溶于水。
隔绝空气条件下,加热无水Na2SO3固体得到黄色固体A,过程中未检测到气体生成。黄色固体A加水得到浊液,放置得无色溶液B。
(1)检验分解产物Na2S:取少量溶液B,向其中滴加CuSO4溶液,产生黑色沉淀,证实有S2-。反应的离子方程式是 。
(2)检验分解产物Na2SO4:取少量溶液B,滴加BaCl2溶液,产生白色沉淀,加入盐酸,沉淀增多(经检验该沉淀含S),同时产生有臭鸡蛋气味的气体(H2S),由于沉淀增多对检验造成干扰,另取少量溶液B,加入足量盐酸,离心沉降(固液分离)后,____(填操作和现象),可证实分解产物中含有SO。
(3)探究(2)中S的来源。
来源1:固体A中有未分解的Na2SO3,在酸性条件下与Na2S反应生成S。
来源2:溶液B中有Na2Sx,加酸反应生成S。
针对来源1进行如图实验:
①实验可证实来源1不成立。实验证据是 。
②不能用盐酸代替硫酸的原因是 。
③写出来源2产生S的反应的离子方程式: 。
(4)实验证明Na2SO3固体热分解有Na2S,Na2SO4和S产生。运用氧化还原反应规律分析产物中S产生的合理性: 。
2. 为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:
已知:Cr2O72-(橙色)+ H2O2CrO42-(黄色)+ 2H+
(1)进行实验i和ii:
序号
操作
现象
i
向2 mL pH = 2的0.05 mol·L−1 K2Cr2O7橙色溶液中滴加饱和Na2SO3溶液(pH 约为 9)3滴
溶液变绿色(含Cr3+)
ii
向2 mL pH = 8的0.1 mol·L−1 K2CrO4黄色溶液中
滴加饱和Na2SO3溶液3滴
溶液没有明显变化
①用化学用语表示饱和Na2SO3溶液pH约为9的原因: 。
②用离子方程式解释i中现象: 。
(2)继续进行实验iii:
序号
操作
现象
iii
向2 mL饱和Na2SO3溶液中滴加pH = 2的0.05 mol·L−1 K2Cr2O7橙色溶液3滴
溶液变黄色
为了说明产生上述现象的原因,补充实验:
向2 mL蒸馏水中滴加pH = 2的0.05 mol·L−1 K2Cr2O7橙色溶液3滴,溶液变成浅橙色。
①补充实验的目的是 。
②用化学平衡移动原理解释iii中现象: 。
③根据实验i~iii,可推测:Na2SO3溶液和铬(VI)盐溶液的反应与溶液酸碱性有关。
a. 碱性条件下,Na2SO3溶液和铬(VI)盐溶液不发生氧化还原反应;
b. 。
④向实验iii所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测。该现象
是 。
(3)为探究溶液酸性增强对Na2SO3溶液还原性或铬(VI)盐溶液氧化性的影响,该同学
利用下图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧
化性与还原性强弱差异越大,电压越大)。
a. K闭合时,电压为x。
b. 向U型管左侧溶液中滴加硫酸至pH = 2后,电压增大了y。
c. 继续向U型管右侧溶液中滴加硫酸后,无气体逸出,电压
几乎不变。
①上述实验说明: 。
②有同学认为:随溶液酸性增强,溶液中O2的氧化性增强
也会使电压增大。利用右图装置选择合适试剂进行实验,
结果表明O2的存在不影响上述结论。该实验方案是 ,测得电压增大了z(z
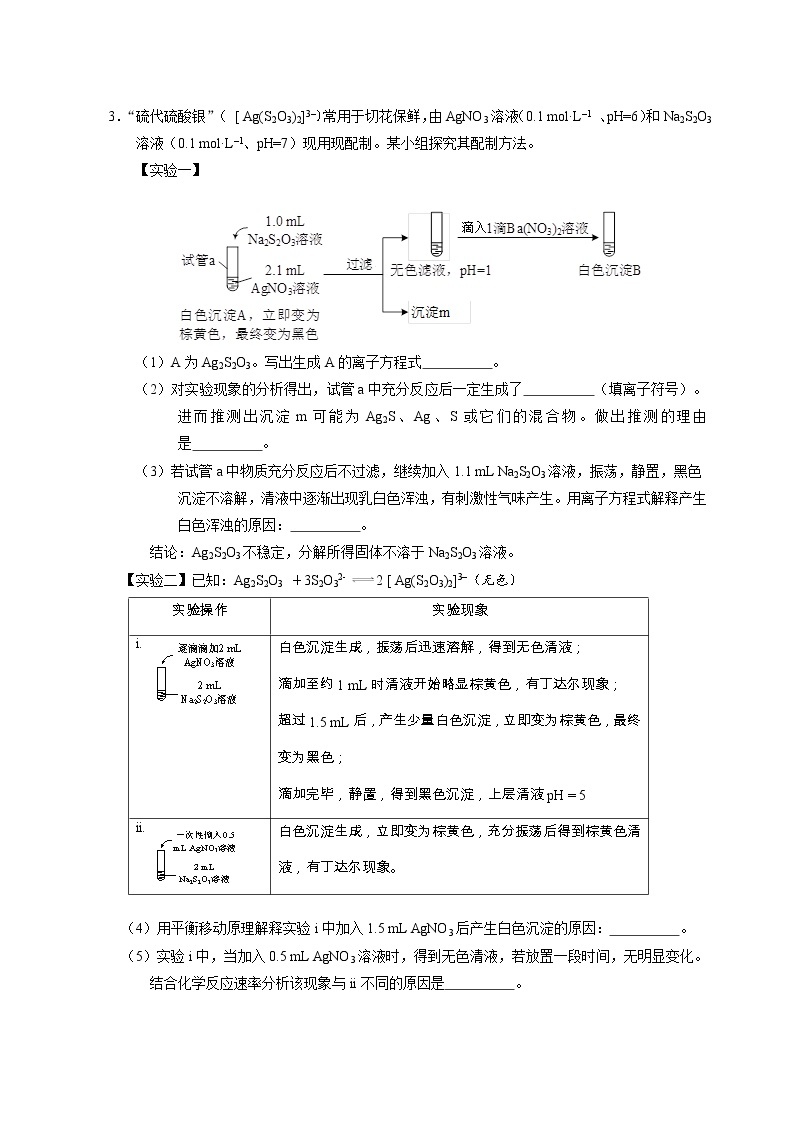
【实验一】
(1)A为Ag2S2O3。写出生成A的离子方程式 。
(2)对实验现象的分析得出,试管a中充分反应后一定生成了 (填离子符号)。进而推测出沉淀m可能为Ag2S、Ag、S或它们的混合物。做出推测的理由是 。
(3)若试管a中物质充分反应后不过滤,继续加入1.1 mL Na2S2O3溶液,振荡,静置,黑色沉淀不溶解,清液中逐渐出现乳白色浑浊,有刺激性气味产生。用离子方程式解释产生白色浑浊的原因: 。
结论:Ag2S2O3不稳定,分解所得固体不溶于Na2S2O3溶液。
【实验二】已知:Ag2S2O3 +3S2O32- 2 [ Ag(S2O3)2]3–(无色)
实验操作
实验现象
i.
白色沉淀生成,振荡后迅速溶解,得到无色清液;
滴加至约1 mL时清液开始略显棕黄色,有丁达尔现象;
超过1.5 mL后,产生少量白色沉淀,立即变为棕黄色,最终变为黑色;
滴加完毕,静置,得到黑色沉淀,上层清液pH = 5
ii.
白色沉淀生成,立即变为棕黄色,充分振荡后得到棕黄色清液,有丁达尔现象。
(4)用平衡移动原理解释实验i中加入1.5 mL AgNO3后产生白色沉淀的原因: 。
(5)实验i中,当加入0.5 mL AgNO3溶液时,得到无色清液,若放置一段时间,无明显变化。结合化学反应速率分析该现象与ii不同的原因是 。
(6)简述用0.1 mol·L–1 AgNO3溶液和0.1 mol·L–1 Na2S2O3溶液配制该保鲜剂时,试剂的投料比和操作: 。
4.某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取出少量黑色固体,洗涤后,_______(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_______________。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___________________(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号
取样时间/min
现象
ⅰ
3
产生大量白色沉淀;溶液呈红色
ⅱ
30
产生白色沉淀;较3 min时量少;溶液红色较3 min时加深
ⅲ
120
产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅
(资料:Ag+与SCN-生成白色沉淀AgSCN)
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据_______现象,判断溶液中存在Ag+,可产生Fe3+。
③ 下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的________溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是________,操作及现象是________________。
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:______。
5.某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
【实验Ⅰ】
试剂:酸化的0.5 mol·L-1 FeSO4溶液(pH = 0.2),5% H2O2溶液(pH = 5)
操作
现象
取2 mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液
溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH = 0.9
向反应后的溶液中加入KSCN溶液
溶液变红
(1)上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是________。
(2)产生气泡的原因是________。
【实验Ⅱ】
试剂:未酸化的0.5 mol·L-1 FeSO4溶液(pH = 3),5% H2O2溶液(pH = 5)
操作
现象
取2 mL 5% H2O2溶液于试管中,加入5滴上述FeSO4溶液
溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊。测得反应后溶液pH = 1.4
(3)将上述混合物分离,得到棕黄色沉淀和红褐色胶体。取部分棕黄色沉淀洗净,加4 mol·L-1盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有Fe2O3,经检验还含有SO42-。检验棕黄色沉淀中SO42-的方法是________。
(4)对于生成红褐色胶体的原因,提出两种假设:
i. H2O2溶液氧化Fe2+ 消耗H+
ii.Fe2+ 氧化的产物发生了水解
① 根据实验II记录否定假设i,理由是________。
② 实验验证假设ii:取_______,加热,溶液变为红褐色,pH下降,证明假设ii成立。
(5)将FeSO4溶液加入H2O2溶液后,产生红褐色胶体,反应的离子方程式是________。
【实验Ⅲ】
若用FeCl2溶液替代FeSO4溶液,其余操作与实验II相同,除了产生与II相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(6)产生刺激性气味气体的原因是________。
(7)由实验Ⅰ、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与________(至少写两点)有关。
6.某学习小组探究稀HNO3、浓HNO3与铜的反应。
装置(尾气处理装置略)
现象
Ⅰ中开始无明显现象,渐有小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色。
Ⅱ中反应剧烈,迅速生成大量红棕色气体,溶液呈绿色。
(1)试管Ⅰ中Cu与稀HNO3反应的化学方程式是 。
(2)Ⅱ中反应的速率比Ⅰ中的快,原因是 。
(3)针对Ⅱ中溶液呈绿色的原因,提出假设:
假设1:Cu2+的浓度较大所致;
假设2:溶解了生成的NO2。
探究如下:取Ⅱ中绿色溶液,分为两等份。
① 取一份于右图所示装置中, (填“操作”和“现象”),
证实Ⅱ中溶解了NO2。
② 向另一份溶液加入 (填化学试剂),溶液变为蓝色。证实假设1不成立,假设2成立。
(4)对于稀HNO3与铜生成NO、浓HNO3与铜生成NO2的原因,提出两种解释:
解释1.HNO3浓度越稀,溶液中NO3- 的数目越少,被还原时,每个NO3- 从还原剂处获得较多电子的机会 (填“增多”或“减少”),因此被还原为更低价态。
解释2.推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。
① B中盛放的试剂是 。
② C中盛放Cu(NO3)2和 。
③ 该小组证实推测的合理性所依据的实验现象是 。
7.实验小组研究酸性条件下K2Cr2O7溶液和H2O2溶液的反应。
【实验Ⅰ】向盛有H2O2溶液的试管中,加入过量的K2Cr2O7溶液和硫酸,振荡,溶液立即变为紫红色,此时pH=1。溶液中持续产生气泡,最终溶液变为绿色。
资料:
ⅰ.Cr2(SO4)3溶液呈绿色。
ⅱ.酸性条件下,K2Cr2O7溶液和H2O2溶液反应生成CrO5,CrO5进一步反应生成Cr3+和O2。
ⅲ.CrO5是一种+6价Cr的过氧化物,其结构如右图,CrO5可溶于水,
易溶于乙醚得到蓝色溶液。
ⅳ.乙醚是一种无色、不溶于水、密度比水小的有机溶剂,化学性质稳定。
(1)实验Ⅰ中产生的气体是O2,检验的方法是______ __。
(2)实验Ⅰ的紫红色溶液中含有CrO5。
① 验证紫红色溶液中含有CrO5的操作及现象是_____ ___。
② 生成CrO5的反应不是氧化还原反应,反应的离子方程式是_____ ___。
(3)对实验Ⅰ中溶液变为绿色和产生O2的原因,作出如下假设:
a.CrO5在酸性溶液中不稳定,自身氧化还原生成Cr3+和O2。
b.CrO5在酸性条件下氧化了溶液中的H2O2,生成Cr3+和O2。
为验证上述假设,用下图装置进行实验Ⅱ和实验Ⅲ(夹持装置已略,B中石蜡油
用于吸收挥发出的乙醚)。实验操作及现象如下:
【实验Ⅱ】
ⅰ.将20 mL CrO5的乙醚溶液加入A中的20 mL
pH=1的稀硫酸中,不断搅拌,乙醚层由蓝色
变为无色,水层变为绿色,O2体积为V mL。
ⅱ.步骤ⅰ结束后向A中加入少量K2Cr2O7溶
液,轻轻搅拌,静置,乙醚层又显出蓝色。
【实验Ⅲ】
仅将实验Ⅱ中的pH=1的稀硫酸替换为等量的含H2O2的pH=1的稀硫酸,重复实验。
现象与实验Ⅱ相同,且O2体积仍为V mL。
① 实验Ⅱ步骤ⅰ中消耗的CrO5与生成的O2的物质的量之比为2∶3,补全离子方程式:
2CrO5 +________ == 2Cr3+ + 3O2↑+ ________ + ________。
② 甲同学认为依据实验Ⅱ和Ⅲ中生成O2的体积相同,无法说明假设b是否成立,其理由是_____ ___。
(4)实验Ⅰ中总反应的离子方程式是________。
8.某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
(1)方案1:通过置换反应比较向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。反应的离子方程式是 ,说明氧化性Ag+>Cu2+。
(2)方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较
实验
试剂
编号及现象
试管
滴管
1.0 mol·L-1
KI溶液
1.0 mol·L-1
AgNO3溶液
Ⅰ.产生黄色沉淀,溶液无色
1.0 mol·L-1
CuSO4溶液
Ⅱ.产生白色沉淀A,溶液变黄
① 经检验,Ⅰ中溶液不含I2,黄色沉淀是 。
② 经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认A的实验如下:
a.检验滤液无I2。溶液呈蓝色说明溶液含有 (填离子符号)。
b.白色沉淀B是 。
c.白色沉淀A与AgNO3溶液反应的离子方程式是 ,说明氧化性Ag+>Cu2+。
(3)分析方案2中Ag+ 未能氧化I- ,但Cu2+氧化了I-的原因,设计实验如下:
编号
实验1
实验2
实验3
实验
现象
无明显变化
a中溶液较快变棕黄色,b中电上析出银;电流计指针偏转
c中溶液较慢变浅黄色;电流计指针偏转
(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)
① a中溶液呈棕黄色的原因是 (用电极反应式表示)。
② “实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是 。
③ 方案2中,Cu2+能氧化I-,而Ag+未能氧化I-的原因: 。
(资料:Ag+ + I- = AgI↓ K1 =1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2 K2 = 8.7×108)
9. 化学变化是有条件的。某小组同学探究I-与金属阳离子的氧化还原反应,实验过程如下。
已知同浓度的稀溶液中氧化性:
(1)根据实验I和Ⅱ,请回答下列问题。
①由“黄色立即加深”初步判断有I2生成,选择 (填试剂)进一步证实生成了I2。
②写出Fe3+与I-反应的离子方程式 ,该条件下氧化性:Fe2+ I2
(选填“>”或“<”)。
③实验Ⅱ的目的是____。
(2)实验Ⅳ中Cu2+与I-反应的离子方程式是 ,甲同学得出氧化性:Cu2+ >I2。
(3)乙同学认为甲同学的结论不合理,分析原因:实验Ⅲ应有
I2生成,但却生成了Agl沉淀,因此推测实验Ⅳ中I2的生
成,与Cul沉淀有关,故不能确定氧化性:Cu2+>I2,并用
右图装置进行验证。K闭合后,较长时间发现两侧溶
液均无明显变化。乙同学为了进一步判断Cu2+和I2
的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中
加入少量 (填试剂),发现指针偏转,且左侧溶液颜色加深,证明该条件下氧化性:Cu2+ I2 (选填“>”或“<”)。
(4)该小组同学进一步分析认为,实验Ⅲ没有发生2Ag++ 2I-=2Ag+I2的反应,原因是生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅳ发生氧化还原反应的原因是____。
(5)小组同学反思实验,反应体系中,各物质浓度对氧化还原反应是否发生都有一定的影响。
10.某同学利用Cl2氧化K2MnO4制备KMnO4的装置如下图所示(夹持装置略):
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
回答下列问题:
(1)装置A中a的作用是 ;装置C中的试剂为 ;装置A中制备Cl2的化学方程式为 。
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是 。
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入 (填“酸式”或“碱式”)滴定管中;在规格为50.00mL的滴定管中,若KMnO4溶液起始读数为15.00mL,此时滴定管中KMnO4溶液的实际体积为 (填标号)。
A.15.00 mL B.35.00mL C.大于35.00mL D.小于15.00mL
(4)某FeC2O4·2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4·2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取m g样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。用 c mol﹒L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
样品中所含的质量分数表达式为 。
下列关于样品组成分析的说法,正确的是 (填标号)。
A.时,样品中一定不含杂质
B.越大,样品中含量一定越高
C.若步骤I中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
11.为测定CuSO4溶液的浓度,甲、乙两同学设计了两个方案。回答下列问题:
Ⅰ. 甲方案
实验原理:
实验步骤:
(1)判断SO42−沉淀完全的操作为 。
(2)步骤②判断沉淀是否洗净所选用的试剂为 。
(3)步骤③灼烧时盛装样品的仪器名称为 。
(4)固体质量为w g,则c(CuSO4)= mol·L−1。
(5)若步骤①从烧杯中转移沉淀时未洗涤烧杯,则测得c(CuSO4) (填“偏高”、“偏低”或“无影响”)。
Ⅱ. 乙方案
实验原理:
实验步骤:
①按如图安装装置(夹持仪器略去)
②……
③在仪器A、B、C、D、E中加入图示的试剂
④调整D、E中两液面相平,使D中液面保持在0或略低于0刻度位置,读数并记 录。
⑤将CuSO4溶液滴入A中搅拌,反应完成后,再滴加稀硫酸至体系不再有气体 产生
⑥待体系恢复到室温,移动E管,保持D、E中两液面相平,读数并记录
⑦处理数据
(6)步骤②为 。
(7)步骤⑥需保证体系恢复到室温的原因是 (填序号)。
a.反应热受温度影响
b.气体密度受温度影响
c.反应速率受温度影响
(8)Zn粉质量为a g,若测得H2体积为b mL,已知实验条件下,则c(CuSO4)_____________mol·L−1(列出计算表达式)。
(9)若步骤⑥E管液面高于D管,未调液面即读数,则测得c(CuSO4) (填“偏高”、“偏低”或“无影响”)。
(10)是否能用同样的装置和方法测定MgSO4溶液的浓度: (填“是”或“否”)。
12.“84消毒液”广泛应用于杀菌消毒,其有效成分是NaClO。实验小组制备消毒液,并利用其性质探索制备碘水的方法。
资料:i. HClO的电离常数为Ka=4.7×10-8;
H2CO3的电离常数为K1=4.3×10-7、K2=5.6×10-11。
ii.碘的化合物主要以I−和IO3−的形式存在,IO3−+5I−+6H+==3I2+3H2O。
iii.碘单质能与I−反应:I2+I−I3−(I3−低浓度时显黄色,高浓度时为棕色)。
Ⅰ.制备消毒液(夹持装置略)
D
A B
浓NaOH溶液
NaOH
溶液
浓盐酸
C
KMnO4
浓NaOH溶液
NaHCO3
溶液
(1)制备NaClO消毒液的装置是______ (填C或D)。
(2)制备完成后,向C装置的溶液中添加NaOH、Na2SiO3等物质,得到与某品牌成份相同的消毒液,用平衡移动原理解释NaOH的作用__ ____。
(3)结合资料i,写出D中反应的化学方程式__ ____。
Ⅱ.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
方案
操作
现象
反应后加淀粉溶液
1
烧杯1溶液中加入9g KI固体
溶液为橙黄色
……
2
烧杯2溶液中加入9g KI固体
再加入1mo/L盐酸10mL
西城二模计算得出
溶液颜色快速加深,呈紫红色
变蓝
3
烧杯3溶液中加入少量KI固体(小于0.5g)
振荡后溶液保持无色
不变蓝
(4)对比不同方案的实验现象,得出制取碘水的最佳方法要关注的因素是______。
(5)针对烧杯3“滴加淀粉溶液不变蓝”的原因,提出两种假设:
假设1:过量的NaClO将反应生成的I2氧化为IO3−。
设计实验证实了假设1成立。NaClO氧化I2生成IO3−的离子方程式是______。
假设2:生成的I2在碱性溶液中不能存在。
设计实验a证实了假设2成立,实验a的操作及现象是______。
(6)某小组检验烧杯3所得溶液中含IO3−:取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在IO3−,说明理由______。
(7)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据______。
13.某小组通过分析镁与酸反应时pH的变化,探究镁与醋酸溶液反应的实质。
【实验】在常温水浴条件下,进行实验Ⅰ~Ⅲ,记录生成气体体积和溶液pH的变化:
Ⅰ.取0.1 g光亮的镁屑(过量)放入10 mL 0.10 mol·L–1 HCl溶液中;
Ⅱ.取0.1 g光亮的镁屑放入10 mL 0.10 mol·L–1 CH3COOH溶液(pH = 2.9)中;
Ⅲ.取0.1 g光亮的镁屑放入10 mL pH = 2.9 HCl溶液中。
【数据】
图1 图2
(1)起始阶段,Ⅰ中主要反应的离子方程式是 。
(2)Ⅱ起始溶液中约为 。(选填“1”、“10”或“102”)
(3)起始阶段,导致Ⅱ、Ⅲ气体产生速率差异的主要因素不是c(H+),实验证据是 。
(4)探究Ⅱ的反应速率大于Ⅲ的原因。提出假设:CH3COOH能直接与Mg反应。
进行实验Ⅳ: 。得出结论:该假设成立。
(5)探究醋酸溶液中与Mg反应的主要微粒,进行实验Ⅴ。
与Ⅱ相同的条件和试剂用量,将溶液换成含0.10 mol·L–1的 CH3COOH与0.10 mol·L–1 CH3COONa的混合溶液(pH = 4.8),气体产生速率与Ⅱ对比如下。
a. 实验Ⅴ起始速率
b. 实验Ⅱ起始速率
c. 实验ⅡpH=4.8时速率
2.1 mL·min–1
2.3 mL·min–1
0.8 mL·min–1
对比a~c中的微粒浓度,解释其a与b、a与c气体产生速率差异的原因: 。
(6)综合以上实验得出结论:
①镁与醋酸溶液反应时,CH3COOH、H+、H2O均能与镁反应产生氢气;
② 。
(7)实验反思:120 min附近,Ⅰ~ⅢpH均基本不变,pH(Ⅰ) ≈ pH(Ⅱ) < pH(Ⅲ),
解释其原因: 。
14.为进一步研究过氧化钠与水的反应,某活动小组进行了如下探究。
(1)把一定量水滴入盛有少量过氧化钠固体的试管中,反应的化学方程式为 。
(2)向反应后的溶液中滴入酚酞,一段时间后,发现溶液颜色逐渐变浅,最后颜色消失。为探究原因,进行实验1(环境温度为30℃)结果如下:
NaOH溶液浓度/(mol/L)
10.0
2.0
1.0
0.10
0.010
滴入酚酞时现象
深紫红色
深红色
深红色
深红色
深红色
溶液变为浅红色时间
2~3s
26~30s
54~60s
6~7min
45min内稳定不变
溶液完全褪色时间
7~8s
50~54s
几乎无色
100~110s
几乎无色
20min后仍为浅红色
2h后略变浅
最终溶液是否褪色
褪色
褪色
褪色
不褪色
不褪色
结合表中数据,判断下列说法正确的是 。(填字母)
a. 其他条件相同时,NaOH溶液浓度越大褪色越快
b. 溶液褪色可能是NaOH溶液浓度过大导致的
c. 当NaOH溶液浓度大于或等于1.0 mol/L时,对溶液颜色变化有明显影响
(3)中间产物H2O2也可能会对溶液颜色的变化产生影响。
①假设1:受H2O2自身氧化性的影响。
为验证假设,设计实验方案: 。实验表明,随H2O2浓度的增大,溶液颜色变化更快。
②假设2: 。
为验证假设,设计了实验2,请补全实验装置。
实验2结果如下:
NaOH溶液浓度/(mol/L)
滴入酚酞时现象
溶液完全褪色时间
2.0
深红色
约50s
1.0
深红色
约1min50s
对比实验1,表中数据说明 。
(4)若准确称取Na2O2的质量为1.56 g,加入一定体积的水后得到20 mL溶液,则所得NaOH溶液的物质的量浓度为 。
(5)实验过程中,需待Na2O2固体完全溶解后再加入酚酞,原因是 。
综上所述,Na2O2与水反应过程复杂,滴入酚酞时溶液颜色变化受多因素影响。
2022届高三化学二轮复习:考点突破
科学探究 参考答案
1. (1) S2-+Cu2+=CuS↓
(2)滴加BaCl2溶液,产生白色沉淀,
(3)向溶液2中加入KMnO4溶液,溶液没有褪色
(4)盐酸中Cl元素为-1价,是Cl元素的最低价,具有还原性,会与KMnO4溶液发生氧化还原反应,使KMnO4溶液应该褪色,干扰实验现象和实验结论;
(5) Sx2-+2H+=H2S↑+(x-1)S↓
(6)根据反应4Na2SO3Na2S+3Na2SO4可知,Na2SO3发生歧化反应,其中的S元素化合价即可升高也可降低,能从+4价降为-2价,也应该可以降到0价生成硫单质
2.(1)①SO32- + H2OHSO3- + OH-
②Cr2O72- + 3SO32- + 8H+ === 2Cr3+ + 3SO42- + 4H2O
(2)① 排除水的稀释对溶液颜色变化造成的影响
②Cr2O72-(橙色)+ H2O2CrO42-(黄色)+ 2H+,溶液中大量的SO32-(或OH-)与
H+结合导致溶液中c(H+)下降,平衡正向移动,溶液颜色变黄
③ 酸性条件下,Na2SO3溶液和铬(VI)盐溶液发生氧化还原反应,生成Cr3+
④溶液变绿
(3)① 溶液酸性增强,铬(VI)盐溶液的氧化性增强,Na2SO3溶液的还原性几乎没有变化
②U型管左管中盛放pH= 8 0.1mol·L-1 K2SO4溶液,右管盛放饱和Na2SO3溶液,闭
合K,记录电压;向左管溶液中滴加硫酸至pH=2后,记录电压(或其他合理答案)
3.(1)Ag++= Ag2S2O3↓
(2)H+、
得到的是氧化产物,必然要生成其他还原产物
(3)
(4)过量Ag+与结合,使c()降低,Ag2S2O3+3S2O32-2[Ag(S2O3)2]3-逆向移动,析出沉淀
(5)逐滴滴加AgNO3时,Ag2S2O3的溶解速率大于分解速率;迅速混合时部分Ag2S2O3来不及溶解即发生分解,分解产物不能再溶于Na2S2O3
(6)Na2S2O3和AgNO3物质的量之比大于2:1,在不断搅拌下将AgNO3溶液缓缓加入到Na2S2O3溶液中
4.(1)①加硝酸加热溶解固体,再滴加稀盐酸,产生白色沉淀
②Fe2+
(2)Fe+2Fe3+=3Fe2+
②4Fe2++O2+4H+=4Fe3++2H2O 加入KSCN溶液后产生白色沉淀
③0.05 mol·L-1 NaNO3溶液 FeSO4溶液
分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,后者红色更深
(3)溶液中存在反应:①Fe+2Ag+=Fe2++2Ag ,②Ag++Fe2+=Ag+Fe3+,③Fe+2Fe3+=3Fe2+。反应开始时,c(Ag+)大,以反应①、②为主,c(Fe3+)增大。约30分钟后,c(Ag+)小,以反应③为主,c(Fe3+)减小。
5.(1)2Fe2+ + H2O2 + 2H+ ==2Fe3+ + 2H2O
(2)Fe3+催化下H2O2分解产生O2(或用化学方程式表示)
(3)取加入盐酸后的黄色溶液少许于试管中,加入BaCl2溶液,产生白色沉淀,说明棕黄色沉淀中含有SO42-
(4)①反应后溶液的pH降低
② Fe2(SO4)3溶液
(5)2Fe2++H2O2+4H2O== 2Fe(OH)3(胶体)+4H+
(6)H2O2分解反应放热,促进Fe3+的水解平衡正向移动,产生的HCl受热挥发
(7)pH、阴离子种类、温度、反应物用量
6.(1)
(2)硝酸浓度大
(3)① 向上拉动活塞a,试管内液面上方出现红棕色气体
② (或CuO等)
(4)解释1.增多
解释2.① 水
② 浓硝酸
③ C中溶液变绿
7.(1)将带火星的木条伸入试管中,木条复燃,说明生成的气体是O2(1分)
(2)① 取少量紫红色溶液于试管中,加入乙醚,振荡,静置,液体分为两层,上层呈蓝色(2分)
② Cr2O72− + 4H2O2 + 2H+ == 2CrO5 + 5H2O(2分)
(3)① 2CrO5 + 6H+== 2Cr3+ + 3O2↑+ H2O2 + 2H2O(2分)
② 实验Ⅱ、Ⅲ中,O2来源于CrO5、H2O2中的−1价O,且−1价O过量,当CrO5的量相同时,生成O2的体积相同,因而由实验Ⅱ和Ⅲ中生成O2的体积相同无法说明假设b是否成立(1分)
(4)Cr2O72− + 3H2O2 + 8H+ == 2Cr3+ + 3O2↑+ 7H2O(2分)
8.(1)
(2)① AgI
② a.
b.AgCl
c.
(3)①
② 将d烧杯内的溶液换为pH≈4的1 mol/L 溶液,c中溶液较慢变浅黄,电流计指针偏转
(4)K1>K2,故更易与发生复分解反应,生成AgI。2Cu2+ + 4I- = 2CuI + I2 ,生成了CuI沉淀,使得的氧化性增强。
9.
10.(1)平衡气压,使浓盐酸顺利滴下; NaOH溶液;
(2)在装置A、B之间加装盛有饱和食盐水的洗气瓶
(3)酸式;C
(4);B、D
11.(1)向上层清液中继续滴加BaCl2溶液,无白色沉淀生成,则沉淀完全
(2)AgNO3溶液
(3)坩埚
(4)
(5)偏低
(6)检查装置气密性
(7)b
(8)
(9)偏高
(10)否
12.(1)C
(2)ClO− + H2OOH− + HClO,加入NaOH使c(OH−)增大,平衡逆移,使c(HClO)减小,分解速率减慢(或消毒液更稳定) )
(3)Cl2 + NaHCO3 == HClO + NaCl + CO2
(4)溶液的酸碱性;消毒液和KI的相对用量(合理即可)
(5)5ClO− + I2 + H2O == 2IO3−+5Cl− +2H+
向与烧杯3 pH相同的NaOH溶液中加入滴有淀粉溶液的碘水,振荡,蓝色褪去
(6)不能,溶液中存在大量ClO−的干扰,ClO−也可将I−氧化为I2使溶液变蓝
(7)“变蓝,因为发生反应ClO− + 2I− + H2O == I2 + Cl− + 2OH− (和 I2+I−I3−),溶液中存在I2单质”或“变蓝,溶液显橙黄色,肯定存在有色离子I2或I3−,反应生成的I2存在平衡I2+I−I3−,有I2会变蓝”;或“不变蓝,I2在碱性溶液中不存在,发生反应
3I2+6OH− == IO3−+5I−+3 H2O ”(合理即可)
13. (1)Mg + 2H+ = Mg2+ + H2↑
(2)102
(3)由图1可知起始阶段Ⅱ的速率远大于Ⅲ,但图2表明起始阶段Ⅱ的pH大于Ⅲ
(4)室温下,将光亮的镁屑投入冰醋酸中,立即产生气体
(5)a与b对比,c(CH3COOH)几乎相同,但b中c(H+) 约为a的100倍,使速率b > a;a与c对比, c(H+)几乎相同,但a中c(CH3COOH)约为c 的2倍,使速率a > c
(6)CH3COOH是与Mg反应产生气体的主要微粒
(7)120min附近,Mg(OH)2(s) Mg2+(aq) + 2OH–(aq)均达到平衡状态,因此pH基本不变;c(Mg2+) Ⅰ≈Ⅱ>Ⅲ,Ⅰ、Ⅱ中上述平衡相对Ⅲ逆移,c(OH–)减小,pH减小
14.(1)2Na2O2+ 2H2O === 4NaOH + O2↑(2分)
(2)abc(2分)
(3)①取等体积的0.010 mol/L的NaOH溶液分置于3个小烧杯中,分别滴加2d酚酞试液,然后同时加入3种不同浓度的H2O2溶液(2分)
30mL 10% H2O2溶液
②H2O2分解产生的O2的影响(1分)
(2分)
中间产物H2O2分解产生的O2对滴入酚酞溶液时颜色变化几乎没有影响(1分)
(4)2mol/L(1分)
(5)排除因Na2O2剩余时其氧化性对实验造成干扰(1分)
2022届高三化学二轮复习:考点突破 选择题: 化学平衡 word版含答案: 这是一份2022届高三化学二轮复习:考点突破 选择题: 化学平衡 word版含答案,共16页。试卷主要包含了1 kJ/ml,125 ml/,3%,6%等内容,欢迎下载使用。
2022届高三化学二轮复习:考点突破 化学反应原理 word版含答案: 这是一份2022届高三化学二轮复习:考点突破 化学反应原理 word版含答案,共24页。试卷主要包含了+247.4 kJ·ml-1,ΔH=247kJ/ml等内容,欢迎下载使用。
2022届高三化学二轮复习:考点突破 选择题: 热化学 word版含答案: 这是一份2022届高三化学二轮复习:考点突破 选择题: 热化学 word版含答案,共10页。试卷主要包含了6 kJ·ml-1,1 kJ·ml-1,2 kJ/ml,6 kJ·ml-1,9 kJ·ml-1,2kJ/ml,9 kJ/ml等内容,欢迎下载使用。












