



2022高考化学一轮复习(步步高)第五章 第28讲微专题15 “位—构—性”综合推断题的解题方法课件
展开元素周期表和元素周期律是高考考查的热点和重点,主要以选择题的形式考查元素在周期表中的位置、结构与性质的关系。如2020年全国卷Ⅱ第13题,2019年全国卷Ⅰ第13题,卷Ⅱ第9题,2018年全国卷Ⅰ第12题,卷Ⅱ第10题;2017年全国卷Ⅰ第12题,卷Ⅱ第9题等,都是结合原子结构、元素周期表、元素及其化合物知识的综合考查。
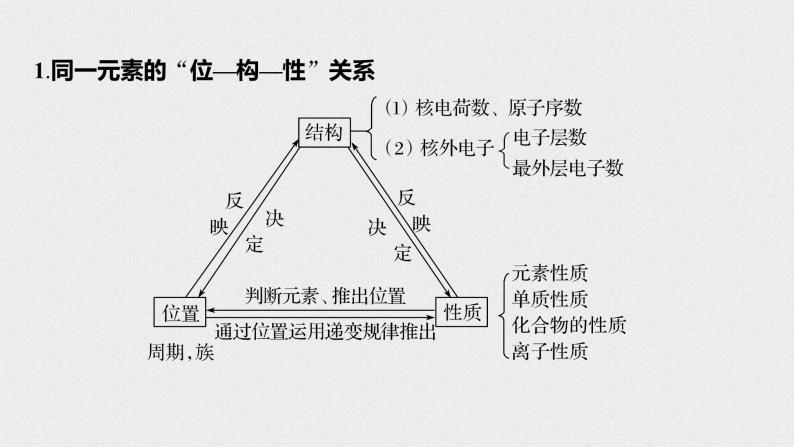
1.同一元素的“位—构—性”关系
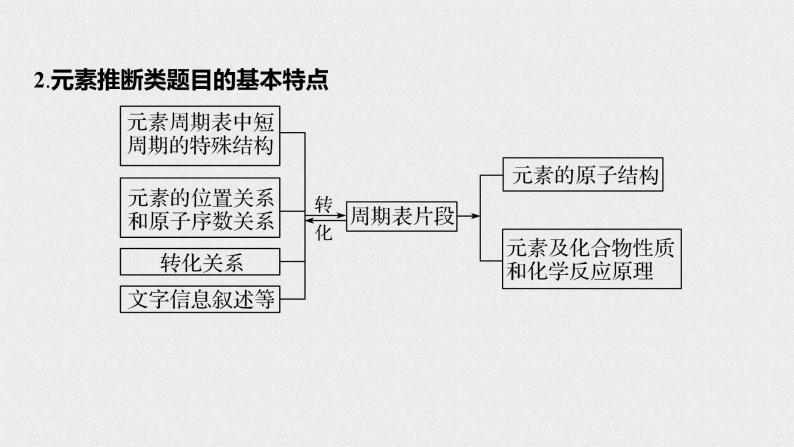
2.元素推断类题目的基本特点
3.推断题要点总结(1)结构与位置互推是解题的核心①掌握四个关系式:a.电子层数=周期数;b.质子数=原子序数;c.最外层电子数=主族序数;d.主族元素的最高正价=主族序数(O、F除外),负价=主族序数-8。②熟练掌握周期表的结构及周期表中的一些特殊规律a.“凹”型结构的“三短四长,七主七副八零完”;b.各周期元素种类;c.稀有气体的原子序数及在周期表中的位置;d.同主族上下相邻元素原子序数的关系。
(2)性质与位置互推是解题的关键熟悉元素周期表中同周期、同主族元素性质的递变规律,主要包括:①元素的金属性、非金属性;②气态氢化物的稳定性;③最高价氧化物对应水化物的酸碱性;④金属与水或酸反应置换H2的难易程度。(3)结构和性质互推是解题的要素①电子层数和最外层电子数决定元素的金属性和非金属性;②同主族元素最外层电子数相同,化学性质相似;③正确推断原子半径和离子半径的大小及结构特点;④判断元素金属性和非金属性的强弱。
题组一 结构特点与元素在周期表中的位置相结合推断1.短周期元素m、n、p、q在元素周期表中的排序如图所示,其中m的气态氢化物与其最高价氧化物对应的水化物能反应。下列说法正确的是A.非金属性:m>nB.氢化物稳定性:n
解析 m的气态氢化物与其最高价氧化物对应的水化物能反应,说明m 为氮元素,则n为氧元素,p为硫元素,q为氯元素。同周期元素从左到右,非金属性逐渐增强,则氮和氧比较,氧的非金属性强,故A错误;同主族元素从上到下,非金属性逐渐减弱,非金属性越强,其气态氢化物越稳定,则水的稳定性强于硫化氢,故B错误;硫离子和氯离子电子层结构相同,核电荷数越大,半径越小,所以硫离子半径大,故C正确;元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,非金属性Cl>S,则高氯酸的酸性强于硫酸,故D错误。
2.(2020·云南月考)W、X、Y、Z是原子序数依次增大的短周期元素,X、Y、Z原子的最外层电子数之和为15,X、Y、Z三种元素在周期表中的相对位置如图所示。W与X以原子个数比为2∶1形成的化合物常用作火箭燃料。下列说法正确的是A.简单离子半径:Y>X>WB.热稳定性:W2Y>XW3C.Z的最高价氧化物是酸性氧化物,不能与任何酸反应D.ZY2的化学键类型与MgCl2相同
解析 设Z的最外层电子数为a,由X、Y、Z原子的最外层电子数之和为15可得a+(a+1)+(a+2)=15,解得a=4,则Z为Si元素、X为N元素、Y为O元素,由W与X以原子个数比为2∶1形成的化合物常用作火箭燃料可知,W为H元素。电子层结构相同的离子,核电荷数越大,离子半径越小,则氮离子的离子半径大于氧离子,故A错误;元素的非金属性越强,氢化物的热稳定性越强,氧元素的非金属性强于氮元素,则水的稳定性强于氨气,故B正确;硅元素的最高价氧化物为二氧化硅,能与氢氟酸反应,故C错误;二氧化硅为共价化合物,化合物中含有共价键,氯化镁为离子化合物,化合物中含有离子键,化学键类型不相同,故D错误。
题组二 结构特点与物质特性或用途相结合推断3.(2019·河北衡水中学高三第一次联合考试)X、Y、Z、R、W是原子序数依次递增的五种短周期主族元素,它们所在周期数之和为11,其中Y元素最高与最低化合价的代数和为2,Y和Z的单质生成的化合物是一种传递神经信息的“信使分子”,R的原子半径是五种元素中最大的,Y和W是同族元素。下列说法错误的是A.简单离子的还原性:Y>ZB.R的单质可能是金属或非金属C.由X、Z和W构成的酸一定是三元酸D.标准状况下,1 ml YZ与0.5 ml Z2混合后所得气体的体积一定小于22.4 L
解析 Y为N元素,W为P元素,“信使分子”为NO,则Z为O元素;R的原子半径是五种元素中最大的,所以应为第三周期的Na、Mg、Al或Si,则X为H元素。A项,还原性:N3->O2-,正确;B项,R可能为Na、Mg、Al或Si,是金属或非金属,正确;C项,H、O、P也可能构成一元酸HPO3等,错误;D项,由于存在2NO2 N2O4,所以1 ml NO与0.5 ml O2混合后所得气体的物质的量小于1 ml,其体积在标准状况下一定小于22.4 L,正确。
4.蒙脱石散是一种温和的止泻剂,适合儿童使用。其主要成分是由A、B、D、E四种原子序数依次增大的短周期元素组成的物质D4[E4B10(BA)8],其中D元素是地壳中含量最高的金属元素,E元素的单质常用来制造太阳能电池,A3B+和BA-含有相同的电子数。下列说法错误的是A.原子半径:D>E>B>AB.简单氢化物的稳定性:E>BC.A、B组成的一种化合物是绿色氧化剂D.含E的一种盐溶液常作木材防火剂
解析 根据分析可知:A为H,B为O,D为Al,E为Si。同周期元素,从左到右原子半径依次减小,原子半径:Al>Si>O>H,故A正确;非金属性越强,简单氢化物的稳定性越强,非金属性:O>Si,则简单氢化物的稳定性:H2O>SiH4,故B错误;H2O2是绿色氧化剂,故C正确;Na2SiO3的水溶液常作木材防火剂,故D正确。
题组三 结构特点与物质的微观结构相结合推断5.(2021·哈尔滨市第六中学月考)科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,该超分子具有高效的催化性能,其分子结构示意图如图。W、X、Z分别位于不同周期,Z的原子半径在同周期元素中最大。(注:实线代表共价键,其他重复单元的W、X未标注)下列说法不正确的是A.Y单质的氧化性在同主族中最强B.离子半径:Z>YC.Z与Y可组成多种离子化合物D.氢化物的热稳定性:Y>X
解析 根据图示可知W形成1个共价键,说明W原子核外只有1个电子,又是四种元素中原子序数最小的元素,X形成四个共价键且W、X、Z分别位于不同周期,则W是H元素,X是C元素,Z是Na元素,Y形成2个共价键,原子序数比C大,比Na小,说明Y原子核外有2个电子层,最外层有6个电子,则Y是O元素。同一主族的元素,原子序数越大,元素的原子半径越大,原子获得电子的能力就越弱,单质的氧化性就越弱。由于O是同一主族中原子序数最小的元素,故O2的氧化性在同主族中最强,A正确;
Y是O元素,Z是Na元素,O2-、Na+核外电子排布都是2、8,电子排布相同,核电荷数越大,离子半径就越小,所以离子半径:Z
解析 X、Y、Z、W是同周期原子序数依次增大的主族元素,由四种元素与锂组成的盐是一种新型的锂离子电池的电解质,Y可形成4个共价键,Z可形成2个共价键,X可形成3个共价键和1个配位键,则Y为C、Z为O、X为B,W可提供电子对,且易得到1个电子,则W为F,均为第二周期元素,且原子序数总和为28,以此来解答。由图可知,该化合物中,X、Y、Z、W之间均为共价键,故A正确;
X形成3个共价键和1个配位键,X原子满足8电子稳定结构,故B正确;W的氢化物是HF,易溶于水,但水溶液是弱酸,故C错误;Z与Y形成的化合物可以是CO或者是CO2,CO与碱不反应,CO2与碱反应,故D正确。
题组四 结构特点与物质转化相结合推断7.短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01 ml·L-1 r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是A.原子半径的大小:W
解析 由n是元素Z的单质,通常为黄绿色气体,可知Z元素为Cl,n为Cl2,再根据q的水溶液具有漂白性,可知q为HClO,由0.01 ml·L-1 r溶液的pH为2,可判断r为一元强酸,则r为HCl,然后根据n和p的反应条件,以及s通常是难溶于水的混合物,可知p为烷烃,s为烷烃的氯代物;根据题意,W、X、Y、Z是短周期原子序数依次增加的四种元素,可进一步推知W、X、Y、Z分别为H、C、O、Cl。
A项,根据原子半径的变化规律,可知原子半径:H
解析 0.05 ml·L-1丙溶液的pH为1,可知丙为二元强酸,应为H2SO4,K是无色气体,是主要的大气污染物之一,且可生成H2SO4,则应为SO2,可知乙为O2,L为H2O,甲是常见的固体,可知甲为C,M为CO2,则W为H元素,X为C元素,Y为O元素,Z为S元素,以此解答该题。同周期元素原子半径从左到右逐渐减小,原子电子层越多半径越大,则原子半径为C>O>H,即W<Y<X,故A错误;
同主族元素从上到下非金属性逐渐减弱,且碳酸的酸性小于硫酸,可知非金属性为O>S>C,即Y>Z>X,故B错误;X为C元素,Z为S元素,化合物XZ2为CS2,电子式为 ,其中所有原子均满足8电子稳定结构,故C正确;X为C元素,Z为S元素,Y为O元素,C与氧气反应可生成CO和CO2,S与氧气反应只能生成SO2,故D错误。
9.(2020·安徽马鞍山高三调研)短周期主族元素X、Y、Z、W的原子序数依次增大,X的简单气态氢化物常温下为无色液体,Y的原子半径是所有短周期主族元素中最大的,Y、Z、W形成的单质及化合物在溶液中有如图转化关系。下列说法不正确的是A.简单离子半径大小:Z>W>X>YB.简单氢化物的稳定性:X>ZC.Z的氧化物对应水化物为强酸D.X、W形成的某化合物可用作自来水消毒剂
解析 根据分析,X为O元素,Y为Na元素,W为Cl元素,Z为S元素。X、Y、Z、W形成的简单离子分别为O2-、Na+、S2-、Cl-,电子层数越多,半径越大,核外电子排布相同的微粒,核电荷数越大,半径越小,则简单离子半径大小:S2->Cl->O2->Na+,即Z>W>X>Y,故A正确;X为O元素,Z为S元素,非金属性越强,简单氢化物的稳定性越强,非金属性:O>S,则简单氢化物的稳定性:X>Z,故B正确;
2024届高三化学一轮复习 “位-构-性”综合推断专题复习课件: 这是一份2024届高三化学一轮复习 “位-构-性”综合推断专题复习课件,共1页。
2024年高考化学一轮复习第五章微专题四巧用“位—构—性”突破元素推断课件: 这是一份2024年高考化学一轮复习第五章微专题四巧用“位—构—性”突破元素推断课件,共15页。PPT课件主要包含了答案B,答案D等内容,欢迎下载使用。
【备战2023高考】化学总复习——专题讲座(五)《“位-构-性”综合推断题的解题方法》练习: 这是一份【备战2023高考】化学总复习——专题讲座(五)《“位-构-性”综合推断题的解题方法》练习,文件包含备战2023高考化学总复习专题讲座五《“位-构-性”综合推断题的解题方法》练习解析版docx、备战2023高考化学总复习专题讲座五《“位-构-性”综合推断题的解题方法》练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。