





高中化学人教版 (新课标)选修4 化学反应原理第三节 电解池备课课件ppt
展开金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年电解氯化钠制钠的工业方法实现了。由于金属钠在现代技术上得到重要应用,它的产量显著地增加。目前,世界上钠的工业生产多数是用电解氯化钠的方法,少数仍沿用电解氢氧化钠的方法。
电解是将电能转化为化学能的一种重要方法。
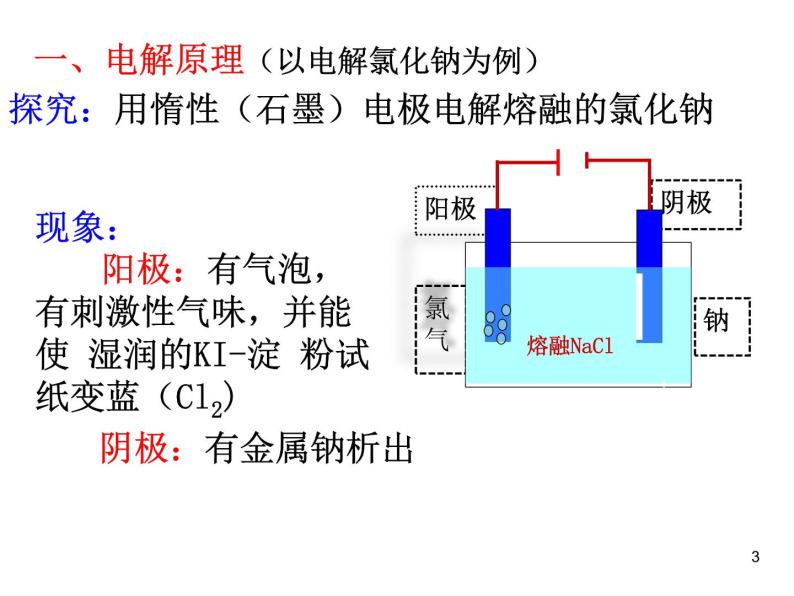
一、电解原理(以电解氯化钠为例)
探究:用惰性(石墨)电极电解熔融的氯化钠
现象: 阳极:有气泡,有刺激性气味,并能使 湿润的KI-淀 粉试纸变蓝(Cl2)
阴极:有金属钠析出
通电前:分析熔融电解质中的离子情况 阳离子:Na+ 阴离子:Cl- 无规则运动
通电后:(必须直流电)(1)确定电极名称: 阳极(接电源正极) 阴极(接电源负极) 与电极材料无关
(2)判断电极产物并书写电极反应: 阳离子移向阴极放电,阴离子移向阳极放电 阳极:2Cl--2e- =Cl2↑ 氧化反应 阴极:2Na+ +2e-=2Na 还原反应 总式:
电解:使电流通过电解质溶液而在阴阳两极引起氧化还原反应的过程。(强制性的氧化还原反应)
电解池:借助氧化还原反应,把电能转化为化学能的装置。
★构成条件: (1)外加直流电源 (2)与电源相连的两个电极:接电源负极的为阴极,阴极送出电子强制发生还原反应接电源正极的为阳极,阳极收回电子强制发生氧化反应 仔细理解个中含义,这是电解的关键! (3)电解质溶液或熔化的电解质
电子的流向: 由电源决定! 电子从外加电源的负极流出,流到电解池的阴极,再从阳极流回电源正极。 (注:电子只在外电路定向移动,不能从溶液中移动)
离子定向移动的方向: 阳离子向 阴极移动, 阴离子向 阳极移动.
惰性电极与活性电极: 惰性电极(铂、金、石墨):仅仅导电,不参与反应 活性电极(除铂、金外的金属):既可以导电、又可以参与电极反应
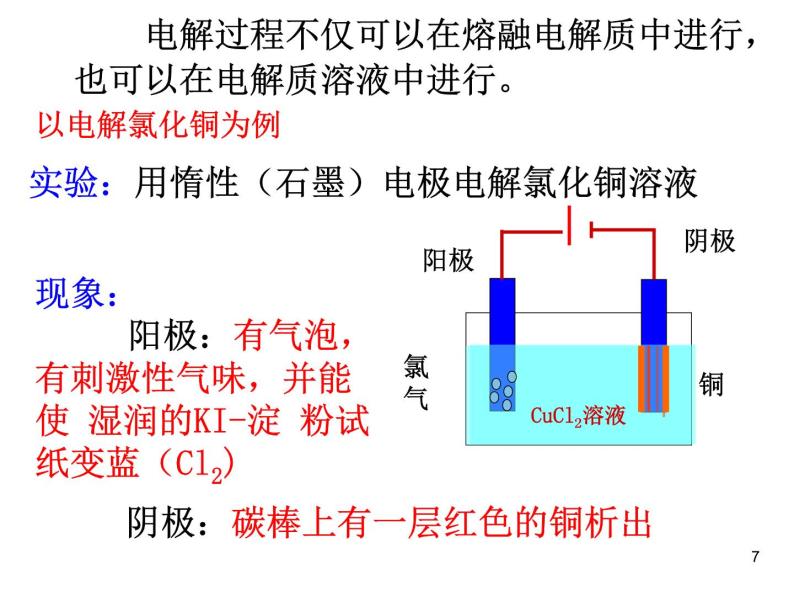
电解过程不仅可以在熔融电解质中进行,也可以在电解质溶液中进行。
实验:用惰性(石墨)电极电解氯化铜溶液
现象: 阳极:有气泡,有刺激性气味,并能使 湿润的KI-淀 粉试纸变蓝(Cl2)
阴极:碳棒上有一层红色的铜析出
通电前:分析电解质溶液中的离子情况 阳离子:H+、Cu2+ 阴离子:OH-、Cl- 做无规则运动
通电后:(必须直流电) (1)确定电极名称: 阳极(接电源正极) 阴极(接电源负极) 与电极材料无关
(3)判断电极产物并书写电极反应: 阳离子移向阴极放电,阴离子移向阳极放电 阳极: 2Cl--2e- =Cl2↑氧化反应 阴极:Cu2++2e- =Cu 还原反应 总式:
(2)判断离子的放电顺序: 阳离子:Cu2+>H+ 阴离子:Cl->OH-
(4)分析电解质溶液的变化情况: CuCl2溶液浓度降低
电解饱和食盐水反应原理
思考:(1)电解池的两极各产生什么现象?若在两极附近均滴加酚酞试液,会有什么现象?(2)怎样初步检验两极产物的生成?(3)结合教材,分析产生这种现象的原因。
在U型管里装入饱和食盐水,用一根碳棒作阳极,一根铁棒作阴极。接通直流电源
如果二支电极均用铁棒作电极,电解食盐水,阴阳极产物又如何?
阴极产物不变!即表明阴极无论用什么材料对阴极产物没影响;那阳极呢?
是OH-失电子?还是Cl-失电子?还是Fe失电子?仔细分析!
阴离子失去电子而阳离子得到电子的过程叫放电。
阳极:①金属材料作电极时:金属在阳极失电子被氧化成阳离子进入溶液,此时轮不到阴离子在电极上放电。? ②用惰性电极(Pt、Au、石墨、钛等)时:溶液中阴离子的放电顺序(由难到易原则)是:
S 2->SO32->I ->Br ->Cl ->OH ->即便OH -微量时也轮不到NO3 -、SO42- 、 F-这些离子放电(失电子)
Ag+>Fe3+ >Cu2+>H+(大量)>Pb2+>Sn2+>Fe2+>Zn2+>(H+)>(微量)注:当离子浓度相差较大时,放电顺序可能要发生变化,在水溶液中这些离子Al3+ 、 Mg2+ 、 Na+ 、 Ca+ 、 K+永远也不会得电子?
阴极:无论是惰性电极还是活性电极都不参与电极反应,发生反应的只能是溶液中的阳离子。阳离子在阴极上放电顺序是:
★电解规律!哪来规律?记住前边放电顺序就不需要这些所谓的规律了!
阳极:2Cl--2 e- =Cl2↑
阴极:Cu2++ 2e-=2Cu↓
阳极: 4OH- -4e- = 2H2O+O2↑
阴极: 4H ++ 4e- = 2H2 ↑
2H2O 2H2↑ +O2↑
阳极: 2Cl--2e- =Cl2↑
阴极: 2H ++ 2e- =H2 ↑
2NaCl+2H2O 2NaOH+H2 ↑ + Cl2 ↑
阳极: 4OH- - 4e- = 2H2O+O2↑
阴极:Cu2++ 2e- =Cu
电解规律(惰性电极)小结
阳极:S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-
Ⅰ与Ⅲ区:电解本身型 如CuCl2 、HClⅠ与Ⅳ区:放氢生碱型 如NaClⅡ与Ⅲ区:放氧生酸型 如CuSO4、AgNO3Ⅱ与Ⅳ区:电解水型 如Na2SO4、H2SO4 、NaOH
阴极:Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>(H+)>Al3+>Mg2+>Na+
1.写出下列装置的电极反应式,并判断A、B、C溶液PH值的变化。
2.如上图所示,通电后A极上析出Ag,对该装置的有关叙述正确的是 A.P是电源的正极B.F极上发生的反应为:4OH- - 4e-=2H2O+O2↑C.电解时,甲、乙、丙三池中,除E、F两极外,其余电极均参加了反应D.通电后,甲池的PH减小,而乙、丙两池溶液的PH不变
3.在下图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法正确的是A.X是正极,Y是负极B.X是负极,Y是正极C.CuSO4溶液的PH值逐渐减小D.CuSO4溶液的PH值不变
人教版 (新课标)第三节 电解池教课内容课件ppt: 这是一份人教版 (新课标)第三节 电解池教课内容课件ppt,共3页。PPT课件主要包含了概念形成,以氯化铜为例等内容,欢迎下载使用。
化学人教版 (新课标)第三节 电解池课堂教学课件ppt: 这是一份化学人教版 (新课标)第三节 电解池课堂教学课件ppt,共60页。PPT课件主要包含了现象原因,⑵电镀池形成条件,①镀件作阴极,②镀层金属作阳极,⑶电镀的特点,铜的电解精炼,⑴粗铜所含的杂质,⑵粗铜的精炼,氯碱工业,Cl-等内容,欢迎下载使用。
化学选修4 化学反应原理第三节 电解池说课课件ppt: 这是一份化学选修4 化学反应原理第三节 电解池说课课件ppt,共60页。PPT课件主要包含了有关电解,巩固练习,第四章电化学基础,电解原理的应用,精制食盐水,铜的电解精炼,电化学专题3\4,拓展练习,金属的电化学腐蚀,吸氧腐蚀等内容,欢迎下载使用。













