
高中化学人教版 (新课标)选修4 化学反应原理第三节 电解池学案
展开第一课时 电解原理
课前预习学案
一、预习目标
预习实验“电解池原理”,初步把握实验原理、目的要求、材料用具和方法步骤。
二、预习内容
“电解池原理”实验
1.实验原理:
与外电源正极相连的电极, 电子, 反应。
与外电源负极相连的电极, 电子, 反应。
定义:
把 转化为 的装置。
组成:
两个电极、
电解质溶液、
直流电源
电极
极:
极:
电 解 池
2.材料用具
实验仪器:小烧杯、玻璃棒、碳棒、导线、电流表、 电源、改进的塑料制电解槽;
实验药品:CuCl2溶液、淀粉碘化钾试纸、NaOH溶液、CuSO4溶液、 片、 片。
3.实验步骤:
⑴ ;
⑵ ;
⑶
4.观察和记录:
三、提出疑惑
同学们,通过你的自主学习,你还有哪些疑惑,请把它填在下面的表格中
课内探究学案
一、学习目标
1.知道电解的基本原理,会判断一般电解反应产物;
2.能说出电解、电解池及形成条件;
3.正确使用实验器材,完成“电解池原理”实验操作。
学习重难点:知道电解的基本原理,会判断一般电解反应产物。
二、学习过程
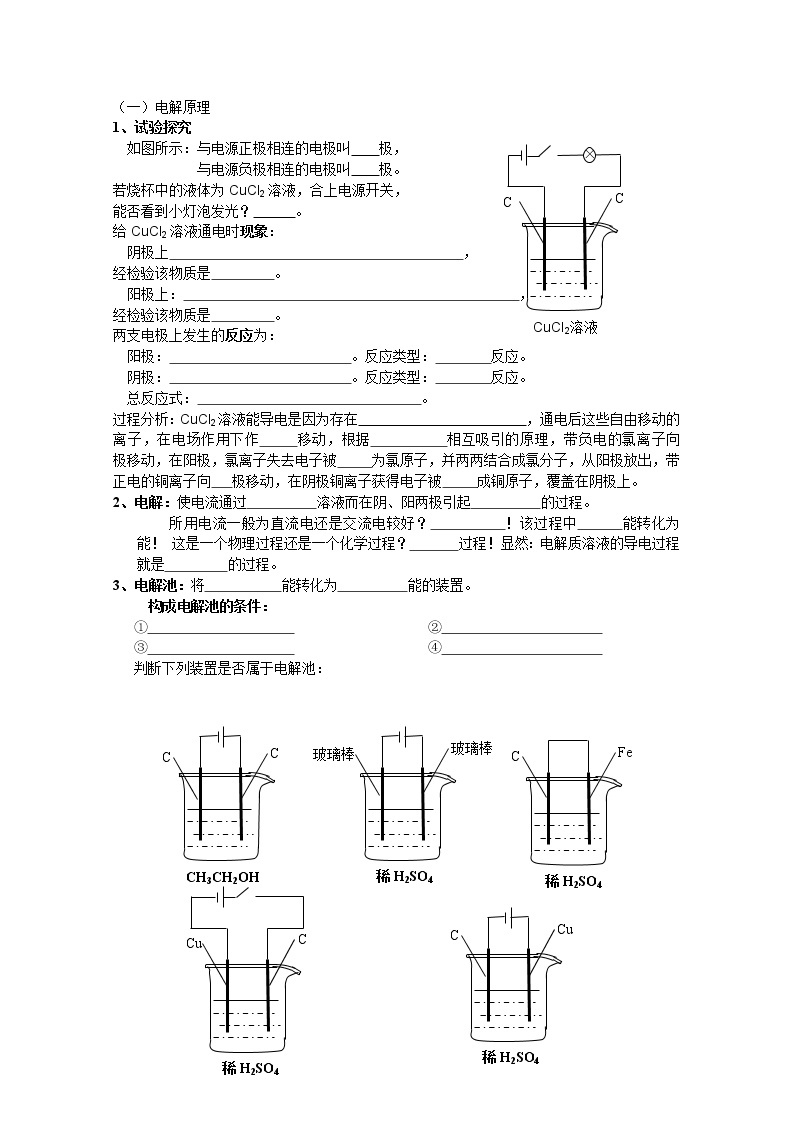
(一)电解原理
1、试验探究
CuCl2溶液
C
C
×
如图所示:与电源正极相连的电极叫 极,
与电源负极相连的电极叫 极。
若烧杯中的液体为CuCl2溶液,合上电源开关,
能否看到小灯泡发光? 。
给CuCl2溶液通电时现象:
阴极上 ,
经检验该物质是 。
阳极上: ,
经检验该物质是 。
两支电极上发生的反应为:
阳极: 。反应类型: 反应。
阴极: 。反应类型: 反应。
总反应式: 。
过程分析:CuCl2溶液能导电是因为存在 ,通电后这些自由移动的离子,在电场作用下作 移动,根据 相互吸引的原理,带负电的氯离子向 极移动,在阳极,氯离子失去电子被 为氯原子,并两两结合成氯分子,从阳极放出,带正电的铜离子向 极移动,在阴极铜离子获得电子被 成铜原子,覆盖在阴极上。
2、电解:使电流通过 溶液而在阴、阳两极引起 的过程。
所用电流一般为直流电还是交流电较好? !该过程中 能转化为 能! 这是一个物理过程还是一个化学过程? 过程!显然:电解质溶液的导电过程就是 的过程。
3、电解池:将 能转化为 能的装置。
构成电解池的条件:
① ②
③ ④
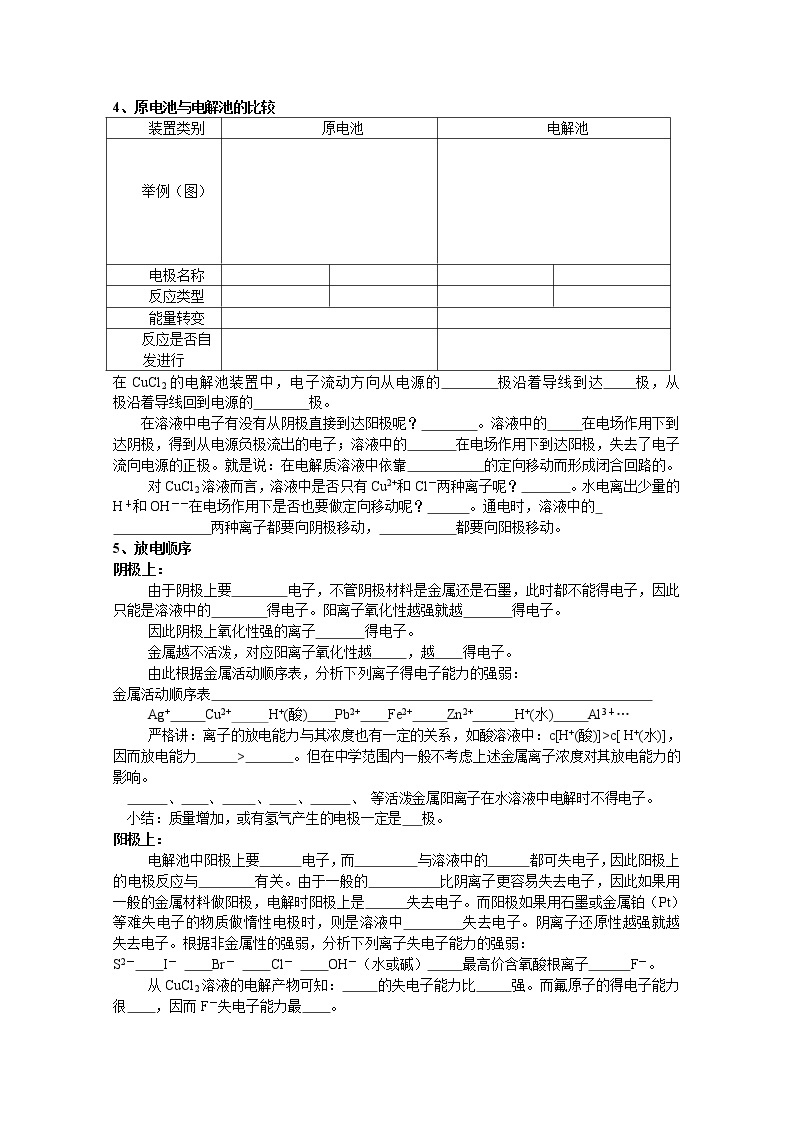
判断下列装置是否属于电解池:
C
C
CH3CH2OH
稀H2SO4
玻璃棒
玻璃棒
稀H2SO4
Fe
C
稀H2SO4
Cu
C
稀H2SO4
C
Cu
4、原电池与电解池的比较
在CuCl2的电解池装置中,电子流动方向从电源的 极沿着导线到达 极,从 极沿着导线回到电源的 极。
在溶液中电子有没有从阴极直接到达阳极呢? 。溶液中的 在电场作用下到达阴极,得到从电源负极流出的电子;溶液中的 在电场作用下到达阳极,失去了电子流向电源的正极。就是说:在电解质溶液中依靠 的定向移动而形成闭合回路的。
对CuCl2溶液而言,溶液中是否只有Cu2+和Cl-两种离子呢? 。水电离出少量的H+和OH--在电场作用下是否也要做定向移动呢? 。通电时,溶液中的
两种离子都要向阴极移动, 都要向阳极移动。
5、放电顺序
阴极上:
由于阴极上要 电子,不管阴极材料是金属还是石墨,此时都不能得电子,因此只能是溶液中的 得电子。阳离子氧化性越强就越 得电子。
因此阴极上氧化性强的离子 得电子。
金属越不活泼,对应阳离子氧化性越 ,越 得电子。
由此根据金属活动顺序表,分析下列离子得电子能力的强弱:
金属活动顺序表
Ag+ Cu2+ H+(酸) Pb2+ Fe2+ Zn2+ H+(水) Al3+…
严格讲:离子的放电能力与其浓度也有一定的关系,如酸溶液中:c[H+(酸)]>c[ H+(水)],因而放电能力 > 。但在中学范围内一般不考虑上述金属离子浓度对其放电能力的影响。
、 、 、 、 、 等活泼金属阳离子在水溶液中电解时不得电子。
小结:质量增加,或有氢气产生的电极一定是 极。
阳极上:
电解池中阳极上要 电子,而 与溶液中的 都可失电子,因此阳极上的电极反应与 有关。由于一般的 比阴离子更容易失去电子,因此如果用一般的金属材料做阳极,电解时阳极上是 失去电子。而阳极如果用石墨或金属铂(Pt)等难失电子的物质做惰性电极时,则是溶液中 失去电子。阴离子还原性越强就越 失去电子。根据非金属性的强弱,分析下列离子失电子能力的强弱:
S2- I- Br- Cl- OH-(水或碱) 最高价含氧酸根离子 F-。
从CuCl2溶液的电解产物可知: 的失电子能力比 强。而氟原子的得电子能力很 ,因而F-失电子能力最 。
研究表明:OH-的失电子能力比最高价含氧酸根离子强:
4OH-- 4e-=O2 ↑+2H2O
、 等阴离子在水溶液中电解时不失电子。
注意:放电顺序这个考点不难,但要细心,极易出错。要能根据放电顺序判断阴、阳极产物,如果是惰性电极则直接考虑溶液中离子的放电顺序。如果阳极是较活泼金属,那一定要能想起:一般的 比阴离子更容易失去电子,因此如果用一般的金属材料做阳极,电解时阳极上是 失去电子。
(二)电极方程式的书写
①标出电极名称—阴极或阳极
②写出电极方程式:
阳极: ;反应类型: 反应。
阴极: ;反应类型: 反应。
阴、阳两极中得、失电子的总数要 ,每一极上都要满足 和 守恒,总方程式可根据阴、阳两极的物质变化写出。
(三)当堂练习:用惰性电极电解下列电解质溶液,请你分析下列问题(注意得失电子的顺序)
1、CuCl2阴极: 阳极
总方程式: 电解质浓度 ,pH
电解对象: ,要把电解质溶液复原,加 。
2、NaCl阴极: 阳极
总方程式: 电解质浓度 ,pH
电解对象: ,要把电解质溶液复原,加 。
3、CuSO4阴极: 阳极
总方程式: 电解质浓度 ,pH
电解对象: ,要把电解质溶液复原,加 。
NaOH:
阴极: 阳极
总方程式: 电解质浓度 ,pH
H2SO4:
阴极: 阳极
总方程式: 电解质浓度 ,pH
课后练习与提高
1. 用惰性电极实现电解,下列说法正确的是
A.电解氢氧化钠稀溶液,溶液浓度增大pH变小
B.电解氯化钠溶液,溶液浓度减小pH不变
C.电解硝酸银溶液,要消耗OH--溶液pH变小
D.电解稀硫酸,实质是电解水,溶液pH不变
2. 右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是
3. 在一盛有饱和Na2CO3溶液的烧杯中插入惰性电极,保持温度不变,通电一段时间后:
A.溶液的PH值增大; B.Na+和CO32-的浓度减小;
C.溶液的浓度增大; D.溶液的浓度不变,有晶体析出;
4. 用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是:
A.CuCl2(CuO);B.NaOH(NaOH);
C.NaCl(HCl); D.CuSO4[Cu(OH)2]
5. 用惰性电极电解下列溶液,电解一段时间后,阴极质量增加,电解液的PH下降的是:
A.CuSO4;B.AgNO3;C.BaCl2;D.H2SO4;
6. 在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是:
A.原电池的正极和电解池的阳极所发生的反应;
B.原电池的正极和电解池的阴极所发生的反应;
C.原电池的负极和电解池的阳极所发生的反应;
D.原电池的负极和电解池的阴极所发生的反应;
7. 用惰性电极实现电解,下列说法正确的是
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
8. 用惰性电极电解一定量的CuSO4稀溶液,下列说法中正确的是
A.阳极发生的电极反应为:Cu2+ + 2e- =Cu
B.阴极发生的电极反应为;4OH- =2H2O + O2↑+ 4e―
C.若有6.4g金属Cu析出,放出的O2一定为0.05 ml
D.电解完成后,加入一定量的Cu(OH)2,溶液可能恢复到原来的浓度
9. 将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比是
A.1∶2∶3 B.3∶2∶1 C.6∶3∶1 D.6∶3∶2
第二课时 电解的应用
课前预习学案
一、预习目标
预习铜的电解精炼和电镀铜的原理以及氯碱工业反应原理
二、预习内容
1、氯碱工业:电解 制 、 和 。
电极反应方程式:
阳极:
阴极:
总方程式
该电解池中阳极用 电极(金属、惰性)
2、电镀:
电镀时,通常把 作阴极,把 作阳极,
用含有 作电镀液。
铜的精炼
电解时,通常把 作阴极,把 作阳极,
用含有 作电镀液。
粗铜中的多数杂质沉积在电解槽底部,形成
电冶金
对于 、 、 、 这样活泼的金属,工业上用电解法冶炼。
工业上用电解 的方法制取金属钠,方程式
工业上用电解 的方法制取金属镁,方程式
工业上用电解 的方法制取金属铝,方程式
三、提出疑惑
同学们,通过你的自主学习,你还有哪些疑惑,请把它填在下面的表格中
课内探究学案
一、学习目标
1.知道铜的电解精炼和电镀铜的原理,
2.知道氯碱工业反应原理;
3.能正确书写电极反应式和电解的总化学方程式。
学习重难点:知道氯碱工业反应原理。
二、学习过程
1.电解食盐水
【思考】
(1)通电前,饱和食盐水中存在哪些离子?这些离子的运动情况怎样?
(2)在电解装置中可否选用铜作阴、阳极的电极材料,为什么?
(3)通电后,溶液中的离子运动发生了什么变化?
(4)通电后,溶液中的在阴、阳放电的是什么离子?
(5)电解后,在阴极区和阳极区分别得到的产物是什么?怎样初步检验两极产物的生成?
【知识总结】电解食盐水
阳极: 阴极:
总式:
电解饱和食盐水可以制造 。
阅读教材,回答离子交换膜法制烧碱的有关知识
【小结】氯碱工业:离子交换膜法制烧碱
2.铜的电解精炼
一般火法冶炼得到的粗铜中含有多种杂质(如锌、铁、镍、银、金等),这种粗铜的导电性远不能满足电气工业的要求,如果用以制电线,就会大大降低电线的导电能力。因此必须利用电解的方法精炼粗铜。
粗铜 含杂质( 等)
极
极
阳极:Zn
Fe
Ni
Cu
Ag
Au
阴极 :
思考:电解完后,CuSO4溶液的浓度有何变化?
3. 电镀
原理:电镀是利用 原理在某些金属表面镀上一薄层其他金属或合金的过程,它是电解原理的又一重要应用。电镀可以使金属更加美观耐用,增强防锈抗腐能力。例如,钢铁是人们最常用的金属,但钢铁有个致命的缺点,就是它们易被腐蚀。防止钢铁发生腐蚀的一种最常用方法就是在其表面镀上其他金属,如锌、铜、铬、镍等。
铁片
铜片
硫酸铜溶液
①电极:
阳极—— 金属或惰性电极
阴极—— 金属制品
②电镀液:含有 金属离子的电解质溶液。
溶液中CuSO4的浓度保持 或
4、电冶金
制取金属钠←电解熔融状态的氯化钠。
阳极: 阴极:
总反应:
冶炼铝
原理:
阳极: 阴极:
总式:
助熔剂:冰晶石(Na3AlF6 六氟合铝酸钠) 需要定期补充
【思考】工业上为什么用电解熔融氧化铝的方法冶炼铝而不用AlCl3?
【思考与交流】试比较电解饱和食盐水与电解熔融氯化钠的异同
(提示:比较电解质、电解装置、电极反应、电解产物)
【小结】
电源、电极、电极反应关系
与电源正极相连
极
极
与电源负极相连
发生 反应
离子移向
离子移向
发生 反应
课后练习与提高
1、用惰性电极电解下列溶液,电解一段时间后,阴极质量增加,电解液的PH下降的是:
A、CuSO4;B、AgNO3;C、BaCl2;D、H2SO4;
2、两串联电解池,左边放硫酸铜,右边放一定量的某硝酸盐溶液,电解时当左池有1.6gCu析出时,右池析出0.45g固体,则右池溶质为:
A、AgNO3;B、NaNO3;C、Mg(NO3)2;D、Al(NO3)3;
3、用惰性电极实现电解,下列说法正确的是:
A、电解稀硫酸溶液,实质上是电解水,故溶液pH不变;
B、电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小;
C、电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2;
D、电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1;
4、右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
A、a为负极、b为正极;
B、a为阳极、b为阴极;
C、电解过程中,d电极质量增加;
D、电解过程中,氯离子浓度不变;
5、某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
A、a为正极,b为负极;NaClO和NaCl
B、a为负极,b为正极;NaClO和NaCl
C、a为阳极,b为阴极;HClO和NaCl
D、a为阴极,b为阳极;HClO和NaCl
6、从H+、Na+、Cu2+、Ba2+、Cl-、SO42-离子中,选出恰当的离子组成一种电解质,将电解质溶液按下列要求进行电解(均是惰性电极):
电解时电解质含量减小,水量不变,则所采用的电解质是 ;
(2)电解时电解质的质量保持不变,水量减小,则所采用的电解质是 ;
(3)电解时电解质和水的质量都发生变化,则所采用的电解质是 ;
7、工业上处理含Cr2O72-的酸性工业废水用以下方法:①往工业废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准。
试回答:
(1)电解时的电极反应:阳极:
阴极:
(2)写出Cr2O72-转变成Cr3+的离子反应方程式:
;
(3)电解过程中Cr(OH)3、Fe(OH)3沉淀是怎样产生的? ;
;
参考答案:
1、AB;2、A; 3、D;4、C;5 .B
6、(1)HCl,CuCl2;(2)H2SO4,Na2SO4;(3)NaCl,BaCl2;
疑惑点
疑惑内容
装置类别
原电池
电解池
举例(图)
电极名称
反应类型
能量转变
反应是否自发进行
a极板
b极板
x电极
Z溶液
A
锌
石墨
负极
CuSO4
B
石墨
石墨
负极
NaOH
C
银
铁
正极
AgNO3
D
铜
石墨
负极
CuCl2
疑惑点
疑惑内容
电解饱和食盐水
电解熔融氯化钠
电解质
电解装置
电极反应
电解产物
高中化学人教版 (新课标)选修4 化学反应原理第四章 电化学基础第三节 电解池导学案: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第四章 电化学基础第三节 电解池导学案,共15页。学案主要包含了电解原理,电解原理的应用,电解的有关计算等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第一节 原电池学案设计: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第一节 原电池学案设计,共5页。学案主要包含了预习目标,预习内容等内容,欢迎下载使用。
人教版 (新课标)选修4 化学反应原理第四节 金属的电化学腐蚀与防护学案: 这是一份人教版 (新课标)选修4 化学反应原理第四节 金属的电化学腐蚀与防护学案,共7页。学案主要包含了预习目标,预习内容等内容,欢迎下载使用。













