

高中化学人教版 (新课标)选修4 化学反应原理第三节 电解池教案及反思
展开1.掌握电解饱和食盐水的原理。(重点)
2.了解电镀、金属精炼、电冶金等方面的应用。(重点)
3.掌握电解的有关计算。(难点)
[基础·初探]
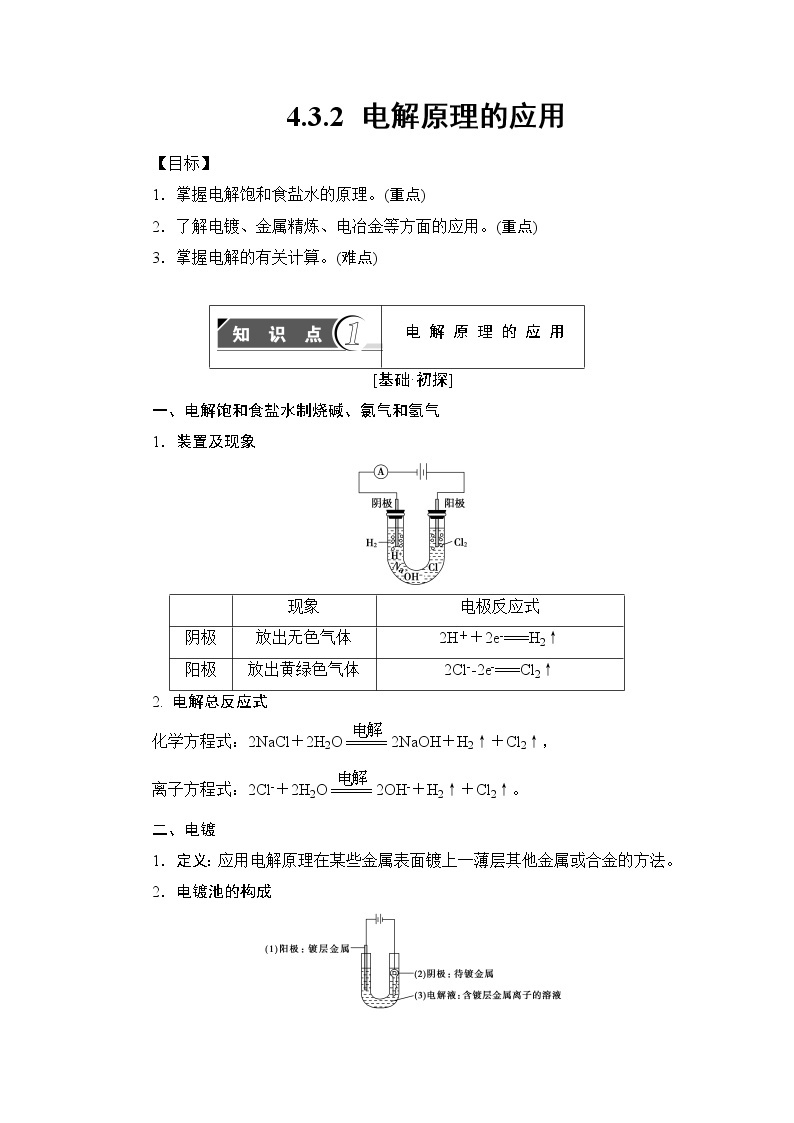
一、电解饱和食盐水制烧碱、氯气和氢气
1.装置及现象
电解总反应式
化学方程式:2NaCl+2H2Oeq \(=====,\s\up9(电解))2NaOH+H2↑+Cl2↑,
离子方程式:2Cl-+2H2Oeq \(=====,\s\up9(电解))2OH-+H2↑+Cl2↑。
二、电镀
1.定义:应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法。
2.电镀池的构成
3.实例(往铁件上镀铜)
(1)阴极材料:铁,电极反应式:Cu2++2e-===Cu;
(2)阳极材料:铜,电极反应式:Cu-2e-===Cu2+;
(3)电解质溶液:CuSO4溶液。
三、电解精炼铜
1.电解精炼铜的原理是粗铜中比铜活泼的金属Zn、Fe等失去电子,产生的阳离子残留在溶液中,不比铜活泼的金属Ag、Au等以金属单质的形式沉积在电解池的底部,形成阳极泥,粗铜中的铜在阴极上析出。
2.装置
四、电冶金
1.本质:使矿石中的金属离子获得电子,从它们的化合物中还原出来。如Mn++ne-===M。
2.电冶金:电解是最强有力的氧化还原手段,适用于一些活泼金属单质的制取,如冶炼Na、Ca、Mg、Al等活泼金属。
3.举例
[探究·升华]
[思考探究]
模拟电解原理在化工生产中的应用,实验装置如下图,装置闭合电键K时,电流计G的指针将发生偏转。
问题思考:
(1)哪个装置是原电池?哪个装置是电解池?
【提示】 甲、乙构成原电池,丙是电解池。
(2)a、b、c、d电极名称分别是什么?
【提示】 a是负极,b是正极,c是阳极,d是阴极。
(3)若模拟氯碱工业生产烧碱、氯气和氢气,如何选用电极材料和电解质溶液?
【提示】 c电极用Pt或石墨,d电极用铁丝(导体均可),X溶液为饱和食盐水。
(4)若模拟电镀生产,在铁件上镀一层金属银,如何选用电极材料和电解质溶液?电极反应式如何书写?
【提示】 c电极用Ag,d电极用Fe,X溶液为AgNO3溶液;阳极:
Ag-e-===Ag+,阴极:Ag++e-===Ag。
(5)若模拟电解精炼铜,如何选用电极材料和电解质溶液?
【提示】 c电极用粗铜,d电极用纯铜,X溶液为CuSO4溶液。
[认知升华]
1.电镀铜与精炼铜的比较
2. 原电池、电解池、电镀池的判断方法
(1)若装置中无外加电源,则该装置可能为原电池,然后根据原电池的构成条件进行分析判断。
(2)若有外接直流电源,两极插入电解质溶液中,则可能是电解池或电镀池;当阴极为金属,阳极亦为金属且与电解质溶液中的金属阳离子属同种元素时,则为电镀池。
(3)若多个单池相互串联,又有外接直流电源时,则与直流电源相连接的为电解池或电镀池。若无外接直流电源时,较活泼的金属电极为原电池的负极(电子输出极),有关装置为原电池,其余为电镀池或电解池。
[题组·冲关]
1.如图所示,能验证氯化钠溶液(含酚酞)电解产物的装置是( )
【解析】 电解NaCl溶液时,阳极反应为2Cl--2e-===Cl2↑,阳极产物为Cl2;阴极反应为2H++2e-===H2↑,阴极放出H2;Cl2可用KI淀粉溶液检验。因H2密度小,在阴极生成,结合e-转移方向知D正确。
【答案】 D
2.按下图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )
①c(Ag+) ②c(AgNO3) ③a棒的质量 ④b棒的质量 ⑤溶液的pH
A.①③B.③④
C.①②④D.①②⑤
【解析】 该电解池中阳极反应式为Ag-e-===Ag+,阴极反应式为Ag++e-===Ag,所以随着电解的进行,c(Ag+)不变,c(AgNO3)不变,溶液的pH不变。答案选D。
【答案】 D
3.在铁制品上镀一层一定厚度的锌层,以下方案设计正确的是( )
A.锌作阳极,镀件作阴极,溶液中含有锌离子
B.铂作阴极,镀件作阳极,溶液中含有锌离子
C.铁作阳极,镀件作阴极,溶液中含有亚铁离子
D.锌作阴极,镀件作阳极,溶液中含有亚铁离子
【解析】 本题考查的是电镀的原理。电镀原理是镀层金属作阳极、镀件作阴极,含有镀层金属阳离子的电解质溶液作电镀液。
【答案】 A
4.下图为相互串联的甲、乙两电解池,试回答:
甲 乙
(1)若甲池利用电解原理在铁上镀银,则A是______(填电极材料),电极反应式是______________;B是________(填电极材料),电极反应式是_________,
应选用的电解质溶液是________。
(2)乙池滴入少量酚酞试液,电解一段时间后,_______________________(填“C”或“Fe”)极附近呈红色。
(3)若甲池阴极增重43.2 g,则乙池中阳极上放出的气体在标况下的体积是________L。
【解析】 (1)电镀池中,镀件作阴极,镀层金属作阳极,含镀层金属阳离子的盐溶液作电解质溶液。
(2)使酚酞呈红色说明显碱性,即2H2O+2e-===2OH-+H2↑,故阴极(Fe)呈碱性。
(3)由电子守恒得:2Ag~Cl2,n(Ag)=eq \f(43.2 g,108 g·ml-1)=0.4 ml,则n(Cl2)=eq \f(1,2)n(Ag)=0.2 ml,V(Cl2)=n·Vm=4.48 L。
【答案】 (1)Fe Ag++e-===Ag
Ag Ag-e-===Ag+ AgNO3溶液 (2)Fe
(3)4.48
[基础·初探]
1.计算的原则
(1)阳极失去的电子数=阴极得到的电子数。
(2)串联电路中通过各电解池的电子总数相等。
(3)电源输出的电子总数和电解池中转移的电子总数相等。
2.计算步骤
首先要正确书写电极反应式(要特别注意阳极材料);其次注意溶液中有多种离子共存时,要根据离子放电顺序确定离子放电的先后;最后根据得失电子守恒进行相关计算。
3.电解计算的常考题型
(1)电子守恒在电解计算中的应用。
(2)计算电解后溶液中的离子浓度。
(3)计算电解质溶液的pH。
(4)计算电解后析出的固体质量。
(5)串联电路中的物质关系。
[探究·升华]
[思考探究]
在如下图中,甲烧杯中盛有100 mL 0.50 ml·L-1 AgNO3溶液,乙烧杯中盛有100 mL 0.25 ml·L-1 CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9 g。
问题思考:
(1)发现A极比C极重,说明A极和C极上分别析出什么物质?说明电源E为正极还是负极?
【提示】 A极比C极重,说明A极上有Ag析出,说明电源E是负极,则C极为阴极,C极上有铜析出。
(2)A极比C极重1.9 g,则A极上析出单质的物质的量为多少?C极上析出单质的物质的量为多少?
【提示】 设A极析出的Ag为x ml,则对应析出的铜为eq \f(x,2) ml(电子守恒),即得108x-64×eq \f(x,2)=1.9,x=0.025 ml
则析出的Ag为2.7 g,析出的铜为0.8 g。
(3)写出B极的电极反应式。计算B极析出气体的体积是多少?(标准状况)
【提示】 B极的电极反应式:
4OH--4e-===O2↑+2H2O
根据题意可知,该过程转移0.025 ml电子,则B极生成O2的体积V=
22.4 L/ml×eq \f(0.025,4) ml=0.14 L。
[认知升华]
电解池中有关量的计算或判断
1.题型特点
主要包括以下几方面:根据直流电源提供的电量求产物的量(析出固体的质量、产生气体的体积等)、溶液的pH、相对原子质量或某元素的化合价、化学式等。
2.解题方法
[题组·冲关]
1.在水中加入等物质的量的Ag+、Na+、Ba2+、NOeq \\al(-,3)、Cl-、SOeq \\al(2-,4),用惰性电极进行电解,一段时间后,在两极上得到的氧化产物和还原产物的质量之比为
( )
A.8∶1 B.2∶27
C.35.5∶108D.108∶35.5
【解析】 Ag+与Cl-、Ba2+与SOeq \\al(2-,4)均生成沉淀,相当于电解NaNO3溶液,实质是电解H2O,两极得到的氧化产物和还原产物分别为O2和H2。
【答案】 A
2.用惰性电极电解饱和食盐水,当电源提供0.2 ml电子时停止通电。若此溶液体积为2 L,则所得电解液的pH是( )
A.1B.8
C.13D.14
【解析】 电解饱和食盐水时供给0.2 ml电子,则消耗的H+为0.2 ml,同时产生OH-为0.2 ml,溶液体积为2 L,pH=13。
【答案】 C
3.将1 L含有0.4 ml Cu(NO3)2和0.4 ml KCl的水溶液,用惰性电极电解一段时间后,在一电极上析出19.2 g Cu;此时,在另一电极上放出气体的体积在标准状况下为(不考虑产生的气体在水中的溶解)( )
A.3.36 LB.5.6 L
C.6.72 LD.13.44 L
【解析】 阴极析出铜0.3 ml,由Cu2++2e-===Cu知Cu2+得到0.6 ml电子,根据2Cl--2e-===Cl2↑,求出当溶液中Cl-全部参与电极反应时,放出Cl2
0.2 ml,失去电子0.4 ml。因此在阳极还有OH-放电,根据4OH--4e-===2H2O+O2↑和电子守恒,在阳极有0.05 ml O2放出,即阳极共放出0.25 ml,标准状况下为5.6 L的气体。
【答案】 B
4.把两个惰性电极插入500 mL的AgNO3溶液中,通电电解。当电解液的pH从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上析出银的质量大约是( )
A.27 mg B.54 mg
C.108 mgD.216 mg
【解析】 本题考查的是有关电解反应的计算。首先应弄清楚两极的反应。阳极:4OH--4e-===O2↑+2H2O;阴极没有氢气析出,则阴极反应为:Ag++e-===Ag。OH-的消耗导致了H+的增加,增加量为1×10-3 ml/L×0.5 L=5×
10-4 ml,即转移电子数5×10-4 ml,析出银的质量为5×10-4 ml×108 g/ml=
0.054 g=54 mg。
【答案】 B 电 解 原 理 的 应 用
现象
电极反应式
阴极
放出无色气体
2H++2e-===H2↑
阳极
放出黄绿色气体
2Cl--2e-===Cl2↑
电镀铜
精炼铜
能量转变
电能转化为化学能
电能转化为化学能
阳极材料
纯铜
粗铜(含锌、银、金等杂质)
阴极材料
镀件
纯铜
阳极反应
Cu-2e-===Cu2+
Zn-2e-===Zn2+
Cu-2e-===Cu2+等
阴极反应
Cu2++2e-===Cu
Cu2++2e-===Cu
电解质溶
液及其变化
硫酸铜溶液保持不变
反应后硫酸铜溶液中混有Zn2+等,Cu2+浓度减小
电 解 的 有 关 计 算
2021学年第三节 电解池教案及反思: 这是一份2021学年第三节 电解池教案及反思,共3页。教案主要包含了教学目标,教学重点,教学过程等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第三章 水溶液中的离子平衡第四节 难溶电解质的溶解平衡教案设计: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第三章 水溶液中的离子平衡第四节 难溶电解质的溶解平衡教案设计,共4页。教案主要包含了学习点拨,学习训练材料等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第一节 弱电解质的电离教案: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第一节 弱电解质的电离教案,共5页。教案主要包含了填空题,强电解质,弱电解质,弱电解质电离平衡等内容,欢迎下载使用。