



化学选修4 化学反应原理第四章 电化学基础第一节 原电池说课课件ppt
展开电化学:研究化学能与电能之间相互转换的装置、过程和效率的科学。
过程及装置分按电化学反应
2. 借助电流而发生反应及装置 (如:电解池)
1. 产生电流的化学反应及装置 (如:原电池等)
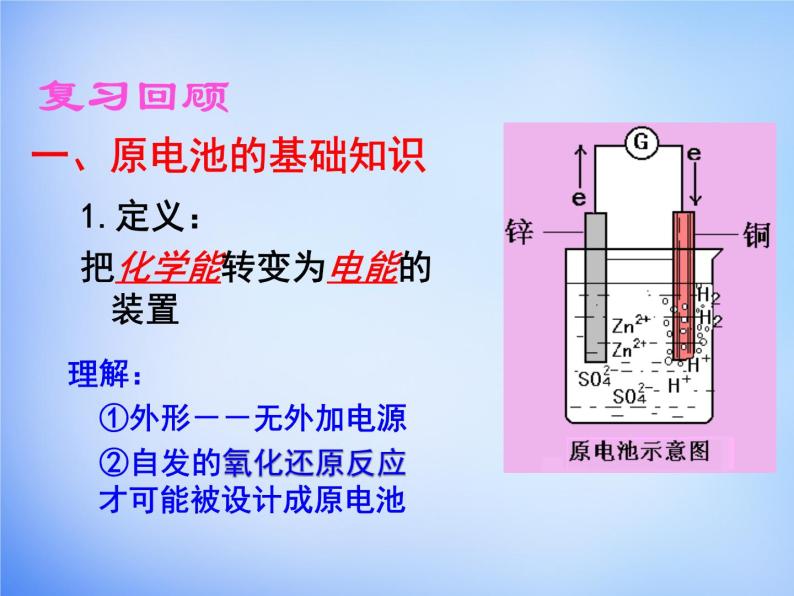
1.定义:把化学能转变为电能的装置
理解: ①外形--无外加电源 ②自发的氧化还原反应才可能被设计成原电池
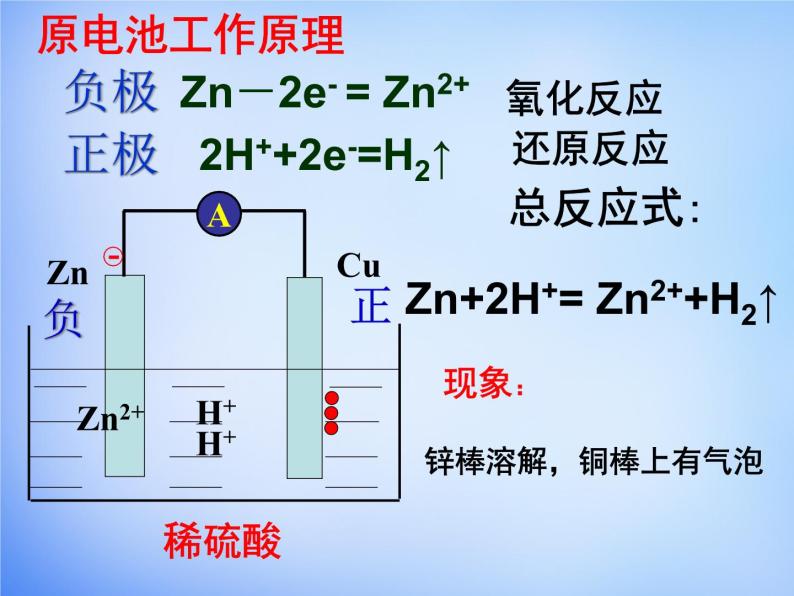
Zn-2e- = Zn2+
2H++2e-=H2↑
Zn+2H+= Zn2++H2↑
锌棒溶解,铜棒上有气泡
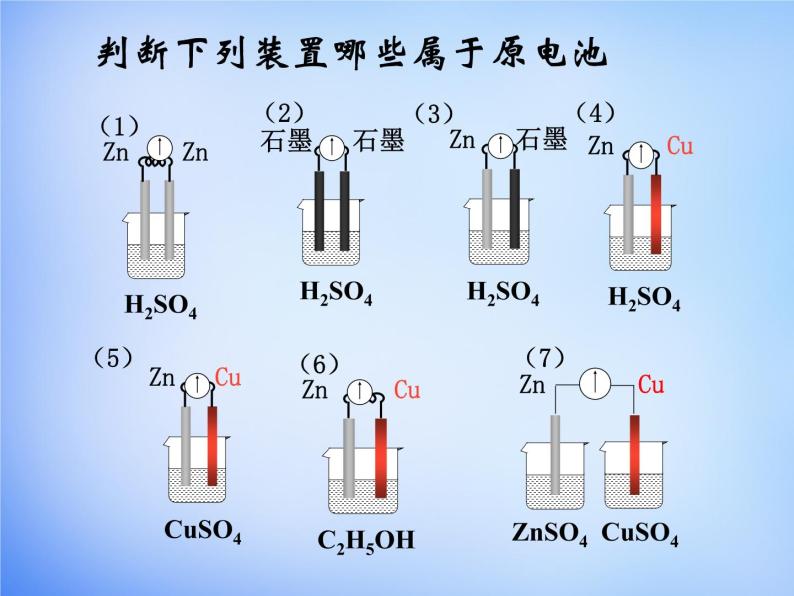
(1)有两种活泼性不同的金属(或一种是 非金属单质或金属氧化物)作电极。
(2)电极材料均插入电解质溶液中。
(3)两极相连形成闭合电路。
1.内部条件:能自发进行氧化还原反应
两极一液成回路,氧化还原是中心
判断下列装置哪些属于原电池
Zn Cu
理论上应看到只在铜片上有大量气泡,实际上锌片上也有大量气泡产生,这是什么原因导致的呢?最终又会造成什么后果?怎样避免和克服呢?
?提出问题: 上图是将锌片和铜片置于稀硫酸的原电池,如果用它做电源,不但效率低,而且时间稍长电流就很快减弱,因此不适合实际应用。这是什么原因造成的呢?有没有什么改进措施?
造成的主要原因:锌片不纯,以及铜极上聚集了许多氢气泡,把铜极跟稀硫酸逐渐隔开,这样就增加了电池的内阻,使电流不能畅通。
一、对锌铜原电 池工作原理的进一步探究
为了避免发生这种现象…
让锌片与稀硫酸不直接接触
【结论1】改进后的原电池装置提高了能量转换率
改进后的原电池装置还有什么优点?
【结论2】改进后的原电池装置化学能不会自动释放
【启示】氧化剂和还原剂不直接接触也能发生反应
请根据反应:Zn + CuSO4 = ZnSO4 + Cu设计一个原电池装置,标出电极材料和电解质溶液,写出电极反应方程式.
且两个电极上都有红色物质析出
电流表指针发生偏转, 但随着时间的延续,电流表指针偏转的角度越来越小,最终可能没有电流通过。
Zn-2e-=Zn2+
Cu2++2e-=Cu
即无法产生持续稳定的电流
按下图所示, 将置有锌片的ZnSO4溶液和置有铜片的CuSO4溶液分别通过导线与电流计连接,有什么现象?
电流计指针不偏转,且铜片和锌片上均无明显现象(即:无电子定向移动)
设计如下图(书P71图4-1)所示的原电池装置,结果如何呢?你能解释它的工作原理吗?
盐桥:在U型管中装满用饱和KCl溶液和琼脂作成的冻胶。
实验三(书71页实验4-1)
分析:改进后的装置为什么能够持续、稳定的产生电流?盐桥在此的作用是什么?
有盐桥存在时电流计指针发生偏转,即有电流通过电路。 取出盐桥,电流计指针即回到零点,说明没有电流通过。
盐桥制法:1)将热的琼胶溶液倒入U形管中(注意不要产生裂隙),将冷却后的U形管浸泡在KCl或NH4NO3的饱和溶液中即可。2)将KCl或NH4NO3的饱和溶液装入U形管,用棉花都住管口即可。
盐桥的作用:(1)使整个装置构成通路,代替两溶液直接接触。
由于盐桥(如KCl)的存在,其中阴离子Cl-向ZnSO4溶液扩散和迁移,阳离子K+则向CuSO4溶液扩散和迁移,分别中和过剩的电荷,保持溶液的电中性,因而放电作用不间断地进行,一直到锌片全部溶解或 CuSO4溶液中的 Cu2+几乎完全沉淀下来。若电解质溶液与KCl溶液反应产生沉淀,可用NH4NO3代替KCl作盐桥。
(2)平衡电荷。 在整个装置的电流回路中,溶液中的电流通路是靠离子迁移完成的。取出盐桥,Zn失去电子形成的Zn2+进入ZnSO4溶液,ZnSO4溶液因Zn2+增多而带正电荷。同时,CuSO4则由于Cu2+ 变为Cu ,使得 SO42-相对较多而带负电荷。溶液不保持电中性,这两种因素均会阻止电子从锌片流向铜片,造成电流中断。
二、由两个半电池组成原电池的工作原理
(1)把氧化反应和还原反应分开在不同区域进行,再以适当方式连接,可以获得电流。
①在这类电池中,用还原性较强的物质作为负极,负极向外电路提供电子;用氧化性较强的物质作为正极,正极从外电路得到电子。②在原电池的内部,两极浸在电解质溶液中,并通过阴阳离子的定向运动而形成内电路。
(2)探究组成原电池的条件
③用导线和盐桥分别将两个半电池连接在一起
设计盐桥原电池的思路:
还原剂和氧化产物为负极的半电池氧化剂和还原产物为正极的半电池
Zn+2Ag+=Zn2++2Ag
根据电极反应确定合适的电极材料和电解质溶液外电路用导线连通,可以接用电器内电路是将电极浸入电解质溶液中,并通过盐桥沟通内电路
能产生稳定、持续电流的原电池应具备什么条件?
1.要有导电性不同的两个电极2.两个半反应在不同的区域进行3.用导线和盐桥分别将两个半电池连接在一起
3. 两个电极相连插入电解质溶液中并形成闭合电路;
把化学能直接转化为电能的装置。
1.有两块金属(或非金属)导体作电极; 2.电解质溶液
二.构成原电池的基本条件:
4.有可自发进行的氧化还原反应。
三.加入盐桥后由两个半电池组成的原电池工作原理:
1. 用还原性较强的物质(如:活泼金属)作负极,向外电路提供电子;用不活泼物质作正极,从外电路得到电子。
2. 原电池在放电时,负极上的电子经过导线流向正极,而氧化剂从正极上得到电子,两极之间再通过盐桥及原电池内部溶液中的阴、阳离子定向运动形成的内电路构成有稳定电流的闭合回路。
1.利用反应Zn+2FeCl3=2FeCl2+ZnCl2 ,设计出两种原电池,画出原电池的示意图,并写出电极反应方程式。
(1)、根据氧化还原反应电子转移判断电极反应。(2)、根据电极反应确定合适的电极材料和电解质溶液
2.依据氧化还原反应:2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:(1)电极X的材料是 ;电解质溶液Y是 ;(2)银电极为电池的 极,发生的电极反应为 ;X电极上发生的电极反应为 ;(3)外电路中的电子是从 电极流向 电极。
2Ag +2e = 2Ag
Cu - 2e = Cu
3. 用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是( )①在外电路中,电流由铜电极流向银电极 ②正极反应为:Ag++e- =Ag③实验过程中取出盐桥,原电池仍继续工作④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同 A ①② B.②③ C.②④ D.③④
二、原电池正负极判断--原电池原理的应用
1.由组成原电池的电极材料判断一般 负极- 的金属 正极- 的金属或 导体,以及某些金属氧化物可以理解成: 与电解质溶液反应
练习:Mg-Al-H2SO4中 是正极, 是负极 Mg-Al-NaOH中 是正极 是负极
1.由组成原电池的电极材料判断
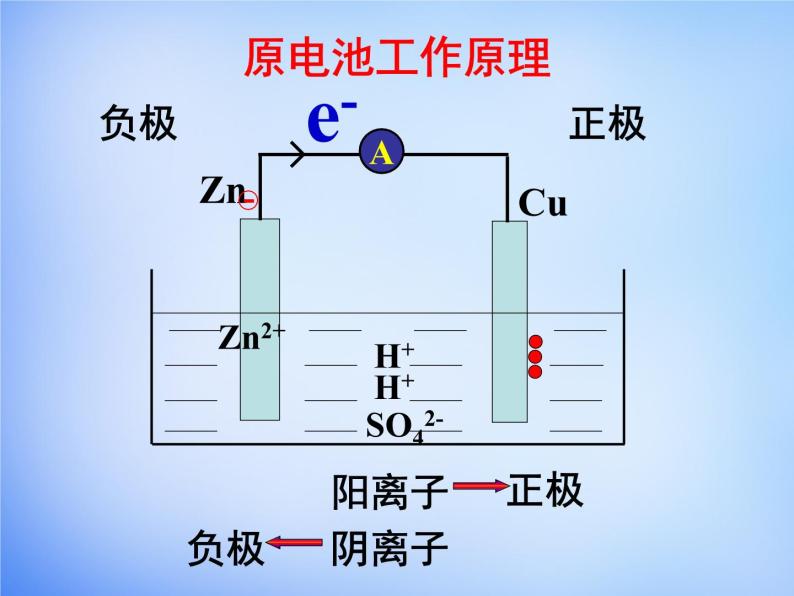
2.根据电子(电流)流动的方向判断 电子--由 流出,流入 ; 电流--由 流出,流入 。
2.根据电子(电流)流动的方向判断
3.根据电极反应类型判断 负极-- 电子,发生 反应 正极-- 电子,发生 反应
3.根据电极反应类型判断
4.根据电解质溶液离子移动的方向判断 阴离子-向 极移动(负极带正电荷) 阳离子-向 极移动(正极带负电荷)
4.根据电解质溶液离子移动的方向判断
5.根据电极现象来判断 负极-- ; 正极-- ;
5.根据电极现象来判断
6.燃料电池中 燃料在 反应 氧化剂在 反应
巩固:已知反应AsO43-+2I-+2H+ AsO33-+I2+H2O是可逆反应.设计如图装置,进行下述操作:(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,发现微安培表指针偏转;(Ⅱ)若改往(B)烧杯中滴加40%NaOH溶液,发现微安培表指针向前述相反方向偏转.试回答:(1)两次操作过程中指针为什么会发生偏转?答: 。(2)两次操作过程中指针偏转方向为什么会相反?试用平衡移动原理解释此现象.答:____________________________________________________。(3)(Ⅰ)操作过程中C1棒上发生的反应为 。(4)(Ⅱ)操作过程中C2棒上发生的反应为 。
这是原电池,指针偏转是由于电子流过电流表
B中加盐酸,AsO43—发生得电子反应为正极;而当加入NaOH后,AsO33—发生失电子反应,为负极;
2I——2e— =I2
AsO33——2e—+2OH- = AsO43—+H2O
1.利用原电池原理设计新型化学电池;
2.改变化学反应速率,如实验室用粗锌与硫酸反应制取氢气;
3.进行金属活动性强弱比较;
4.电化学保护法,即将金属作为原电池的正极而受到保护。如在铁器表面镀锌。
三、原电池的主要应用:
(1)比较金属活动性强弱。
下列叙述中,可以说明金属甲比乙活泼性强的是
C.将甲乙作电极组成原电池时甲是负极;
A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲 上有H2气放出;
B.在氧化–还原反应中,甲比乙失去的电子多;
D.同价态的阳离子,甲比乙的氧化性强;
当两种金属构成原电池时,总是活泼的金属作负极而被腐蚀,所以先被腐蚀的金属活泼性较强。
练习:把a、b、c、d四块金属浸入稀硫酸中,用导线两两相连组成原电池。若 a、b相连时,a为负极; c、d相连时,电流由d到c; a、c相连时,c极产生大量气泡, b、d相连时,溶液中的阳离子向b极移动。则四种金属的活泼性顺序为: 。
a>c > d > b
下列制氢气的反应速率最快的是
粗锌和 1ml/L 盐酸;
纯锌和1ml/L 硫酸;
纯锌和18 ml/L 硫酸;
粗锌和1ml/L 硫酸的反应中加入几滴CuSO4溶液。
当形成原电池之后,反应速率加快,如实验室制H2时, 纯Zn反应不如粗Zn跟酸作用的速率快。
(3)比较金属腐蚀的快慢
在某些特殊的场所, 金属的电化腐蚀是不可避免的, 如轮船在海中航行时, 为了保护轮船不被腐蚀,可以在轮船上焊上一些活泼性比铁更强的金属如Zn。这样构成的原电池Zn为负极而Fe为正极,从而防止铁的腐蚀。
下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是
(4)判断溶液pH值变化
在Cu-Zn原电池中,200mLH2SO4 溶液的浓度为0.125ml/L , 若工作一段时间后,从装置中共收集到 0.168L升气体,则流过导线的电子为———— ml,溶液的pH值变_________?(溶液体积变化忽略不计)
y =0.015 (ml)
x =0.015 (ml)
=3.75× 10﹣ 4(ml/L )
∴pH =-lg3.75 ×10-4
=4 -lg3.75
Zn-2e-=Zn2+
2H++2e- =H2↑
2 2 22.4
x y 0.168
0.2×0.125×2
2H+ —— 2e——H2↑
(5)原电池原理的综合应用
例6:市场上出售的“热敷袋”的主要成分为铁屑、炭粉、木屑、少量氯化钠和水等。 “热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会发现有大量铁锈存在。“热敷袋”是利用 放出热量。2)炭粉的主要作用是 。3)加入氯化钠的主要作用是 。4)木屑的作用是 。
与铁屑、氯化钠溶液构成原电池,加速铁屑的氧化
氯化钠溶于水、形成电解质溶液
使用“热敷袋”时受热均匀
以以下反应为基础设计原电池
MnO4- + 8H+ + 5e- = Mn2++4H2O
5Fe2+ – 5e- = 5Fe3+
5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2++4H2O
6.利用原电池原理设计新型化学电池
高中化学人教版 (新课标)选修4 化学反应原理第一节 原电池集体备课课件ppt: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第一节 原电池集体备课课件ppt,共28页。PPT课件主要包含了第一节原电池,探究一,探究二,探究三等内容,欢迎下载使用。
人教版 (新课标)选修4 化学反应原理第一节 原电池教课ppt课件: 这是一份人教版 (新课标)选修4 化学反应原理第一节 原电池教课ppt课件,共41页。PPT课件主要包含了原电池原理,电极反应式,总反应式,锌铜原电池工作原理,实验探索,不可以,电极方程式的书写,练一练,解释某些化学现象,原电池原理应用等内容,欢迎下载使用。
人教版 (新课标)选修4 化学反应原理第一节 原电池教课课件ppt: 这是一份人教版 (新课标)选修4 化学反应原理第一节 原电池教课课件ppt,共27页。PPT课件主要包含了Zn2+,阳离子,阴离子,SO42-,原电池工作原理,外部条件,组成原电池的条件等内容,欢迎下载使用。













