化学必修1第二节 离子反应教学设计
展开学习目标:
1. 理解离子反应的概念
2. 掌握离子方程式的书写方法,理解离子方程式的意义
3. 掌握复分解型离子反应发生的条件
4. 掌握一些常见离子能否共存的判断方法
学习重、难点:离子反应的概念及其发生的条件, 离子反应方程式的书写方
教学过程:
导入新课
[引入] 三国时期,诸葛亮在七擒孟获的过程中,蜀军由于误饮哑泉水、个个不能言语,生命危在旦夕,巧遇老叟,指点迷津——饮用万安溪安乐泉水、终于转危为安,渡过难关,哑泉水为何能致哑,万安溪安乐泉水又是什么灵丹妙药呢?
原来哑泉水中含有较多的硫酸铜,人喝了含铜盐较多的水就会中毒。而万安溪安乐泉水中含有较多的碱,铜离子遇氢氧根离子发生离子反应生成沉淀而失去了毒性。
那么什么叫离子反应?离子反应要发生具备什么条件呢?下面我们一起来进行探究。
推进新课
教学环节一:离子反应的概念
[板书]
一.离子反应( inic reactin ):有离子参加的反应。
[演示实验2-1]
1.CuSO4溶液中滴加NaCl溶液
2.CuSO4溶液中滴加BaCl2溶液
[设问]实验1无明显现象,原因是什么呢?
[回答]只是CuSO4溶液电离出的Cu2+和SO42-与NaCl溶液电离出的Na+ Cl-的简单混合
[提问]实验2中反应说明了什么?
[结论]实验2说明了CuSO4溶液电离出的SO42-和BaCl2溶液电离出的Ba2+发生了化学反应生成了BaSO4白色沉淀。而CuSO4溶液电离出的Cu2+与BaCl2电离出的Cl-并没有发生化学反应,在溶液中仍以Cu2+和Cl-的离子形式存在。
[总结]由实验2可以看出,电解质在水溶液中所电离出的离子并没有全部发生了化学反应,而只有部分离子发生了化学反应生成其他物质。
[分析]上述实验“2”的反应本质:
②BaCl2溶液与CuSO4溶液混合反应本质:Ba2++SO42-=====BaSO4↓
[小结]上述用实际参加反应的离子符号表示离子反应的式子叫做离子方程式。
教学环节二:离子方程式
[板书]二. 离子方程式:用实际参与反应的离子符号来表示离子间反应的过程。
1.离子方程式的书写:“写、拆、删、查”四个步骤。
[讲解]
以BaCl2溶液与CuSO4溶液为例来研究一下离子方程式的书写。
①“写”――根据客观事实,正确书写化学方程式,例:
BaCl2+CuSO4===BaSO4↓+CuCl2
②“拆”――将易溶于水、易电离的物质(强电解质)拆成离子形式,把难于水的物质或难电离的物质以及气体、单质、氧化物仍用分子形式表示。
Ba2++2Cl-+Cu2++SO2-4===BaSO4↓+Cu2++2Cl-
③“删”――对方程式两边都有的相同离子,把其中不参加反应的离子,应按数消掉。Ba2++SO42-===BaSO4↓
④“查”――检查方程式两边各元素、原子个数和电荷数是否守恒,离子方程式两边的系数是否为最简比。
[小结]
四步中,“写”是基础,“拆”是关键,“删”是途径,“查”是保证。既然拆是关键,拆时应注意作出准确判断,易溶、易电离物质应拆,难溶、难电离物质仍保留化学式。
[点击试题]
完成下列反应的离子方程式。
①HCl+NaOH ② HCl+KOH ③ NaOH + H2SO4 ④ H2SO4+KOH
[投影小结]
[设问]通过这些离子方程式你们发现了什么?
[分析]反应物不同,却都可用同一离子方程式表示。
[小结]可见离子方程式与化学方程式的意义不一样,化学方程式仅代表某一个反应的情况,而离子方程式不仅可表示一定物质间的某一个反应,而且表示所有同一类型的反应。
[板书]2. 离子方程式的意义
①揭示反应的实质。
②不仅表示一定物质间的某一个反应,而且表示所有同一类型的反应。
[设问]是否所有的中和反应的离子方程式都可表示为:H++OH-=====H2O
[点击试题]
完成下列反应的离子方程式:
①Cu(OH)2+HCl ②CH3COOH+KOH ③Ba(OH)2+H2SO4
[讲解]上述三个反应的离子方程式分别为:
Cu(OH)2+2H+=====Cu2++2H2O (Cu(OH)2——难溶碱)
CH3COOH+OH-=====CH3COO-+H2O (CH3COOH——难电离物)
Ba2++2OH-+2H++SO42- =====BaSO4↓+2H2O
[引导]通过上述比较可知,H++OH-=====H2O这一离子方程式表示的是什么样的中和反应?
[小结]H++OH-=====H2O表示强酸+强碱生成可溶性盐+水的这一类反应的本质。
[学生实验]实验2-3
[提问]上述离子反应发生后,溶液中各离子的数目有何变化?(总有离子的减少)
[归纳]离子反应的实质就是通过反应使某些离子的数目明显减少的过程。
[讨论]哪些因素可以使离子数目明显减少?
教学环节三:离子反应发生的条件
[板书]三. 离子反应发生的条件
生成难溶物、难电离物质(弱酸、弱碱、水)或挥发性物质(气体)。因此,复分解反应均为离子反应。
[投影总结]
(1)常见酸、碱、盐的溶解性规律
酸:除硅酸外一般均可溶;
碱:除NaOH、KOH、Ba(OH)2、NH3 H2O溶,Ca(OH)2微溶,其余均难溶;
盐:钾、钠、铵、硝酸盐均可溶,氯化物中AgCl,Hg2Cl2不溶。硫酸盐中BaSO4、PbSO4、CaSO4、Ag2SO4
(2)常见的弱酸、弱碱
弱酸:HF、CH3COOH、HClO、H2S、H2SO3、H3PO4、H2SiO3
弱碱:NH3 H2O、难溶碱
[过渡]
在现阶段,我们就研究复分解型的离子反应。
教学环节四:注意事项
[板书]四. 注意事项
[投影小结]
(1) 注意哪些物质是难溶于水的物质,哪些物质是易溶于水的,哪些物质是微溶于水的。在写离子方程式时难溶于水的物质必须用分子式写,如BaSO4,AgCl,CaCO3 等。
对于微溶物的处理,有以上三种情况:
①当反应物中有微溶物并且处于澄清状态时,应将微溶物写成离子形式。如在澄清石灰水中通入适量CO2,其离子方程式为:Ca2++2OH- +CO2 ==CaCO3 ↓+H2O
②当反应物中有微溶物,且处于悬浊液或固态时,应将微溶物写成分子式。如在石灰乳中加入Na2CO3 浓溶液,其离子方程式为:Ca(OH)2 +CO32- ==CaCO3 ↓+2OH-
③在生成物中有微溶物析出时,应用分子式表示。向澄清石灰水中加入稀硫酸,其离子方程式为:Ca2++2OH-+2H++SO42-==CaSO4↓+2H2O
(2)注意反应是否在溶液中进行。离子方程式只能用来表示电解质在溶液中进行的反应,不是在溶液中进行的反应,一般不用离子方程式表示。
例如,氯化铵固体与熟石灰固体之间经加热生成氨气的反应,尽管是复分解反应,但不是以自由移动的离子形式参与反应的,就不能用离子反应表示,只能用化学反应方程式表示:2NH4Cl+Ca(OH)2 ==CaCl2 +2NH3↑+2H2O
(3)多元强酸酸式酸根离子在离子方程中拆开写;多元弱酸酸式酸根离子则不拆开写。
例如NaHSO4 与NaOH的反应,离子方程式为:H++OH-==H2O
NaHCO3与NaOH的反应,离子方程式为:HCO3-+OH-==H2O+CO32-
(4) 单质、氧化物、沉淀、气体在离子方程式一律写成化学式
教学环节五:判断离子方程式正误的方法
[板书]五.判断离子方程式正误的方法
[投影并讲结]
(1)看该反应是否能写出离子反应方程式。
(2)看像== ↑ ↓及必要的反应条件是否正确、齐全。
(3)看表示各物质的化学式是否正确,该用离子表示的是否拆成了离子,该用分子表示的是否写成了分子式。
(4)必须满足守恒原则(元素守恒、电荷守恒)
(5)不可以局部约分。注意溶液中溶质电离出的阴离子和阳离子配数比是否正确。某些离子方程式离子数不能任意约减,例如,H2SO4与Ba(OH)2溶液反应的离子方程式,应当是Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O 而不能写成Ba2++OH-==BaSO4↓+H2O
[过渡]前面我们学习了离子反应及离子反应方程式,接下来我们来讨论本节最后一个问题,有关溶液中的离子能否大量共存?
教学环节六:离子共存问题
[板书]六. 离子共存问题
[讲述]离子反应是向着离子减弱的方向进行。离子共存是指离子之间不能发生离子反应。反之如离子间能发生反应,则离子间不能共存。
造成离子不能共存的原因主要由以下几个方面:
[板书]1.复分解反应
(1)在溶液中某此离子间能互相反应生成难溶性物质时,这些离子就不能大量共存。
如SO42-与Ba2+、Pb2+、Ag+;
OH-与Cu2+、Fe3+、Mg2+、Al3+、Zn2+;
Ag+与Cl-、Br-、I-、CO32-、SO32-、S2-;
Mg2+、Ca2+、Ba2+与CO32-、SO32-、PO43-;S2-与Cu2+、Pb2+等
(2)离子间能结合生成难电离的物质时,则这些离子不能大量共存。
如H+ 与OH-、ClO-、CH3COO-、HPO42-、H2PO4-、F- 、S2-
OH-与HCO3-、HS-、HSO3-、H2PO4-、HPO42-、H+等不能大量共存。
(3)离子间能结合生成挥发性物质时,则这些离子不能大量共存。
如:H+与CO32-.SO32-.S2-.HCO3-,HSO3-,HS-
OH-与NH4+等不能大量共存。
[小结]强酸与弱酸的阴离子和弱酸的酸式酸根离子不能大量共存。
强碱与弱碱的阳离子和弱酸的酸式酸根离子不能大量共存。
[讲解]注意题目是否给出附加条件,例如酸碱性,在酸性溶液中除题给离子外,还应有大量H+,在碱性溶液中除题给离子外,还应有大量OH-;是否给定溶液无色,若给定无色时则应排除:Cu2+(蓝色)、Fe3+(黄棕色)、Fe2+(浅绿色)、MnO4-(紫色)
[总结]本节学习了离子反应及其表示形式,离子方程式的书写、意义,还有离子反应发生的条件,离子共存问题,其中离子方程式的书写是一难点,又是重要的化学用语,能够正确书写离子方程式,将为化学学习带来众多方便。希望同学们多练。
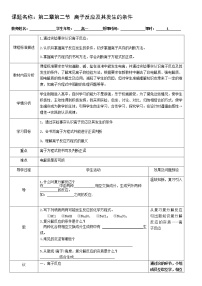
化学方程式
离子方程式
NaOH +HCl ==NaCl +H2O
KOH +HCl ==KCl +H2O
2NaOH + H2SO4 ==Na2SO4 +2H2O
2KOH + H2SO4 ==K2SO4 +2H2O
H+ + OH-==H2O
H+ + OH- ==H2O
H+ + OH- ==H2O
H+ + OH- ==H2O
现象及离子方程式
1、向盛有2 mL Na2SO4 溶液的试管里加入2 mL BaCl2 溶液
有白色沉淀
SO42- + Ba2+ ==BaSO4 ↓
2、向盛有2 mL NaOH 稀溶液的试管里滴入几滴酚酞溶液,再用滴管向试管里慢慢滴入稀盐酸,至溶液恰好变色为止
溶液变红,又逐渐褪去
H+ + OH- ==H2O
3、向盛有2 mL Na2CO3 溶液的试管里加入2 mL 盐酸
有气泡产生
CO32-+2H+ ==H2O +CO2
高中化学人教版 (新课标)必修1第二节 离子反应教学设计及反思: 这是一份高中化学人教版 (新课标)必修1第二节 离子反应教学设计及反思,共4页。
2020-2021学年第二节 离子反应教案: 这是一份2020-2021学年第二节 离子反应教案,共6页。教案主要包含了离子反应及其发生条件等内容,欢迎下载使用。
高中化学人教版 (新课标)必修1第二节 离子反应教学设计: 这是一份高中化学人教版 (新课标)必修1第二节 离子反应教学设计,共4页。