高中化学人教版 (新课标)必修1第二节 化学计量在实验中的应用第2课时教案设计
展开课前预习学案
预习目标
预习气体摩尔体积的概念;初步掌握阿伏加德罗定律的要,并学会运用该定律进行有关简单推理。
预习内容
气体摩尔体积
1.概念: 。
2.符号_____;单位__ ___。
3.标准状况下(0℃,101kPa) Vm=___________
4.气体体积V、气体摩尔体积Vm和物质的量之间的关系表达式 。
三、提出疑惑
同学们,通过你的自主学习,你还有哪些疑惑,请把它填在下面的空格中
课内探究学案
学习目标
理解和掌握点气体摩尔体积的概念;
初步掌握阿伏加德罗定律的要,
学会运用该定律进行有关简单推理。
学习重点、难点 : 气体摩尔体积概念的逻辑推理过程;阿伏加德罗定律的直观理解。
学习过程
(一)气体摩尔体积
【互动探究】1、物质的体积与哪些量的大小有关?
2、为什么1ml气体在标准状况下所占的体积都约是22.4升?
3、什么是气体摩尔体积?表示符号是?单位?如何理解标准状况?
4、气体摩尔体积、物质的量、气体的体积三者之间的关系式是如何?
1、探究问题:
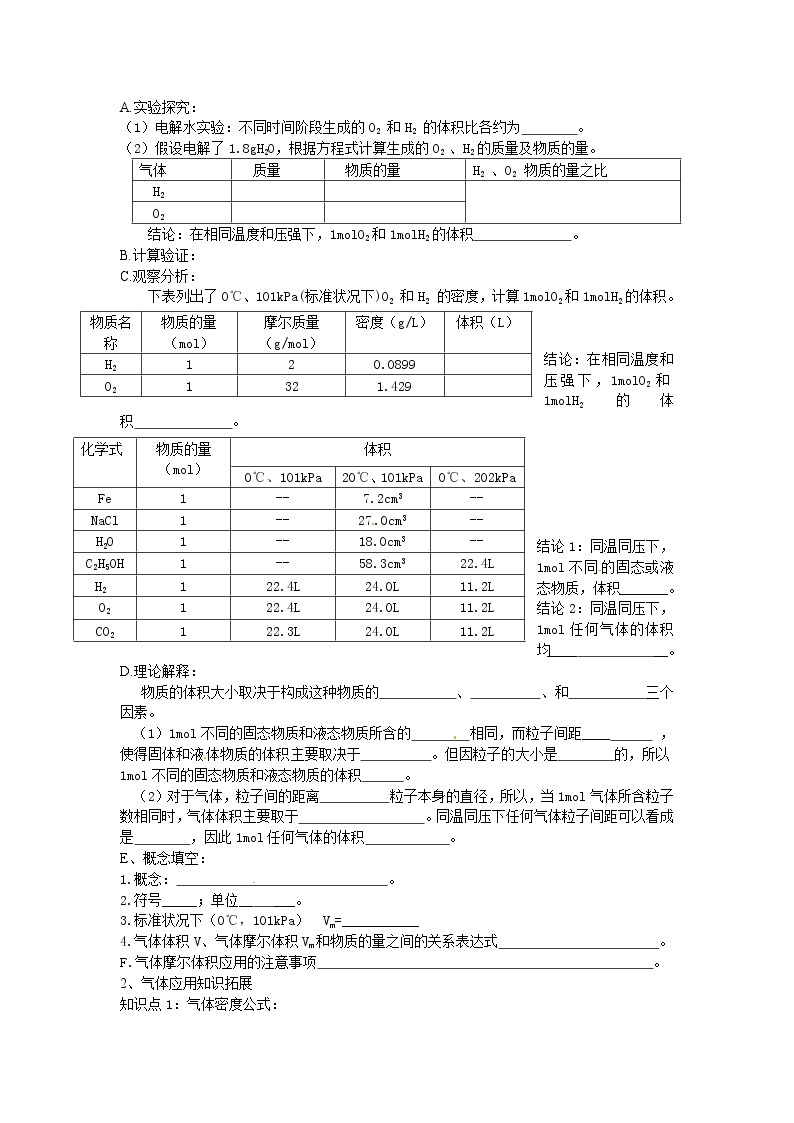
A.实验探究:
(1)电解水实验:不同时间阶段生成的O2 和H2 的体积比各约为 。
(2)假设电解了1.8gH2O,根据方程式计算生成的O2 、H2的质量及物质的量。
结论:在相同温度和压强下,1mlO2和1mlH2的体积 。
B.计算验证:
C.观察分析:
下表列出了0℃、101kPa(标准状况下)O2 和H2 的密度,计算1mlO2和1mlH2的体积。
结论:在相同温度和压强下,1mlO2和1mlH2的体积 。
结论1:同温同压下,1ml不同的固态或液态物质,体积_______。
结论2:同温同压下,1ml任何气体的体积均____ __。
D.理论解释:
物质的体积大小取决于构成这种物质的 、 、和 三个因素。
(1)1ml不同的固态物质和液态物质所含的 相同,而粒子间距____ ,使得固体和液体物质的体积主要取决于 。但因粒子的大小是 的,所以1ml不同的固态物质和液态物质的体积 。
(2)对于气体,粒子间的距离 粒子本身的直径,所以,当1ml气体所含粒子数相同时,气体体积主要取于 。同温同压下任何气体粒子间距可以看成是 ,因此1ml任何气体的体积 。
E、概念填空:
1.概念: 。
2.符号_____;单位__ ___。
3.标准状况下(0℃,101kPa) Vm=___________
4.气体体积V、气体摩尔体积Vm和物质的量之间的关系表达式 。
F.气体摩尔体积应用的注意事项 。
2、气体应用知识拓展
知识点1:气体密度公式:
1.气体密度ρ与摩尔质量M关系是 。标准状况下任何气体的密度ρ= 。
2.推导同温同压下,气体的密度之比和摩尔质量之比有何关系?
用符号表示为 。
思维训练1:
1.同温同压下,等质量的CO2和SO2两种气体的密度之比是 。
2.同温同压下,某气体A对氧气的相对密度为0.5,求A的是式量是多少?A气体对空气的相对密度是多少?
(二)阿伏加德罗定律及推论:
1.在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子,此定律称为
。
2.推论:同温同压下,任何气体的体积之比= 之比= 之比。
用符号表示为:相同T、P:
反思总结
物质的量与物质所含的微粒数N、质量m、气体体积V之间的关系
当堂检测
1.下列说法中,正确的是
A.1ml某气体的体积是22.4L,该气体所处的状况不一定是标准状况.
B.非标准状况下,1mlO2的体积必定不是22.4L
C.某物质含有阿伏加德罗常数个微粒,该物质在标准状况下的体积为22.4L
D.标准状况下,1mlH2和O2的混合气体的体积不一定为22.4L
2.H2和CO的混合气体5.6L(标准状况)充分燃烧,需要O2的质量为
A.8g B.16g C.4g D.无法确定
3.同温同压下,同体积的氢气和甲烷各种量的比应是:分子个数比( );原子个数比( );物质的量之比( );质量之比( )
A.1:1 B.2:5 C.1:8 D.1:5
4.下列说法正确的是(NA表示阿伏加德罗常数)
A.在常温常压下,11.2LN2含有的分子数为0.5NA
B.在常温常压下,1mlHe含有的原子数目为NA
C.71gCl2所含原子数为2NA
D.在同温同压下,相同体积的任何气体单质所含原子数相同
5.在相同条件下.一个容器充满NO,另一个容器充满N2和O2,两个容器的体积相同,则两个容器内的气体一定具有相同的
A.原子数 B.电子数 C.中子数 D.质量
6.标准状况下,1.7gNH3和____________LH2S含有相同的氢原子数.
7.2mlSO3和3mlSO2其分子数之比为_____________;相同状况下(均为气体)体积之比为_____________;氧原子数之比为__________________.
五、课后练习与提高
1.对1ml H2O的说法正确的是( )
A 含有6.02×1023个氢分子 B 含有6.02×2×1023个氢元素
C 质量为18g D 氢原子与氧原子的物质的量之比为2:1
2.跟2.8g N2含有相同分子数的下列物质是( )
A 16g氧气 B 0.1ml甲烷分子 C 1.8g水 D 3.01×1022个磷酸分子
3.下列数量的物质中,含原子数最多的是( )
A 标准状况下11.2升CO2 B 0.2ml NH3 C 13.5g水 D 6.02×1023个Ar原子
4.同温同压下,下列气体的密度最大的是( )
A F2 B Cl2 C HCl D CO2
5.下列叙述正确的是( )
A 1ml任何气体的体积都约为22.4L B 48g O3和1.5ml O2所含氧原子数相等
C 17g OH- 和19g H3O+ 所含电子数相等 D 28g氮气所含原子数为阿伏加德罗常数
6.下列说法正确的是( )
A 三氧化硫的摩尔质量是80g
B 氧原子的质量就是氧的相对原子质量
C 氖的摩尔质量在数值上等于它的原子量
D 1ml氩气和1ml氟气具有相同的质子数
7.在标准状况下,下列物质占体积最大的是( )
A 98g H2SO4 B 6.02×1023个氮分子 B 44.8L HCl D 6g氢气
8. 0.5ml H2SO4 的质量是 g,含 个分子,含 ml氧原子,能和 ml
NaOH完全反应,该硫酸所含氢元素的质量与 ml H3PO4或 g HCl中所
含氢元素的质量相同.
9. 质量相等的SO2 和SO3,物质的量之比为 , 硫原子的原子个数之比为 ,
氧原子的原子个数之比为 .
10.12.8g氧气与 L(标准状况)的CO气体所含氧原子数相同,与 ml SO2所
含的分子数相同.
知识拓展: 1 ρ=M.Vm ρ=M.22.4
ρ1: ρ2=M1:M2
思维训练 1 11:16 2 16 0.55
(二)阿伏加德罗定律及推论:
1 阿伏加德罗定律
2 物质的量 粒子个数 V1/V2=n1/n2
当堂检测 1 A 2 BC 3 ABC 4 BC 5 A 6 3.36L 7 2:3 2:3 1:1、
课后练习与提高 1 CD 2 BC 3 C 4 B 5 BC 6 CD 7 D
49 3.01×1023
5:4 5:4 5:6 10 17.92 0.4
气体
质量
物质的量
H2 、O2 物质的量之比
H2
O2
物质名称
物质的量(ml)
摩尔质量(g/ml)
密度(g/L)
体积(L)
H2
1
2
0.0899
O2
1
32
1.429
化学式
物质的量(ml)
体积
0℃、101kPa
20℃、101kPa
0℃、202kPa
Fe
1
--
7.2cm3
--
NaCl
1
--
27.0cm3
--
H2O
1
--
18.0cm3
--
C2H5OH
1
--
58.3cm3
22.4L
H2
1
22.4L
24.0L
11.2L
O2
1
22.4L
24.0L
11.2L
CO2
1
22.3L
24.0L
11.2L
人教版 (新课标)选修5 有机化学基础第二节 有机化合物的结构特点教案设计: 这是一份人教版 (新课标)选修5 有机化学基础第二节 有机化合物的结构特点教案设计,共9页。教案主要包含了物质的量的单位——摩尔,气体摩尔体积等内容,欢迎下载使用。
高中化学人教版 (新课标)必修1第二节 化学计量在实验中的应用教学设计: 这是一份高中化学人教版 (新课标)必修1第二节 化学计量在实验中的应用教学设计,共17页。教案主要包含了混合物的分离和提纯,离子的检验,物质的量及物质的量浓度等内容,欢迎下载使用。
高中化学人教版 (新课标)必修1第二节 化学计量在实验中的应用第4课时教案设计: 这是一份高中化学人教版 (新课标)必修1第二节 化学计量在实验中的应用第4课时教案设计,共8页。教案主要包含了物质的量浓度,稳定的),填空题等内容,欢迎下载使用。