

高中化学第二节 醛教学设计
展开
普通高中课程标准实验教科书—化学选修5[人教版]
第二节 醛
教学目标:
1.认识醛典型代表物的组成和结构特点。
2.根醛的组成和结构的特点,认识醛的加成、氧化反应。
教学重点: 醛的组成和结构特点。
教学难点: 醛的加成、氧化反应。
探究建议:①实验:醛基的检验。②调查与讨论:甲醛在生产生活中的应用,以及对健康的危害。
课时划分:一课时
教学过程:
[导课]上一节课中,我们学习了乙醇的性质,同学们想一下乙醇催化氧化的产物是什么?(乙醛),醛是重要的一类化合物,引发室内污染的罪魁祸首-甲醛及乙醛都是重要的醛,今天我们学习…
[板书]第二节 醛
[设问]:乙醛是怎样的一种物质呢?下面我们具体地来认识一下。
[板书]一、乙醛分子的组成和结构
[展示]乙醛分子的结构模型
[讲述]分析—CHO的结构。由于氧原子吸引电子的能力大于碳原子,使得C=O双键的电子云向氧原子偏移,C—H键电子云向碳原子偏移,C=O双键是不饱和的极性键,C—H键是极性键。因此,在化学反应中,C=O双键和C—H键都可能断键。乙醛分子中的醛基对乙醛的主要化学性质起决定作用。
[板书] 分子式: ,结构式(注意键的类型): 结构简式: 。乙醛的官能团为 (称为: )。
[板书]二、乙醛的物理性质
[讲解]观察试剂瓶内的乙醛,用“招气入鼻”的方法闻乙醛的气味。
[提问]乙醛有哪些物理性质?
生:它是无色、有刺激性气味的液体。
[演示]乙醛跟水、氯仿互溶的投影实验
师:根据投影实验的现象,乙醛还有哪些物理性质?
生:乙醛能跟水、氯仿等互溶。
[板书]乙醛是无色、有刺激性气味的液体,密度比水小,沸点是20。8℃,易挥发、易燃烧、能跟水、乙醇、乙醚、氯仿等互溶。
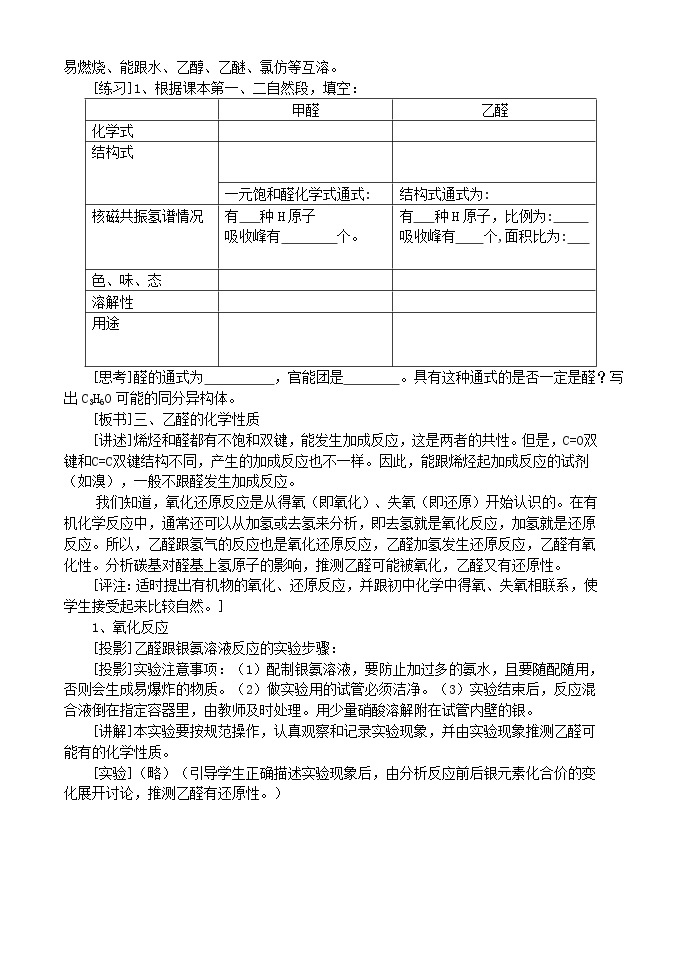
[练习]1、根据课本第一、二自然段,填空:
| 甲醛 | 乙醛 |
化学式 |
|
|
结构式
|
|
|
一元饱和醛化学式通式: | 结构式通式为: | |
核磁共振氢谱情况 | 有 种H原子 吸收峰有 个。 | 有 种H原子,比例为: 吸收峰有 个,面积比为: |
色、味、态 |
|
|
溶解性 |
|
|
用途 |
|
|
[思考]醛的通式为 ,官能团是 。具有这种通式的是否一定是醛?写出C3H6O可能的同分异构体。
[板书]三、乙醛的化学性质
[讲述]烯烃和醛都有不饱和双键,能发生加成反应,这是两者的共性。但是,C=O双键和C=C双键结构不同,产生的加成反应也不一样。因此,能跟烯烃起加成反应的试剂(如溴),一般不跟醛发生加成反应。
我们知道,氧化还原反应是从得氧(即氧化)、失氧(即还原)开始认识的。在有机化学反应中,通常还可以从加氢或去氢来分析,即去氢就是氧化反应,加氢就是还原反应。所以,乙醛跟氢气的反应也是氧化还原反应,乙醛加氢发生还原反应,乙醛有氧化性。分析碳基对醛基上氢原子的影响,推测乙醛可能被氧化,乙醛又有还原性。
[评注:适时提出有机物的氧化、还原反应,并跟初中化学中得氧、失氧相联系,使学生接受起来比较自然。]
1、氧化反应
[投影]乙醛跟银氨溶液反应的实验步骤:
[投影]实验注意事项:(1)配制银氨溶液,要防止加过多的氨水,且要随配随用,否则会生成易爆炸的物质。(2)做实验用的试管必须洁净。(3)实验结束后,反应混合液倒在指定容器里,由教师及时处理。用少量硝酸溶解附在试管内壁的银。
[讲解]本实验要按规范操作,认真观察和记录实验现象,并由实验现象推测乙醛可能有的化学性质。
[实验](略)(引导学生正确描述实验现象后,由分析反应前后银元素化合价的变化展开讨论,推测乙醛有还原性。)
[板书]Ag++NH3·H2O=AgOH↓+NH4+
AgOH+2 NH3·H2O =[Ag(NH3)2]++OH-+2H2O
[讲解]在上述反应里,银氨络合离子被还原成金属银,附着在试管内壁上,形成银镜。这个反应叫做银镜反应。反应最终生成物可巧记为:一水、二银、三氨、乙酸铵。
应用:(1)实验室里常用银镜反应检验醛基。(2)工业上利用葡萄糖(含—CHO)发生银镜反应制镜和在保温瓶胆上镀银。
[评注:用实验检证乙醛的还原性,并引导学生从实验现象的观察去论证乙醛的结构要点,从而突出醛基的特性,并明确官能团对有机物性质的决定作用。在此基础上指出银镜反应的实际运用,使学生感到学有所用。]
[投影]乙醛跟新制氢氧化铜反应的实验步骤和注意事项
[讲解]本反应中氢氧化铜是过量的,使用过量的游离碱能加快醛基的氧化。使用新制的氢氧化铜有两个原因,一是新制备的氢氧化铜反应性能好,现象明显。二是在氢氧化钠溶液中加几滴2%硫酸铜溶液,能获得检验醛基的灵敏试剂。这个实验操作简便、不要另行购制试剂。(实验略。)(引导学生正确描述实验现象后,由分析反应前后铜元素化合价的变化展开讨论,得出由于乙醛有还原性,所以能把新制的氢氧化铜还原成红色的氧化亚铜沉淀,并让学生板书反应的离子方程式和化学方程式。)
[板书]Cu2++2OH-=Cu(OH)2↓
[讲解]实验室利用该反应检验醛基。医院里利用这一反应检验病人是否患有糖尿病(检验葡萄糖中的醛基)。
在上述反应中,银氨络合物和新制的氢氧化铜都是弱氧化剂,这表明乙醛有较强的还原性。
[实验]乙醛跟酸性高锰酸钾溶液反应
[讲解]乙醛既能被弱氧化剂氧化,也能被强氧化剂氧化。
[板书]
[板书]2、乙醛的加成反应:,该反应还属于还原反应(P58)
[讲解]1、醛基与H2的加成反应,是分子中引入羟基的一种方法。
2、工业上不用该反应来制取乙醇。
[小结]乙醛既有氧化性又有还原性,以还原性为主。醛基的氧化或还原,是有机合成中引入羟基(—OH)的两种方法。
[练习]完成下列反应的化学方程式或离子方程式。
(1)RCHO+[Ag(NH3) 2]++OH-→
(2)RCHO十Cu(OH)2→
(3)RCHO十H2→
[投影] 科学视野 丙酮
1.丙酮的分子式C3H6O,结构简式CH3COCH3。酮的通式R1COR2。
酮是羰基直接与两个烃基相连,没有与羰基直接相连的氢原子,所以不能发生氧化反应。
2.丙酮易挥发、易燃烧,可跟水、乙酸及乙醚等以任意比互溶,能溶解多种有机物,是一种重要的有机溶剂。
3.丙酮的化学性质:CH3COCH3+H2→CH3CHCH3
总结、扩展
1.饱和一元醛的通式:CnH2n+1CHO或CnH2nO,由于醛类物质都含有醛基,它们的性质很相似。如,它们都能被还原成醇,被氧化成羧酸,都能发生银镜反应等。
2.饱和一元醛、酮互为同分异构体,它们具有相同的通式CnH2nO,从分子组成上看比乙烯多一个氧原子,其通式也可以看做CnH2n-2·H2O,它们燃烧时耗氧量与同碳原子的炔烃相同,生成的水与同碳原子数的烯烃相同。
[课堂练习]
1.丙醛和氢氧化铜反应形成砖红色沉淀的实验中,决定实验成败的关键是
A.Cu(OH)2要新制 B.CuSO4要过量 C.CH3CH2CHO要过量 D.NaOH要过量
2.已知烯烃在一定条件下氧化时,C=C键断裂,RCH=CHR′可氧化成RCHO和R′CHO。下列烯烃中,经氧化可得到乙醛和丁醛的是
A.1-己烯 B.2-己烯 C.2-甲基-2-戊烯 D.3-己烯
3.下列物质在常温下是气体的是
A.甲醇 B.甲醛 C.四氯化碳 D.乙醛
4.下列各组中的每一种物质都能使溴水褪色的是
A.硝酸银溶液、KBr溶液、氨水、四氯化碳B.乙醛溶液、K2SO3、氨水、KNO3溶液
C.苯酚溶液、石灰水、裂化汽油、异戊二烯D.KI溶液、淀粉溶液、H2S溶液、酒精
5.丙烯醛的结构简式为CH2=CH-CHO,下列有关它的性质叙述中错误的是
A.能使溴水褪色,也能使酸性高锰酸钾溶液褪色
B.在一定条件下与H2充分反应生成1-丙醇
C.能发生银镜反应,表现氧化性 D.在一定条件下能被空气氧化。
6.下列关于醛的说法中,正确的是
A.甲醛是甲基跟醛基相连而构成的醛 B.醛的官能团是-COH
C.甲醛和丙醛互为同系物 D.饱和一元脂肪醛的分子组成符合CnH2nO通式
7.下列物质中,在常温常压下为气体,并能与苯酚发生缩聚反应的是
A.丙烯 B.蚁醛 C.乙炔 D.甲醇
8.甲醛是一种______色______气味的______体,______溶于水,其35-40%水溶液称______,此溶液可用于______等;还可与苯酚在一定条件下制______。乙醛是______色______气味______体,______溶于水还能溶于_____等溶剂。
9.在一支洁净的试管中加入少量的硝酸银溶液,滴入氨水现象______,化学方程式______;再继续滴加氨水至沉淀刚好消失,此时溶液称______,其化学方程式______,在此溶液中滴几滴乙醛,水浴加热,现象______,此反应称______反应,化学方程式______。在此过程中乙醛发生______(氧化、还原)反应,此反应可以检验______基的存在。
10.在硫酸铜溶液中加入适量氢氧化钠溶液,现象___________,离子方程式______,在此液体中滴入福尔马林加热,可看到______,化学方程式______。
11.醛类的官能团是______,醛可以发生加氢还原反应,是因为官能团中的______键能发生______反应;醛可以发生氧化反应,是因为官能团中______的键能发生______反应。
12.某饱和一元醛7.2g与银氨溶液作用,生成21.6g银,求此类醛的结构简式。
13.某种醛的组成是含碳62.1%、氢10.3%、氧27.6%(均为质量分数),它的蒸气密度是氢气的29倍。写出这种醛的分子式、结构式和名称。
参考答案:
1.AD;2.B;3.B;4.C;5.C;6.CD;7.B;
8.无;具有强烈刺激性;气;易;福尔马林;杀菌;酚醛树脂;无色;具有刺激性;液;既能;乙醇、乙醚、氯仿。
9.有白色沉淀;AgNO3+NH3·H2O==AgOH↓+NH4NO3;银氨溶液;AgOH+2NH3·H2O==Ag(NH3)2OH+2H2O;有银白色金属析出;银镜。
CH3CHO+2Ag(NH3)2OH2Ag↓+CH3COONH4+3NH3+H2O;氧化;醛。
10.有浅蓝色沉淀生成Cu2++2OH-==Cu(OH)2↓
有红色沉淀生成;HCHO+2Cu(OH)2HCOOH+Cu2O+2H2O
11.醛基(-CHO);C=O双;还原;C-H;氧化。
所以饱和一元醛的物质的量为:0.1mol
则CnH2nO=72 n=4
分子式为C4H8O,可能的结构式如下:
13.解:醛的相对分子质量为:29×2=58
即:C∶H∶O=3∶6∶1
所以此醛的分子式为C3H6O,结构式为CH3CH2CHO,是丙醛。
[小结]略。
[作业]P59 1、2、3、4、5
[板书计划]
第二节 醛
一、乙醛分子的组成和结构
分子式: ,结构式(注意键的类型): 结构简式: 。乙醛的官能团为 (称为: )。
二、乙醛的物理性质
乙醛是无色、有刺激性气味的液体,密度比水小,沸点是20。8℃,易挥发、易燃烧、能跟水、乙醇、乙醚、氯仿等互溶。
三、乙醛的化学性质
1、氧化反应
Ag++NH3·H2O=AgOH↓+NH4+
AgOH+2 NH3·H2O =[Ag(NH3)2]++OH-+2H2O
Cu2++2OH-=Cu(OH)2↓
2、乙醛的加成反应:
[知识拓展1] 甲醛
1.甲醛的结构特点:
(1)甲醛的分子式CH2O,结构简式HCHO,结构式
(2)分析:从结构上看甲醛是H原子与-CHO直接相连,没有烃基。结构很特别,与羰基相连的两个H原子在性质上没有区别,受羰基的影响,两个H原子都非常活泼。
2.甲醛的物理性质
甲醛又叫蚁醛是一种无色具有强烈刺激性气味的液体,易溶于水。
福尔马林是质量分数含35%~40%的甲醛水溶液。甲醛的水溶液具有杀菌和防腐能力,是一种良好的杀菌剂。
3.甲醛的化学性质
(1)与氢气加成 HCHO+H2→CH3OH
(2)银镜反应HCHO+2[Ag(NH3)2]++2OH-→HCOO-+NH4++2Ag↓+3NH3+H2O=反应产物HCOO-中仍含有-CHO,可进一步与银氨溶液反应。
(3)与新制得的氢氧化铜溶液反应HCHO+2Cu(OH)2→HCOOH+Cu2O↓+2H2O
[知识拓展2] 甲醛——室内污染的罪魁祸首
木版中为什么含甲醛
市面上的家具、地板可分两大类。一类称之为实木,另外一类为复合木材(板材)。前者为天然原木直接锯切后成形,未经复合拼接处理的木材。后者是由天然木材切锯后经粘接复合、表面覆以贴面而成。因为目前市面上所用的粘着剂是以甲醛为主要原料制成的,所以复合板材一般都会散发出一种刺激性的气体,即甲醛。人体长期处于甲醛浓度超标的环境下会出现嗅觉异常、刺激、过敏、肺功能异常、免疫功能异常等方面的症状。
室内空气中甲醛污染对健康的影响
现代科学研究表明,甲醛对人体健康有不良影响。当室内空气中甲醛含量为0.1 mg/m³时就有异味和不适感,美国环保局室内空气品质部认为人长期暴露在甲醛释放达到0.153 mg/m³室内时,就会产生不适感;0.5 mg/m³可刺激眼睛引起流泪;0.6 mg/m³时引起咽喉不适或疼痛;浓度随着升高,还可引起恶心、呕吐、咳嗽、胸闷、气喘;当大于65 mg/m³时甚至可引起肺炎、肺水肿等损伤,甚至导致死亡。长期接触低剂量甲醛(0.017~0.068 mg/m³)可以引起慢性呼吸道疾病、女性月经紊乱,引起新生儿体质降低,染色体异常,甚至引起鼻炎癌,高浓度的甲醛对神经系统、免疫系统、肝脏等都是毒害,长期接触较高浓度的甲醛会出现急性精神抑郁症。甲醛还有致畸、致癌作用,据流行病学调查,长期接触甲醛的人,可引起鼻腔、口腔、鼻咽、咽喉、皮肤和消化道癌症,国际癌症研究所已建议将其作为可疑致癌物对待。
[知识拓展3] 植物中的醛
肉桂醛:分子式C9H8O分子量132.15,结构简式:,又称β-苯丙烯醛。淡黄色油状液体,有香味。是桂皮油和肉桂油的主要成分。熔点-7.5℃,沸点246℃、密度(20/4℃)1.0497克/厘米3,折射率l.618~1.623。微溶于水,溶于乙醇、乙醚、氯仿和油中。能随水蒸气挥发。在空气中易被氧化成肉桂酸。用于配制肥皂用香精,也用作食品的增香剂。可由桂皮油中分离出来,或由肉桂醇氧化或由苯甲醛和乙醛缩合制得。
苯甲醛:分子式C7H6O分子量:106.12,结构简式:。略带苦杏仁味的无色的无色液体。凝固点-56.5℃,沸点179℃,密度(20/4℃)1.046克/厘米3。微溶于水,能与乙醇、乙醚、氯仿、苯混溶、化学性质不稳定,遇空气逐渐氧化成苯甲酸,可还原成为苯甲醇。能还原银氨溶液,但不与斐林试剂作用。要密封和避光保存。自然界中苯甲醛以苦杏仁苷的形式存在于苦杏仁中,能与水一起蒸馏。是一种重要的化工原料。用于制肉桂醛、肉桂酸、苯乙醛等,也是生产香料的原料。工业上由甲苯氧化或由苯二氯甲烷水解制得。
高中化学人教版 (新课标)选修5 有机化学基础第二节 醛教学设计: 这是一份高中化学人教版 (新课标)选修5 有机化学基础第二节 醛教学设计,共6页。教案主要包含了乙醛,醛类,丙酮等内容,欢迎下载使用。
选修5 有机化学基础第二节 醛教学设计: 这是一份选修5 有机化学基础第二节 醛教学设计,共5页。教案主要包含了教学目标,教学重点,教学难点,课时安排,教学过程,学生活动,指导阅读,演示实验3-5等内容,欢迎下载使用。
化学选修5 有机化学基础第二节 醛教案及反思: 这是一份化学选修5 有机化学基础第二节 醛教案及反思,共5页。教案主要包含了教学目标,教学重点,教学过程,实验3-5,实验3-6,思考和交流等内容,欢迎下载使用。













