苏教版必修一专题3 从矿物到基础材料第一单元 从铝土矿到铝合金教案设计
展开专题3 从矿物质到基础材料
第一单元 从铝土矿到铝合金
1. 从铝土矿中提取铝
⑴ 元素是地壳中含量最多的金属元素,约占地壳总量的 。在地壳中含量依次降低的金属是 、 、 。 铝在大自然以稳定的 态存在。铝土矿的主要成分为 ,还有少量的 、 等杂质。
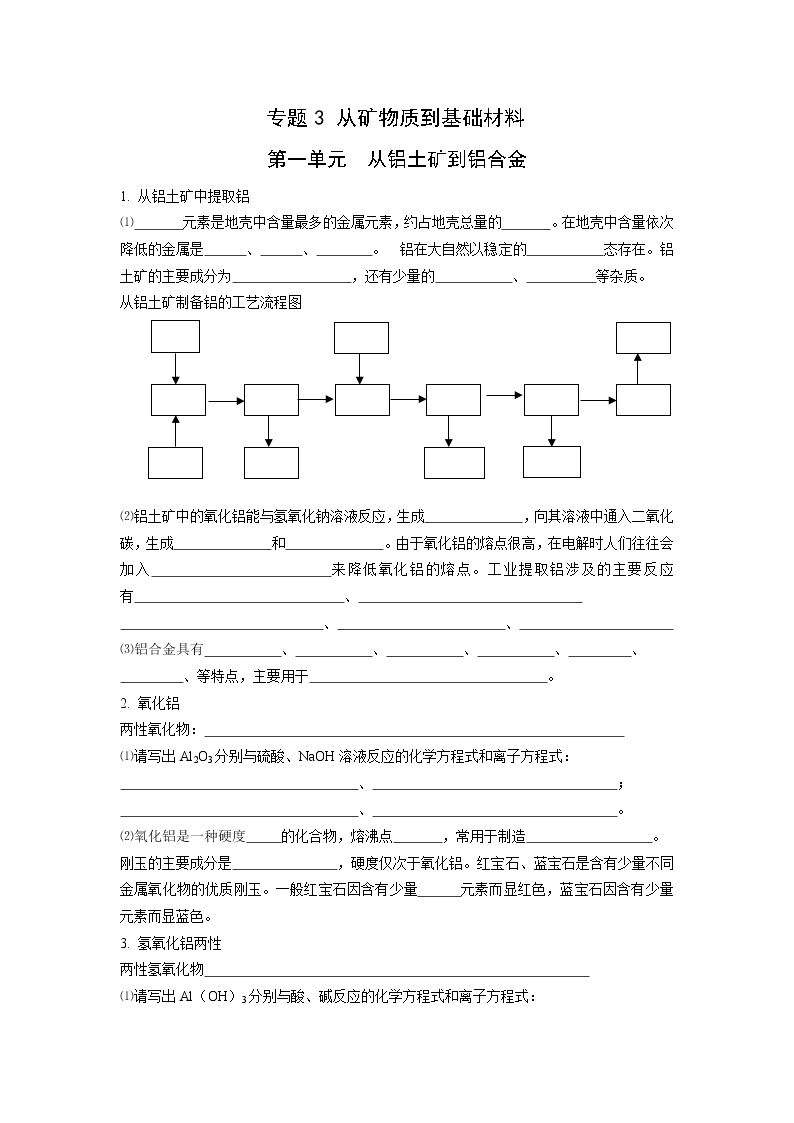
从铝土矿制备铝的工艺流程图
⑵铝土矿中的氧化铝能与氢氧化钠溶液反应,生成 ,向其溶液中通入二氧化碳,生成 和 。由于氧化铝的熔点很高,在电解时人们往往会加入 来降低氧化铝的熔点。工业提取铝涉及的主要反应有 、
、 、
⑶铝合金具有 、 、 、 、 、
、等特点,主要用于 。
2. 氧化铝
两性氧化物:
⑴请写出Al2O3分别与硫酸、NaOH溶液反应的化学方程式和离子方程式:
、 ;
、 。
⑵氧化铝是一种硬度 的化合物,熔沸点 ,常用于制造 。
刚玉的主要成分是 ,硬度仅次于氧化铝。红宝石、蓝宝石是含有少量不同金属氧化物的优质刚玉。一般红宝石因含有少量 元素而显红色,蓝宝石因含有少量 元素而显蓝色。
3. 氢氧化铝两性
两性氢氧化物
⑴请写出Al(OH)3分别与酸、碱反应的化学方程式和离子方程式:
、 。
、 。
⑵明矾的净水原理(文字与方程式结合):
⑶注意:①AlCl3中逐滴加入NaOH溶液,反应时可看作是经过两步反应:
第一步: 、 第二步:
②在NaAlO2溶液中逐滴加入盐酸,也是分两步进行的,先生成Al(OH)3沉淀,盐酸过量时沉淀消失。离子方程式分别是 、
⑷实验室制取氢氧化铝的离子方程式
4. 铝的性质
(1)铝制品抗腐蚀性的原因:
(2)跟酸的反应 非氧化性酸:Al + HCl =====
强氧化性酸: 下铝遇 或 ,会在铝表面生成致密的氧化膜而发生 。故浓硝酸、浓硫酸可保存在密闭 制容器中。
(3)跟碱溶液的反应
跟碱溶液反应的原理: 、
总反应的化学方程式:
指出铝与碱溶液反应的氧化剂、还原剂,标出电子转移的方向和数目:
⑷铝热反应 (1)条件:高温
(2)金属氧化物:在金属活动性顺序表中排在铝之后的金属氧化物
(3)反应过程中放出大量的热,产生高温,使金属单质熔融。
铝热反应: ,常用于
金属氧化物 + Al 高温==== Al2O3 + 金属单质
写出V2O5、MnO2、Cr2O3分别与Al发生铝热反应的化学方程式:
______________________
_________________________________________________
_________________________________________________
5. 铝盐和偏铝酸盐的相互转化:(写出下列反应的离子方程式)
Al3+ 反应①:
②:
③:
④:
⑤:
⑥:
AlO2- Al(OH)3
①由铝盐制备氢氧化铝时,一般用弱碱——氨水,不用强碱,为什么?
②由偏铝酸盐制备氢氧化铝时,一般用弱酸——CO2 +H2O,不用强酸,为什么?
高中苏教版第三单元 人类对原子结构的认识教案: 这是一份高中苏教版第三单元 人类对原子结构的认识教案,共3页。
高中化学苏教版必修一第一单元 氯、溴、碘及其化合物教案及反思: 这是一份高中化学苏教版必修一第一单元 氯、溴、碘及其化合物教案及反思,共3页。
高中苏教版第二单元 钠、镁及其化合物教学设计: 这是一份高中苏教版第二单元 钠、镁及其化合物教学设计,共3页。