
必修二专题2 化学反应与能量转化第三单元 化学能与电能的转化教案
展开年级 组别 | 高一化学 | 审阅 (备课组长) |
| 审阅 (学科校长) |
| ||
主备人 |
| 使用人 |
| 授课时间 |
| ||
课题 | 苏教版化学必修二 专题二第三单元 化学能转化能电能 | 课 型 | 新授课 | ||||
课标 要求 |
| ||||||
教 学 目 标 | 知识与能力 | 通过活动与探究认识原电池,了解原电池工作原理。 | |||||
过程与方法 | 通过活动与探究认识原电池,了解原电池工作原理及应用,学会进行简单的原电池设计。 | ||||||
情感、态度与价值观 | 通过对实验现象的的分析理解,加深对原电池的理解,培养学生理论联系实际的思维,提高其化学学习兴趣 | ||||||
教学 重点 | 原电池的形成条件 | ||||||
教学 难点 | 原电池的原理 | ||||||
教学 方法 | 实验探究法 | ||||||
教学程序设计 | |||||||
教 学 过 程 及 方 法 | 环节一 明标自学 | ||||||
过程设计 | 二次备课 | ||||||
通过前面的学习,我们知道化学反应过程中都有能量的变化;化学能可以转化为热能、光能、电能等,其中重点学习了化学能与热能的转化。下面我们学习化学能与电能之间的转化。 今天我们主要掌握以下几个问题: 什么叫原电池? 原电池化学原理是什么? 原电池的正负极的规定与反应类型 原电池形成条件 |
| ||||||
教 学 过 程 及 方 法 | 环节二 合作释疑 环节三 点拨拓展 (备注:合作释疑和点拨拓展可以按照顺序先后进行,也可以根据教学设计交叉进行设计) | ||||||
过程设计 | 二次备课 | ||||||
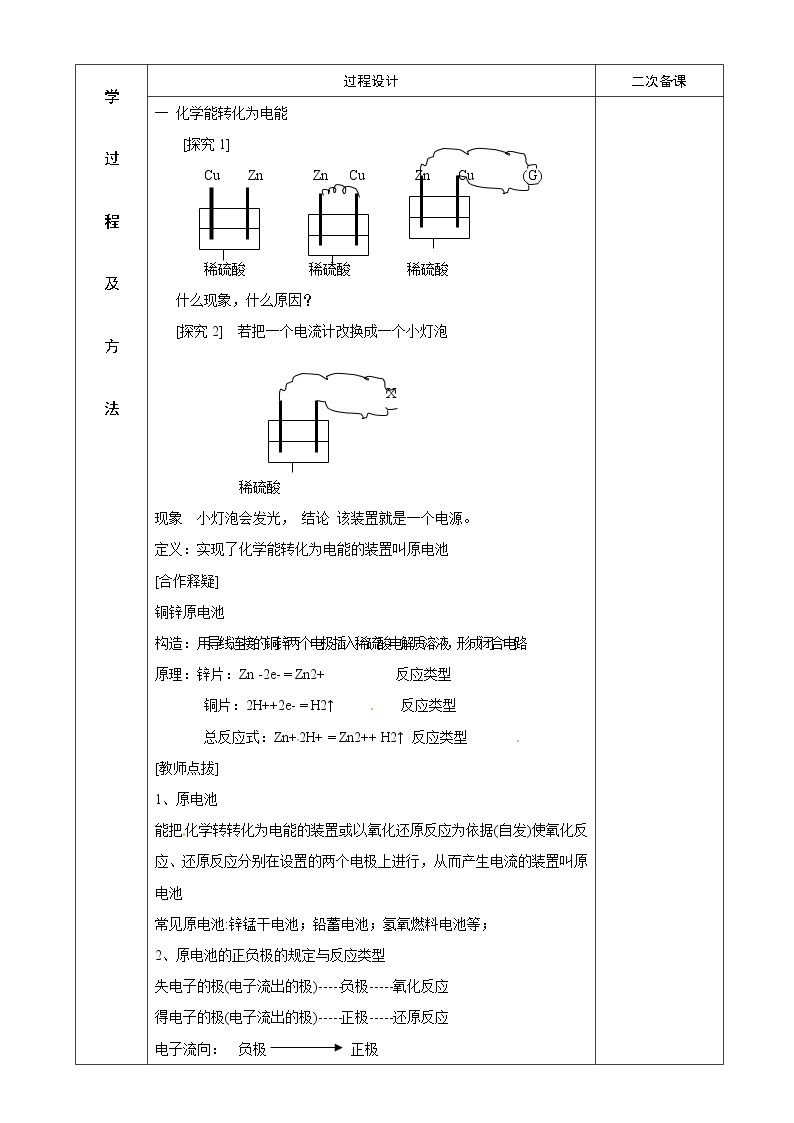
一 化学能转化为电能 [探究1] Cu Zn Zn Cu Zn Cu (G)
稀硫酸 稀硫酸 稀硫酸 什么现象,什么原因? [探究2] 若把一个电流计改换成一个小灯泡
X
稀硫酸 现象 小灯泡会发光, 结论 该装置就是一个电源。 定义:实现了化学能转化为电能的装置叫原电池 [合作释疑] 铜锌原电池 构造:用导线连接的铜锌两个电极插入稀硫酸电解质溶液,形成闭合电路 原理:锌片:Zn -2e- = Zn2+ 反应类型 铜片:2H++2e- = H2↑ 反应类型 总反应式:Zn+2H+ = Zn2++ H2↑ 反应类型 [教师点拔] 1、原电池 能把化学转转化为电能的装置或以氧化还原反应为依据(自发)使氧化反应、还原反应分别在设置的两个电极上进行,从而产生电流的装置叫原电池 常见原电池:锌锰干电池;铅蓄电池;氢氧燃料电池等; 2、原电池的正负极的规定与反应类型 失电子的极(电子流出的极)-----负极-----氧化反应 得电子的极(电子流出的极)-----正极-----还原反应 电子流向: 负极 正极 溶液中离子移动方向: 阴离子向负极(锌片)移动,阳离子向正极(铜片)移动 3、原电池原理 负极 mM - mne- =m Mnn+ 反应类型 极极 nNm+ + nme- = nN + 反应类型 总反应式:mM + nNm+ == m Mnn+ +nN 反应类型 4、原电池形成条件 (1)有电解质溶液 (2)有两个活动性不同的金属(一种金属 另一种非金属) 具体 ①金-------金 ②金-------非金属如:石墨 ③金-------不溶性的金属氧化物 两电极浸入电解质溶液中且用导线连接或直接接触闭合回路 [指出] 1、闭合回路有多种方式 如下: Cu Zn Cu Zn Cu Zn
稀硫酸 稀硫酸 稀硫酸 2、电极与电解质溶液可能反应,也可能不反应如生铁放入氯化钠溶液中生锈。 3、原电池中正极不参加化学反应,仅作导体,负极参加反应而溶解进入溶液 4、原电池相比于一般条件下的氧化还原反应的优点:反应速率加快;能量利用率高。 5、能把化学转转化为电能或以氧化还原反应为依据(自发)使氧化反应、还原反应分别在设置的两个电极上进行,从而产生电流的装置的装置叫原电池 |
| ||||||
教学 过程 及 方法 | 环节四 当堂检测 | 二次备课 | |||||
1、下列装置中哪些是原电池?是原电池的请指出正、负极并写出电极反应式 Fe Cu Zn Cu Fe C
稀硫酸 酒精 稀硫酸 稀硫酸 稀硫酸 ① ② ③ ④ 2、下列A、B、C、D四个装置中分别具有足量的CuCl2溶液 Zn Cu C Pt Zn Cu Zn Zn
A B C D (1)A、B、C、D四个装置中属于原电池的是 分析原因 (2)A中的Zn是 极,电极反应式 发生的反应类型 Cu是 极,电极反应式 发生的反应类型 总反应方程式: (3)指出A工作时溶液中离子的移动方向 |
| ||||||
课堂小结 | 1、什么是原电池,正负极怎么规定的? 2、形成原电池的条件有哪些? | ||||||
作业 | 课本 P46 EX1 | ||||||
板 书 设 计 | 一、 化学能转化为电能 1、原电池 2、原电池的正负极的规定与反应类型 3、原电池原理 4、原电池形成条件 | ||||||
课后 反思 |
| ||||||
鲁科版2019 高中化学 选修一1.2 化学能转化为电能——电池 教案(2课时): 这是一份鲁科版2019 高中化学 选修一1.2 化学能转化为电能——电池 教案(2课时),文件包含化学能转化为电能1-教学设计docx、化学能转化为电能2-教学设计docx等2份教案配套教学资源,其中教案共4页, 欢迎下载使用。
高三化学《化学能转化为电能 电池》复习教案2: 这是一份高三化学《化学能转化为电能 电池》复习教案2,共5页。教案主要包含了教学目标,教学重点,教学难点,教学过程等内容,欢迎下载使用。
【鲁科版】高考化学一轮复习第20讲化学能转化为电能__电池教案: 这是一份【鲁科版】高考化学一轮复习第20讲化学能转化为电能__电池教案,共17页。













