高中化学鲁科版必修2第3节 化学反应的利用第二课时教学设计
展开高一化学鲁科版必修2第二章第3节第2课时
化学反应为人类提供能量
一、教学目标
(一)知识与技能目标
1、掌握原电池的工作原理。
2、了解常见的电池及化学科学在能源开发和利用方面的重要应用。
3、了解化学能与其它形式能量的相互转化。
(二)过程与方法目标
1、通过“活动·探究”原电池的工作原理培养学生的观察能力、实验探究能力和分析解决问题的能力。
2、 利用追根寻源、资料在线等拓展性栏目开拓学生的视野。
(三)情感态度与价值观目标
1、通过教材中活动栏目的设计,培养学生的探索精神和实事求是的科学态度。
2、提升学生对化学反应价值的认识,赞赏化学科学对个人生活和社会发展的贡献。
二、教学重点、难点
(一)知识上重点、难点
原电池的工作原理。
(二)方法上重点、难点
怎样将化学能转化为电能。
三、教学准备
(一)学生准备
收集身边的废旧电池,思考生活、生产中能量的来源及利用。
(二)教师准备
1、教学媒体、课件;
2、编制“活动·探究”活动报告及实验仪器和药品(铜片2片、锌片2片、石墨电极、200ml稀硫酸、250ml烧杯、电流计、导线若干等)。
四、教学方法
实验探究法,启发、讨论、对比
五、课时安排 1课时
六、教学过程
教学 环节 | 教师活动 | 学生活动 | 设计意图 |
引入新课
拓展新课 | 【讲述】今天我们来学习化学反应为人类提供能量,先来看一个实验。 【实验】将锌片插入稀硫酸中,可观察到什么现象? 【引导】请写出锌与稀硫酸反应的离子方程式,并用双线桥和单线桥描述电子转移的情况。 锌与稀硫酸反应是什么反应? 什么微粒失去电子?什么微粒得到电子? 该反应的氧化反应过程是什么?还原反应过程是什么? 反应中电子是如何转移的?转移了几个电子? 对于用单线桥表示电子转移的离子方程式,有同学提出了一个非常有创意的猜想:假如能把连接Zn和H+的线桥变成导线,接入灯泡会有怎样的现象? 这种想法若能实现,可以为人类提供电能,将解决许多能源问题,有很大的价值。 |
锌片插入稀硫酸中有气泡产生,锌片逐渐溶解。
思考、回答 有电子的定向移动,产生了电流,灯泡应该发光。 | 明确学习内容,引起学生学习兴趣
回顾知识, 为后面探究做铺垫
有创意的猜想,激发学生的探究欲望 |
实验探究
总结原理
跟踪检测
认识化学反应为人类提供的多种形式能量
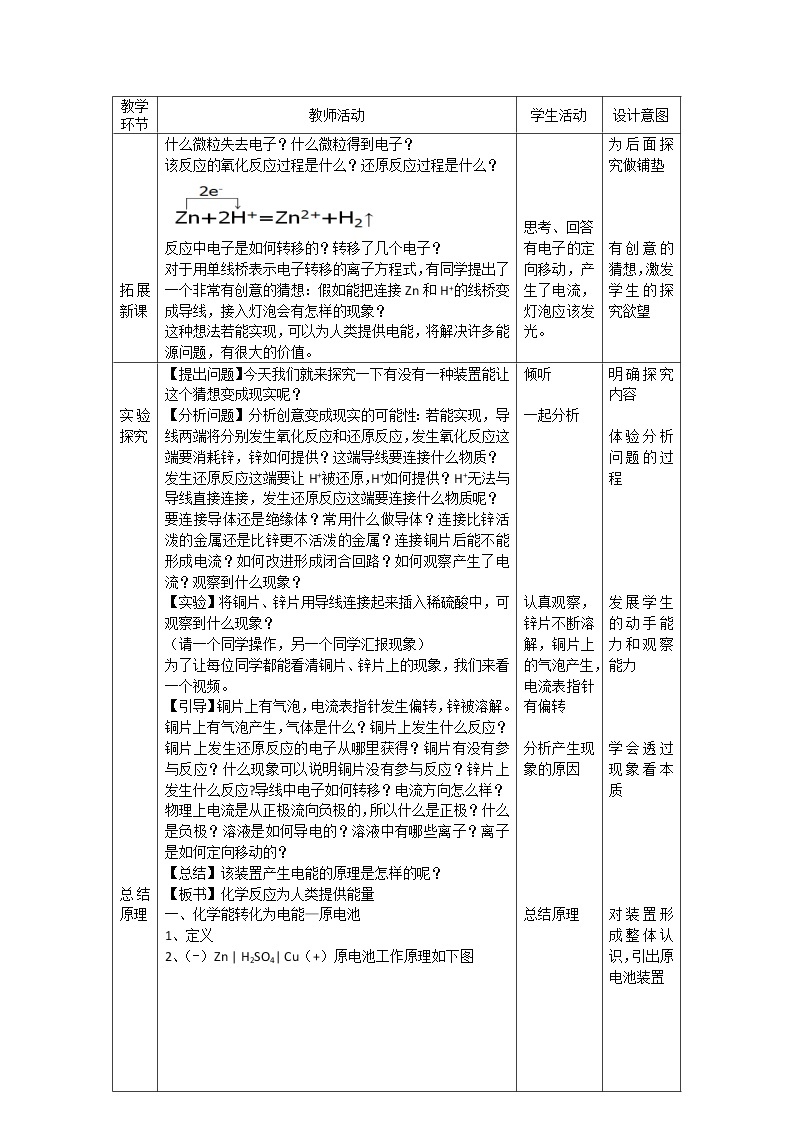
总结 布置作业 | 【提出问题】今天我们就来探究一下有没有一种装置能让这个猜想变成现实呢? 【分析问题】分析创意变成现实的可能性:若能实现,导线两端将分别发生氧化反应和还原反应,发生氧化反应这端要消耗锌,锌如何提供?这端导线要连接什么物质? 发生还原反应这端要让H+被还原,H+如何提供?H+无法与导线直接连接,发生还原反应这端要连接什么物质呢? 要连接导体还是绝缘体?常用什么做导体?连接比锌活泼的金属还是比锌更不活泼的金属?连接铜片后能不能形成电流?如何改进形成闭合回路?如何观察产生了电流?观察到什么现象? 【实验】将铜片、锌片用导线连接起来插入稀硫酸中,可观察到什么现象? (请一个同学操作,另一个同学汇报现象) 为了让每位同学都能看清铜片、锌片上的现象,我们来看一个视频。 【引导】铜片上有气泡,电流表指针发生偏转,锌被溶解。 铜片上有气泡产生,气体是什么?铜片上发生什么反应?铜片上发生还原反应的电子从哪里获得?铜片有没有参与反应?什么现象可以说明铜片没有参与反应?锌片上发生什么反应?导线中电子如何转移?电流方向怎么样? 物理上电流是从正极流向负极的,所以什么是正极?什么是负极?溶液是如何导电的?溶液中有哪些离子?离子是如何定向移动的? 【总结】该装置产生电能的原理是怎样的呢? 【板书】化学反应为人类提供能量 一、化学能转化为电能—原电池 1、定义 2、(-)Zn | H2SO4| Cu(+)原电池工作原理如下图
电流流动方向:正极流向负极 离子移动方向:阴离子向负极移动阳离子向正极移动 【小结】我们把创意的想法转变为了现实,这就是科学研究的魅力。 【设问】在原电池中,铜片并没有参与反应,那么,铜片的作用是什么呢?能不能用其他材料代替铜片呢? (带着问题阅读第51页的“追根寻源”) 【学生演示】把(-)Zn | H2SO4| Cu(+)原电池中正级换成锌片或铜片,有何现象?正极材料是否是唯一的呢? 【引导】(-)Zn | H2SO4| Cu(+)原电池的形成条件哪些呢?装置中发生什么反应?要形成电势差要具备什么条件?为形成闭合回路,用了哪些方法将两极连接? 【板书】3、(-)Zn | H2SO4| Cu(+)原电池的形成条件 (1)发生自发的氧化还原反应 (2)有两活性不同的电极:一极发生氧化反应,一极发生还原反应 (3)电极材料均插入稀硫酸(电解质)溶液中,两极还用导线相连,从而形成闭合回路 【课堂训练】1、关于(-)Zn | H2SO4| Cu(+)原电池的有关叙述错误的是( ) A.锌为负极,锌发生氧化反应 B.溶液中硫酸的物质的量减小 C.负极发生还原反应,正极发生氧化反应 D.电流方向是从铜片流向锌片 2、下列说法中正确的是( ) A.原电池是把电能转为化学能的装置 B.原电池中电子流出的一极是正极,发生氧化反应 C.原电池两极均发生氧化还原反应 D.原电池中的阳离子向正极移动 【引导】利用上述原理可制成多种电池,电池的种类有哪些? 【板书】4、电池的分类 【视频】原电池的种类是多样的,观看苹果手机创意广告 【讲述】所以化学不仅可以用来制备物质,为人类提供能量,还可以提高我们的生活质量,可以让你看懂如此有深度的广告,是一门具有实用、创造性和趣味性的学科。 【讲述】化学能除了能转化为电能,还能转化为其他形式的能吗? 【板书】二、化学能转化为光能、热能 【板书】三、不同形式能量之间的转化 化学能与热能:放热反应与吸热反应 化学能与光能:燃烧与光合作用 化学能与电能:原电池与电解 【讲述】化学能以多种途径与其他形式的能进行着转化,并直接参与到整个自然界的能量循环之中。在能源问题备受注目的今天,化学科学将在能源的开发和利用方面发挥非常重要的作用。 【总结】本节课学习的主要知识 【作业】导与学 【研究性学习】 1、什么是电势差? 2、其他原电池是不是都具备(-)Zn | H2SO4| Cu(+)原电池的形成条件? 3、(-)Zn | H2SO4| Cu(+)原电池的负极产生的气泡原因有哪些? | 倾听
一起分析
认真观察,锌片不断溶解,铜片上的气泡产生,电流表指针有偏转
分析产生现象的原因
总结原理
阅读“追根寻源”,认识铜片的作用
思考,回答
积极作答
阅读教材,结合生活进行分类
联系生活经验作答
梳理本课学习内容 | 明确探究内容
体验分析问题的过程
发展学生的动手能力和观察能力
学会透过现象看本质
对装置形成整体认识,引出原电池装置
体验成功探究的喜悦 发展提取信息的能力
进一步认识Zn | H2SO4| Cu原电池的组成
巩固原电池的原理
认识原电池的分类,体验原电池的广泛用途 认识各种形式的原电池
认识能量转化形式的多样性和相互性
总结本节学习内容,形成知识体系,明确课后学习内容 |
板书设计:
化学反应为人类提供能量
一、化学能转化为电能—原电池
1、定义
2、(-)Zn | H2SO4| Cu(+)原电池工作原理如右图
电子流向:负极流向正极
电流流向:正极流向负极
离子移动方向:阴离子向负极移动
阳离子向正极移动
3、(-)Zn | H2SO4| Cu(+)原电池的形成条件
4、电池的分类
二、化学能转化为热能、光能
三、不同形式能量之间的相互转化
教学反思:本节课通过用双线桥分析锌与稀硫酸反应的电子转移情况回顾了氧化还原反应的有关知识,为探究原电池装置做好了铺垫,再通过用单线桥分析锌与稀硫酸反应的电子转移情况来引出学生提出的可以把电子的定向转移转化为电能的猜想,再进一步探究原电池装置并用实验验证。引入新知识很新颖,原电池工作原理讲解很清晰,学生易理解,印象深刻。但本节课教材是本章第一节从化学反应本质认识化学反应能量变化知识的延伸,这样引入不利于学生形成系统知识,形成整体知识框架。弥补方法是在练习课上再次联系前后知识,构建知识框架。
化学第3节 化学反应的利用第二课时教案: 这是一份化学第3节 化学反应的利用第二课时教案,共3页。教案主要包含了教学重点,教学准备,教学方法,教学过程等内容,欢迎下载使用。
鲁科版必修2第2章 化学键 化学反应与能量第2节 化学反应的快慢和限度教学设计: 这是一份鲁科版必修2第2章 化学键 化学反应与能量第2节 化学反应的快慢和限度教学设计,共4页。
化学必修2第2章 化学键 化学反应与能量综合与测试教学设计及反思: 这是一份化学必修2第2章 化学键 化学反应与能量综合与测试教学设计及反思,共12页。