

鲁科版必修2第1节 化学键与化学反应教案设计
展开第2章 化学反应与能量
第一节 化学键与化学反应
一. 本节教材分析
(一)教材特点
在前边原子结构和元素周期律知识的基础上,引导学生进一步探索原子是如何结合成为分子的。通过对化学键概念的建立,使学生在原子、分子的水平来认识物质的构成和化学反应。老教材把“物质的构成”和“化学反应中的能量变化”两个知识点,分开来讲,两者知识跨度较大,前后联系不太紧密。实际上人们研究化学反应,有两个主要的目的:一个是研究物质的组成(或得到新的物质),二是研究物质变化时伴随的能量改变。两者是紧密联系的。新教材就突出了这一点,把化学变化和能量变化放到一起来讲,使学生懂得在物质发生化学变化的同时也伴随有能量的变化,从两个视角来关注化学反应,从而为认识化学反应和应用化学反应奠定基础。
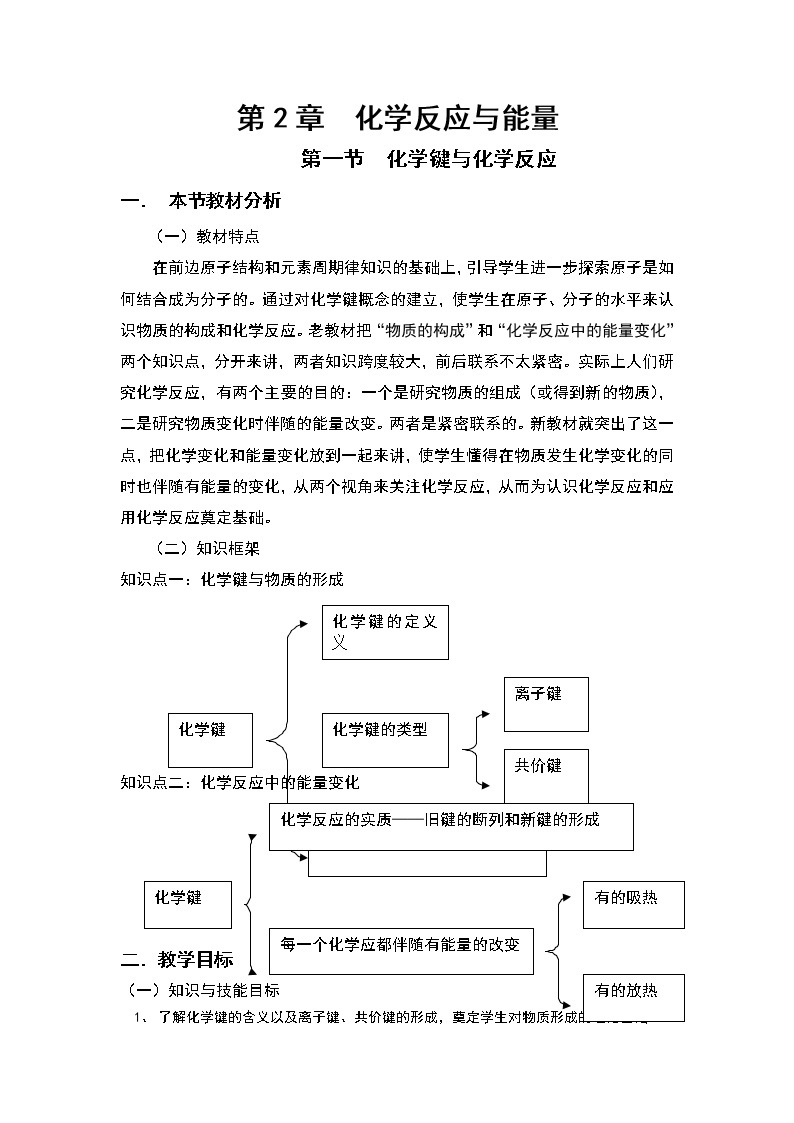
(二)知识框架
知识点一:化学键与物质的形成
知识点二:化学反应中的能量变化
二.教学目标
(一)知识与技能目标
1、 了解化学键的含义以及离子键、共价键的形成,奠定学生对物质形成的理论基础。
2、了解化学反应中伴随有能量的变化的实质和化学能与其他能量形式之间的转化。
(二)过程与方法目标
1、讲清化学键存在于分子内相邻的两个或多个原子间,“强烈的相互作用”而不能说成是“结合力”。
2、 通过电解水和氯化氢的形成过程的介绍,搞清共价键的形成原因和存在情况。
3、 关于离子键的形成,通过对NaCl形成过程的分析,引导学生注意离子键的形成特点:(1)成键的主要原因——得失电子(2)成键的微——阴、阳离子 (3)成键的性质:静电作用。当静电吸引与静电排斥达到平衡时形成离子键
4、 通过生产或生活中的实例,了解化学能与热能间的相互转变,认识提高燃料的燃烧效率、开发新型清洁能源的重要性,引导学生关注能源、关注环保能等社会热点。
(三)情感态度与价值观目的
在学生已有知识的基础上,通过重新认识已知的化学反应,引导学生从宏观现象入手,思考化学反应的实质,通过对化学键、共价键、离子键的教学,培养学生的想象力和分析推理能力。通过“迁移·应用”、“交流·研讨”、“活动·探究”等形式,关注学生概念的形成。通过对“化学反应的应用”的学习,提升学生对化学反应的价值的认识,从而赞赏化学科学对人类社会发展的贡献。
三、教学重点、难点
(一)知识上重点、难点
教学重点:化学键、离子键、共价键的的含义,化学键与化学反应的实质,化学键与化学反应能量的关系。难点:对离子键、共价键的成因和本质理解。
(二)方法上突破点
针对共价键和离子键,这些比较抽象的概念,要以某一实例出发,展开分析剖析,从中提出问题,鼓励学生联想质疑,形成概念。
四、教学准备
(一) 学生准备
1、 预习 第1节 化学键与化学反应的第一部分“一、化学键与化学反应中的物质变化
和第二部分“二、化学键与化学反应中的能量变化”
2、 将学生每8人编为一组。准备做木柴在空气中的燃烧实验。
3、感受化学反应中的能量变化:试剂:NaOH溶液,稀盐酸(2mol.L-!,锌粉,氢氧化钡晶体(Ba(OH)2· 8H2O ) 仪器:试管,小烧杯,玻璃片,温度计,镊子,胶头滴管,药匙,单空塞
(二) 教师准备
1、 教学多媒体设备和多媒体课件;
2、 准备电解水的实验装置,以便做电解水的演示实验
3、 氢气在氯气中的燃烧和钠在氯气中的燃烧实验录象
4、 编制“活动·探究”活动报告及评价表。
五、教学方法
问题推进法、总结归纳法
六、课时安排
2课时
七、教学过程
第1课时
第一部分:化学键与化学反应中的物质变化
知识点1:化学键的定义
【引入】前边通过元素周期律、周期表的学习,知道目前已知的元素种类只有一百多种,可这些元素却构成了已发现或合成的一千多万种物质,元素的原子能够相互结合形成多种多样的物质,说明形成这些物质的原子间一定存在着相互作用。
【演示实验】水在直流电的作用下分解
2H2O === 2H2 + O2
【思考·质疑】水在通电条件下能够发生分解,为什么要通电?
【归纳】水分子是由两个氢原子和一个氧原子构成的,氢原子和氧原子之间存在着很强的相互作用,要破坏这种相互作用就需要消耗能量,通电正是为了提供使水分解所需要的能量。
【媒体展示——板书】 第1节 化学键与化学反应
化学键:相邻的(两个或多个)原子间的强相互作用
【对定义的强调】(1)首先必须相邻。不相邻一般就不强烈 (2)只相邻但不强烈,也不叫化学键 (3)“相互作用”不能说成“相互吸引”(实际既包括吸引又包括排斥)
【对上述(1)、(2)做解释——板书】
【进一步分析·归纳】水在通电时分解成H2和O2 ,在这个过程中首先水分子中氢原子和氧原子间的化学键断裂,形成单个的氢原子和氧原子,然后氢原子和氢原子间、氧原子和氧原子间分别又以新的化学键结合成为氢分子和氧分子。结论:化学反应的实质——旧化学键的断裂和新化学键的形成。
【点评】 通过学生对电解水为什么要提供能量的质疑,引出原子形成物质时,原子间确实存在着相互作用,教师及时引导给出化学键的定义。通过学生对化学键定义的阅读理解,教师进一步通过板书解释(水分子间的化学键的存在情况),强调理解化学键定义的几个关键点:(1)首先必须相邻。不相邻一般就不强烈 (2)只相邻但不强烈,也不叫化学键 (3)“相互作用”不能说成“相互吸引”(实际既包括吸引又包括排斥)。通过解释定义使学生对化学键作到了较深刻的理解。
知识点2:化学键的类型
【引入】元素有一百多种,这些元素从大的角度分两类:金属元素、非金属元素。金属元素一般容易失电子,非金属元素一般容易得电子。我们发现非金属和非金属元素之间,非金属元素和金属元素之间、金属元素和金属元素之间都可以通过化学键构成物质,他们之间的化学键是否一样呢?
【实验录象】钠在氯气中的燃烧实验录象
2Na + Cl2 ==== 2NaCl
氢气在氯气中的燃烧实验录象
H2 + Cl2 ==== 2HCl
【点评】“氢气在氯气中的燃烧”和“金属钠在氯气中的燃烧”是《化学1(必修)》中的演示实验,且实验过程中用到了有毒的气体——氯气。此时借助于实验录象不仅快捷省事,而且也不会因氯气的毒性或气体扩散而搞得满屋刺激性气味而影响教学。
【联想·质疑】氢气在氯气中的燃烧形成氯化氢和钠在氯气中的燃烧形成氯化钠,在形成化学键方面是否相同?
【归纳】氢气在氯气中燃烧时,氢分子和氯分子获得能量,化学键分别断裂,从而形成氢原子和氯原子。由于氢和氯都是非金属元素,都有得电子的趋势,最终谁也不能把对方的电子完全得到,而是氯原子和氢原子各提供一个电子组成共用电子对,从而使两者的最外层都达到稳定结构并产生强烈的相互作用——形成化学键。这样的化学键叫共价键。由于氯和氢都没有完全得失电子,因此,都不形成离子,HCl中的氢和氯不能叫氢离子氯离子,只能叫氢原子氯原子。
而在氯化钠的形成过程中,由于钠是金属元素很容易失电子,氯是非金属元素很容易得电子,当钠原子和氯原子靠近时,钠原子就失去最外层的一个电子形成钠阳离子,氯原子最外层得到钠的一个电子形成氯阴离子(两者最外层均达到稳定结构),阴、阳离子靠静电作用形成化学键——离子键,构成氯化钠。由于钠和氯原子之间是完全的得失电子,他们已形成了离子,因此NaCl中的微粒不能再叫原子,而应该叫离子。
【媒体展示——板书】
共价键:原子间通过共用电子对形成的化学键。一般非金属元素之间形成共价键。
离子键:阴阳离子之间通过静电作用形成的化学键。一般存在于金属和非金属之间。
【对定义的强调】(1)共价键的成键微粒是原子,而离子键的成键微粒是阴阳离子 (2)一般典型的非金属和非金属之间都形成共价键,典型的金属和非金属之间都形成离子键 (3)共价键和离子键的实质相同,都属于电性作用。成键原因都是原子都有使自己的最外层达到稳定结构状态的趋势。(稀有气体原子的最外层都已达到稳定结构,因此稀有气体分子都是单原子分子,分子内不形成化学键)
【迁移·应用——课堂练习】
指出构成下列物质的微粒和键型:NaCl、CaO、MgCl2 、H2O、CH4、NH3 、CO2
物质 | 形成化学键的微粒 | 化学键类型 |
H2O |
|
|
CH4 |
|
|
NH3 |
|
|
NaCl |
|
|
MgCl2 |
|
|
CaO |
|
|
CO2 |
|
|
【知识拓展】非极性共价键:在单质分子中同种原子形成的共价键,两个原子对共用电子对共用电子对的吸引能力相同;共用电子对不偏向于任何一个原子,成键原子不显电性。这样的共价键叫非极性共价键。
极性共价键:在共价键形成的化合物分子中,由于不同原子对共用电子对的吸引能力不同,共用电子对会偏向于吸引电子能力强的一方,因此吸引电子能力强的原子带部分负电荷,吸引电子能力较弱的一方带部分正电荷,这样的共价键叫极性共价键。如氯化氢中的共价键就是极性共价键,共用电子对会偏向于氯原子一方偏离于氢原子一方。H2 、Cl2中的化学键。
【点评】 通过氯化氢和氯化钠两种物质的形成过程的剖析,分别给出共价键、离子键的定义;又通过他们化学键的形成特点,从成键微粒、成键原因、成键本质等方面,找出他们之间的异同点。然后把从具体事例得出的结论推广开来,重点强调在什么情况下会形成共价键,在什么情况下会形成离子键,再通过当堂举例判断、练习,使学生对概念的掌握比较清晰。
对于程度好的同学,通过“知识拓展”补充介绍“非极性共价键”和“极性共价键”的概念,以及化合价与共价键的关系,但不要进一步拓展,这样可以达到开拓学生思路的目的。
鲁科版必修2第1节 化学键与化学反应第二课时教案: 这是一份鲁科版必修2第1节 化学键与化学反应第二课时教案,共3页。教案主要包含了教学目标,教学重点,教学准备,教学方法,教学过程第2课时等内容,欢迎下载使用。
化学必修2第2章 化学键 化学反应与能量第1节 化学键与化学反应教案设计: 这是一份化学必修2第2章 化学键 化学反应与能量第1节 化学键与化学反应教案设计,共6页。
鲁科版必修2第1节 化学键与化学反应教案及反思: 这是一份鲁科版必修2第1节 化学键与化学反应教案及反思,共5页。