




备战2021年高考化学之突破反应原理题-化学反应原理(以图破理)仿真预测卷
展开说明:1.本卷为反应原理部分(以图破理)仿真预测卷,选择经典,具有很强的高考导向,
2.本卷由10个单选题和4个综合题组成,建议用时60分钟以内,
3.预祝2020高考大捷!
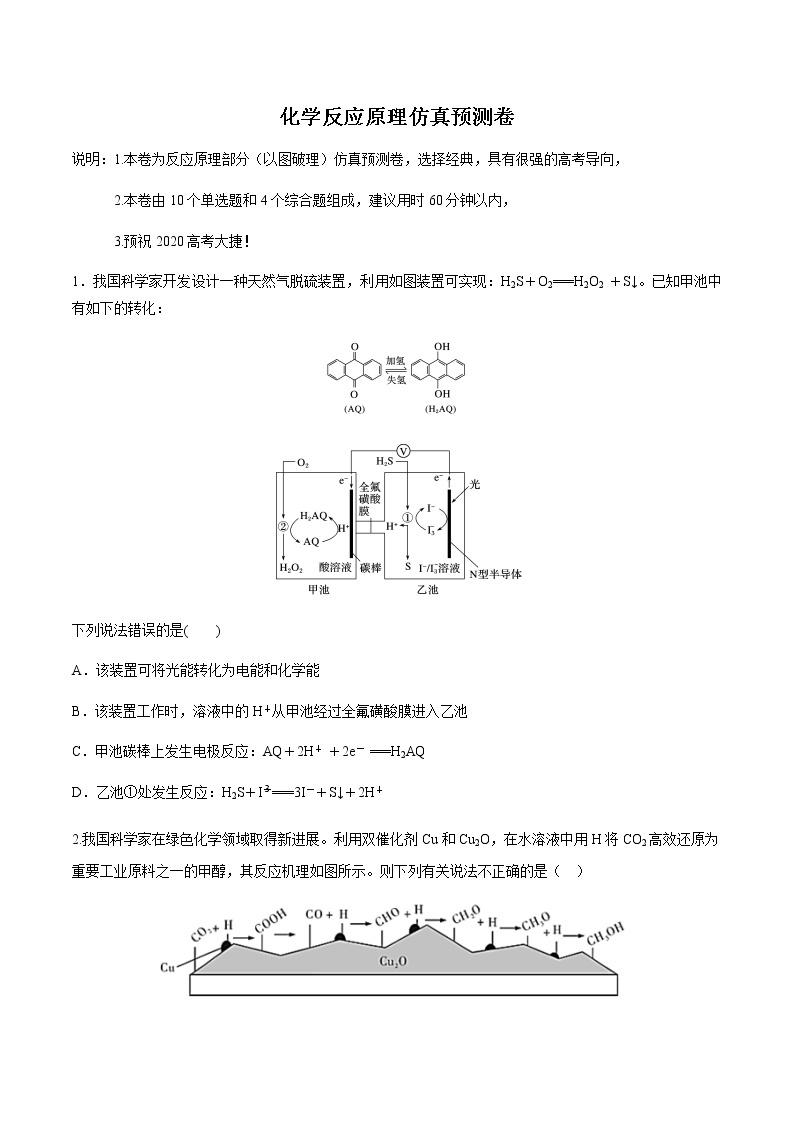
1.我国科学家开发设计一种天然气脱硫装置,利用如图装置可实现:H2S+O2===H2O2 +S↓。已知甲池中有如下的转化:
下列说法错误的是( )
A.该装置可将光能转化为电能和化学能
B.该装置工作时,溶液中的H+从甲池经过全氟磺酸膜进入乙池
C.甲池碳棒上发生电极反应:AQ+2H+ +2e- ===H2AQ
D.乙池①处发生反应:H2S+I===3I-+S↓+2H+
【答案】 B
【解析】 装置是原电池装置,根据图中信息知道是将光能转化为电能和化学能的装置,A正确;原电池中阳离子移向正极,甲池中碳棒是正极,所以氢离子从乙池移向甲池,B错误;甲池中碳棒是正极,该电极上发生得电子的还原反应,即AQ+2H++2e-===H2AQ,C正确;在乙池中,硫化氢失电子生成硫单质,I得电子生成I-,发生的反应为H2S+I===3I-+S↓+2H+,D正确。
2.我国科学家在绿色化学领域取得新进展。利用双催化剂Cu和Cu2O,在水溶液中用H将CO2高效还原为重要工业原料之一的甲醇,其反应机理如图所示。则下列有关说法不正确的是( )
A. CO2生成甲醇是通过多步氧化反应实现的
B. 该催化反应过程中涉及了化学键的形成及断裂
C. 有可能通过调节控制反应条件获得甲醛等有机物
D. 催化剂Cu结合氢原子,催化剂Cu2O结合含碳微粒
【答案】A
【解析】A. CO2生成COOH,为还原反应;CO生成CHO,为还原反应;CHO生成CH2O,为还原反应;CH2O生成CH3O,为还原反应;CH3O生成CH3OH,为还原反应,所以CO2生成甲醇是通过多步还原反应实现,A错误;
B. 该催化过程发生化学反应,所以该反应中有化学键的形成和断裂,B正确;
C. CHO和H生成CH2O,需要Cu2O作催化剂,可以调节控制反应条件获得甲醛等有机物,C正确;
D. 根据图知,催化剂Cu结合H原子,催化剂Cu2O结合含CHO微粒,催化剂Cu结合氢原子,催化剂Cu2O结合含碳微粒,D正确。
3.25 ℃时,向一定浓度的Na2X溶液中滴入盐酸,溶液的pH与离子浓度变化关系如图所示。
已知:H2X是二元弱酸,Y表示或,pY=-lgY。下列叙述不正确的是( )
A.曲线n表示pH与p的变化关系
B.Ka2(H2X)=1.0×10-10.3
C.NaHX溶液中c(H+)>c(OH-)
D.当溶液呈中性时,c(Na+)=c(HX-)+2c(X2-)+c(Cl-)
【答案】 C
【解析】H2X为二元弱酸,以第一步电离为主,则Ka1(H2X)>Ka2(H2X),则pH相同时<,pY=-lgY,则p>p,则m、n分别表示pH与p、p的变化关系。A.根据分析可知,n表示pH与的变化关系,故A正确;B.M点pH=9.3,c(H+)=10-9.3 mol/L,p=-lg=1,则=0.1,所以Ka2(H2X)=×c(H+)=10-9.3×0.1=1.0×10-10.3,故B正确;C.根据B可知HX-的电离平衡常数为1.0×10-10.3,曲线n表示pH与p的变化关系,n点pH=7.4,p=-lg=-1,=10,所以HX-的水解平衡常数Kh==×=1.0×10-7.6>1.0×10-10.3,说明HX-的水解程度大于其电离程度,则NaHX溶液呈碱性,c(H+)<c(OH-),故C错误;D.当溶液呈中性时,c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(HX-)+2c(X2-)+c(Cl-),故D正确;故选C。
4.我国某科研团队设计了一种新型能量存储/转化装置(如下图所示)。闭合K2、断开K1时,制氢并储能;断开K2、闭合K1时,供电。下列说法错误的是
A.制氢时,溶液中K+向Pt电极移动
B.制氢时,X电极反应式为
C.供电时,Zn电极附近溶液的pH降低
D.供电时,装置中的总反应为
【答案】D
【解析】闭合K2、断开K1时,该装置为电解池,Pt电极生成氢气,则Pt电极为阴极,X电极为阳极;断开K2、闭合K1时,该装置为原电池,Zn电极生成Zn2+,为负极,X电极为正极。
A. 制氢时,Pt电极为阴极,电解池中阳离子流向阴极,故A正确;
B. 制氢时,X电极为阳极,失电子发生氧化反应,根据根据化合价可知该过程中Ni(OH)2转化为NiOOH,电极方程式为,故B正确;
C. 供电时,Zn电极为负极,原电池中阴离子流向负极,所以氢氧根流向Zn电极,电极反应为Zn-2e-+4OH-=ZnO22-+2H2O,转移两个电子同时迁移两个OH-,但会消耗4个OH-,说明还消耗了水电离出的氢氧根,所以电极负极pH降低,故C正确;
D. 供电时,正极为NiOOH被还原,而不是水,故D错误。
5.常温下,CH3COOH和NH3·H2O的电离常数均为1.8×10-5。向20 mL浓度均为0.1 mol·
L-1 NaOH和NH3·H2O的混合液中滴加等物质的量浓度的CH3COOH溶液,所得混合液的电导率与加入CH3COOH溶液的体积(V)关系如图所示。下列说法错误的是( )
A.M点:c(Na+)>c(CH3COO-)>c(NH3·H2O)>c(NH)
B.溶液呈中性的点处于N、P之间
C.已知lg 3≈0.5,P点的pH=5
D.P点:3[c(CH3 COO-)+c(CH3COOH)]=2[c(Na+)+c(NH)+c(NH3·H2O)]
【答案】 D
【解析】 M点溶液中溶质为等物质的量浓度的CH3COONa、NH3·H2O,CH3COONa水解,NH3·H2O电离,但CH3COONa水解程度小于NH3·H2O电离程度,c(Na+)>c(CH3COO-)>
c(NH3·H2O)>c(NH),故A正确;体积为20 mL时NaOH和醋酸恰好完全反应,体积为40 mL时醋酸和一水合氨恰好完全反应;醋酸钠溶液呈碱性、醋酸铵溶液呈中性,要使混合溶液呈中性,应该使醋酸稍微过量,所以加入醋酸的体积应该大于40 mL,应该在N、P之间,故B正确;加入醋酸60 mL 时,溶液中的溶质为CH3COONa、CH3COONH4、CH3COOH,且三者的物质的量浓度相等,该溶液为缓冲溶液,溶液的pH=pKa-lg=-lg(1.8×10-5)-lg=6-lg 9=6-2lg 3≈5,故C正确;加入醋酸60 mL时,溶液中的溶质为CH3COONa、CH3COONH4、CH3COOH,且三者的物质的量浓度相等,根据物料守恒,2c(CH3COO-)+2c(CH3COOH)=3c(Na+)+3c(NH)+3c(NH3·H2O),故D错误。
6.硫酸钡是一种比碳酸钡更难溶的物质。常温下-lg c(Ba2+)随-lg c(CO32-)或-lg c(SO42-)的变化趋势如图,下列说法正确的是( )
A. 趋势线A表示硫酸钡
B. 常温下,Ksp(BaCO3)=1×10-11
C. 将碳酸钡和硫酸钡固体置于水中,此时溶液中的=10
D. 在硫酸钡悬浊液中,若要使0.1 mol的硫酸钡完全转化成碳酸钡,则需要加入碳酸钠的物质的量至少为0.1 mol
【答案】C
【解析】根据图示,当-lg c(CO32-)或-lg c(SO42-)=0时,-lg c(Ba2+)为10、11,趋势线A表示的物质的Ksp=1×10-10,趋势线B表示的物质的Ksp=1×10-11。
A.硫酸钡是一种比碳酸钡更难溶的物质,所以Ksp(BaSO4)
C.将碳酸钡和硫酸钡固体置于水中,此时溶液中的===10,故C正确;
D.因为硫酸钡是一种比碳酸钡更难溶的物质,所以在含0.1 mol的硫酸钡的悬浊液中加入0.1 mol的碳酸钠不能完全转化成碳酸钡,故D错误。
7.三元锂电池是以镍、钴、锰为正极材料的新型电池,镍、钴、锰材料可表示为Li1-nNixCoyMnzO2,x+y+z=1,通常简写为Li1-n MO2,Ni、Co、 Mn 三种元素分别显+2、+3、+4价。其充电时总反应为:LiMO2 +C6Li1-nMO2+LinC6,下列说法错误的是
A. 放电时电子从b电极由导线移向a电极
B. 在Li1-nMO2材料中,若x:y:z=2:3:5,则n=0.3
C. 放电时,正极反应为:Li1- nMO2+nLi++ne - =LiMO2
D. 充电时,当转移0.2mol电子,负极材料减重1.4 g
【答案】D
【解析】放电时锂离子从负极移向正极,因此a是电池的正极,b是电池的负极,据此来进行分析即可。
A.放电时,电子从负极流出,经导线流回正极,A项正确;
B.当x:y:z为2:3:5时,这三种金属离子所带正电荷一共为价,而氧元素一共带-4价,因此一共有0.7个,即,B项正确;
C.放电时,从负极移向正极,嵌入正极材料中,且正极材料得到电子,C项正确;
D.充电时,锂离子从正极“脱嵌”移动到阴极,因此负极材料的质量是增加的,D项错误。
8.常温下联氨(N2H4)的水溶液中存在有:①N2H4+ H2ON2H5++OH- K1②N2H5+ +H2ON2H6++OH- K2。该溶液中的微粒的物质的量分数(X)随-lg c(OH-)变化的关系如图所示。则下列叙述不正确的是( )
A. 图中Ⅲ对应的微粒为N2H62+
B. 若C点为N2H5Cl溶液,则存在:c(Cl-)>c(N2H5+ )+2c(N2H62+ )
C. 将10mL0.1mol/L的联氨溶液与5mL0.1mol/L.的盐酸溶液混合后,所得溶液pH等于8
D. 常温下羟胺(NH2OH)的Kb=10-10,将少量联氨水溶液加入到足量NH3OHCl溶液中,发生的反应为N2H4+NH3OH+=N2H5+ +NH2OH
【答案】C
【解析】横坐标为c(OH-)的负对数值,从左到右c(OH-)越来越小,越能促进N2H4的电离,纵坐标为微粒的物质的量分数,已知联氨的两步电离分别为:N2H4+H2O⇌N2H5++OH-,N2H5++H2O⇌N2H62++OH-,故曲线Ⅰ为N2H4、Ⅱ为N2H5+、Ⅲ为N2H62+。
A. 图中Ⅲ对应c(OH-)最小,N2H4的电离平衡正向移动程度大,图中Ⅲ对应的微粒为N2H62+,A正确;
B. N2H5Cl溶液中存在电荷守恒,即c(OH-)+c(Cl-)= c(H+)+c(N2H5+ )+2c(N2H62+ ),从图象可知,C点c(H+)> c(OH-),故c(Cl-)>c(N2H5+ )+2c(N2H62+ ),B正确;
C. 10mL0.1mol/L的联氨溶液与5mL0.1mol/L的盐酸溶液混合后,联氨过量,发生反应方程式为:N2H4+HCl==N2H5Cl,N2H5+水解:N2H5++H2ON2H4·H2O+H+,所得溶液显酸性,pH<7,C错误;
D. 常温下,NH3OHCl溶液中,NH3OH+水解:NH3OH++ H2O NH2OH·H2O+ H+,显酸性,联氨电离:N2H4+ H2ON2H5++OH-,显碱性,所以NH3OHCl溶液中加入少量联氨水溶液,发生反应为:N2H4+NH3OH+=N2H5+ +NH2OH,D正确。
9.中科院长春应化所张新波团队提出了一种独特的锂-氮电池(Li-N2),该电池在放电过程中消耗氮气,充电过程中释放氮气,实现氮气的循环,并对外提供电能。该电池在充电时发生反应:2Li3NN2↑+6Li。现以该电池为电源进行如图所示实验,下列说法正确的是( )
A. 乙电极上的反应为2Li3N-6e-=N2↑+6Li+
B. 充电过程中Li+由甲电极迁移向乙电极,并在多孔碳布表面生成Li3N
C. 电极“石墨a”和m、n处均可能有铜析出
D. 锂氮电池为绿色固氮提供了一种可能
【答案】D
【解析】放电时,该原电池中锂失电子,作负极,发生氧化反应,氮气得电子,作正极,发生还原反应,故甲为负极,石墨b为阴极,乙为正极,石墨a为阳极。
【详解】A. 放电时,该原电池中锂失电子作负极,氮气得电子作正极,故乙电极是正极,发生反应:N2↑+6Li++6e−=2Li3N,A错误;
B. 充电过程是电解池原理,Li+由乙电极移向甲电极,多孔碳布表面Li3N分解生成N2和Li+,B错误;
C. A是阳极,电解硫酸铜溶液,在阳极:2H2O - 4e- =4H++2O2↑,产生氧气,C错误;
D. 反应:N2+6Li=2Li3N属于氮的固定,锂、氮电池为绿色固氮提供了一种可能,D正确。
10.常温常压下,将NH3缓慢通入饱和食盐水中至饱和,然后向所得溶液中缓慢通入CO2,整个实验进程中溶液的pH随通入气体体积的变化曲线如图所示(实验中不考虑氨水的挥发)。下列叙述不正确的是
A. 由a点到b点的过程中,溶液中增大
B. 由图可知(NH4)2CO3溶液显碱性、NH4Cl溶液显酸性
C. c点所示溶液中,c(NH4+)>c(CO32-)>c(OH-)>c(H+)
D. d点所示溶液中,c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
【答案】D
【解析】A.,由a点到b点,溶液pH增大,c(OH-)增大,由于温度不变,Ka不变,因此增大,A正确;
B. b点表示NH3的量达到最大值,c点时,溶液中的一水合氨和二氧化碳恰好完全反应,溶质为碳酸铵,由图可知(NH4)2CO3溶液显碱性、NH4Cl溶液显酸性,B正确;
C.c点所示溶液中,溶质为碳酸铵,溶液呈碱性,因此离子浓度大小为:c(NH4+)>c(CO32-)>c(OH-)>c(H+),C正确;
D. d点所示溶液中,溶质为碳酸氢铵,根据质子守恒可知,c(NH4+)+c(NH3·H2O)+ c(NH3)=c(HCO3-)+c(CO32-)+c(H2CO3),D错误。
11.氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。研究氧化亚氮分解对环境保护有重要意义。
(1)污水生物脱氮过程中,在异养微生物催化下,硝酸铵可分解为N2O和另一种产物,该反应的化学方程式为________。
(2)已知反应2N2O(g)=2N2(g) + O2(g)ΔH= –163 kJ·mol-1,1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收945 kJ、498 kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为________ kJ。
(3)在一定温度下的恒容容器中,反应2N2O(g)=2N2(g) + O2(g)的部分实验数据如下:
反应时间/min
0
10
20
30
40
50
60
70
80
90
100
C(N2O)/mol/L
0.100
0.090
0.080
0.070
0.060
0.050
0.040
0.030
0.020
0.010
0.010
①在0~20min时段,反应速率v(N2O)为________ mol·L-1·min-1。
②若N2O起始浓度c0为0.150 mol·L-1,则反应至30min时N2O的转化率α =__________。比较不同起始浓度时N2O的分解速率:v(c0=0.150 mol·L-1) ________ v(c0=0.100 mol·L-1)(填“>”、“=”或“<”)。
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1________T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1 min时,体系压强p =________(用p0表示)。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g) 2I(g) (快反应)
第二步 I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是________(填标号)。
A.N2O分解反应中,k(含碘)> k(无碘) B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大 D.I2浓度与N2O分解速率无关
【答案】 (1). NH4NO3N2O+2H2O (2). 1112.5 (3). 1.0×10-3 (4). 20.0%
(5). = (6). > (7). 1.25p0 (8). AC
【解析】【详解】(1)硝酸铵可分解为N2O和另一种产物,根据质量守恒定律,可判断另一产物为H2O,反应的化学方程式为NH4NO3N2O+2H2O;
(2)正反应为放热反应,化学键生成时放出的能量-化学键断裂时需吸收的能量=反应放出的能量,设1molN2O(g)分子中化学键断裂时需要吸收的能量为xkJ,则945 kJ×2+498 kJ-2x kJ =163 kJ,解得x=1112.5,
(3)①在0~20min时段,v(N2O)===1.0×10-3 mol·L-1·min-1;
②从表中数据分析可知,每个时间段内,△c(N2O)相等,即v(N2O)相等,与起始浓度无关,所以不同起始浓度时N2O的分解速率:v(c0=0.150 mol·L-1) = v(c0=0.100 mol·L-1);若N2O起始浓度c0为0.150 mol·L-1,则反应至30min时N2O转化的浓度为0.010mol/L×3=0.030mol/L,则转化率α=×100%=20.0%;
③温度越高反应越快,半衰期越短,由图可知,压强一定时,T1时半衰期小于T2,则T1>T2;其他条件相同时,压强之比等于物质的量之比,由反应式2N2O(g)=2N2(g) + O2(g)可知,设起始时有2molN2O,当有一半分解时,生成1molN2和0.5molO2,还剩余1molN2O,此时混合气体总物质的量变为(1mol+1mol+0.5mol)=2.5mol,则体系压强p =P0=1.25p0;
(4)化学反应速率快慢取决于反应速率最慢的反应,即第二步反应,该反应的总反应为2N2O(g)=2N2(g) + O2(g),碘在反应中起催化剂作用,
A.碘在反应中起催化剂作用,N2O分解反应中,k(含碘)> k(无碘),故A正确;
B.第二步反应为慢反应,对总反应速率起决定作用,故B错误;
C.第二步反应为慢反应,第三步反应为快反应,第二步活化能比第三步大,故C正确;
D.由含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5可知, N2O分解速率与[c(I2)]0.5成正比,故D错误。答案选AC。
12.(1)已知反应2HI(g)=H2(g)+ I2(g)的△H=+11kJ·mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___kJ。
(2)已知某密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。
①该反应△H__________ 0(填“>”或“<”)
②若T1、T2时的平衡常数分别为K1、K2,则K1_______K2(填“>”、“<”或“=”)。
③T3时在某刚性容器中按1:2投入CO(g)和H2O(g),达到平衡后测得CO的转化率为75%,则T3时平衡常数K3=____________。
(3)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应: 2MoS2(s)+7O2(g) 2MoO3(s)+4SO2(g) ΔH。
测得氧气的平衡转化率与起始压强、温度的关系如图所示:
①p1、p2、p3的大小:_________。
②若初始时通入7.0 mol O2,p2为7.0 kPa,则A点平衡常数Kp=________(用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,写出计算式即可)。
(4)中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
助剂
CO2转化率(%)
各产物在所有产物中的占比(%)
C2H4
C3H6
其他
Na
42.5
35.9
39.6
24.5
K
27.2
75.6
22.8
1.6
Cu
9.8
80.7
12.5
6.8
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加_______助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是_____;
②下列说法正确的是______;
a 第ⅰ步所反应为:CO2+H2CO+H2O
b 第ⅰ步反应的活化能低于第ⅱ步
c 催化剂助剂主要在低聚反应、异构化反应环节起作用
d Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
e 添加不同助剂后,反应的平衡常数各不相同
【答案】(1)299 (2) < > 1.8 (3) p1>p2>p3 211/77(kPa)-3
(4)K 降低生成乙烯的反应所需要的活化能,加快乙烯生成速率,而对其他副反应几乎无影响 ac
【解析】(1)设1molHI(g)分子中化学键断裂时需吸收的能量为x kJ,则:2x kJ-436kJ-151kJ=11kJ,解得x=299,
(2)①由图可知,温度越高平衡时c(CO)越大,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应进行,故正反应是放热反应,即该反应△H<0;
②该反应正反应是放热反应,升高温度平衡向逆反应移动,化学平衡常数减小,故
则K1>K2;。
③T3时在某刚性容器中按1:2投入CO(g)和H2O(g),达到平衡后测得CO的转化率为75%,
K= =1.8,则T3时平衡常数K3=1.8。
(3)①根据图知,压强一定时,升高温度氧气的转化率降低,平衡逆向移动,则△H<0;该反应的正反应是一个反应前后气体体积减小的可逆反应,增大压强平衡正向移动,氧气转化率增大,所以压强:p1>p2>p3;
②若初始时通入7.0molO2,P2为7.0kPa,A点氧气转化率为50%,则A点n(O2)=7mol×(1-50%)=3.5mol,生成n(SO2)= =2mol,恒温恒容条件下气体压强之比等于物质的量之比,所以A点压强=×7.0kPa=5.5kPa,P(O2)=×5.5kPa=3.5kPa,P(SO2)=(5.5-3.5)kPa=2kPa,则A点平衡常数Kp=(kPa)-3 。
(4)①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加K助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是降低生成乙烯的反应所需要的活化能,加快乙烯生成速率,而对其他副反应几乎无影响;
②①由表中数据可知,Na的其他副反应占比大,Cu的CO2转化率低,兼顾乙烯的产率、CO2转化率和对副反应的影响,选择添加K助剂效果最好,不仅能提高单位时间内乙烯产量,并且其他副反应占比少,根本原因是降低反应的活化能、加快乙烯生成速率。
②a.由催化CO2加氢合成低碳烯烃反应可知,第ⅰ步所反应为:CO2+H2CO+H2O,故a正确;
b.第ⅰ步反应是慢反应,第ⅱ步是快反应,反应的活化能越低,反应速率越快,所以第ⅰ步反应的活化能高于第ⅱ步,故b错误;
c.助剂可改变反应的选择性,所以催化剂助剂主要在低聚反应、异构化反应环节起作用,故c正确;
d.催化剂不能改变平衡状态,不能改变焓变△H,故d错误;
e.反应的平衡常数只与温度有关,不同助剂能改变反应历程,但不能改变反应的起始状态、不能改变反应温度,所以反应的平衡常数不变,故e错误。
13.I.亚硫酸钠的氧化反应:2Na2SO3 (aq) +O2(aq)=2Na2SO4(aq) ∆H=x kJ/mol。其反应速率受溶解氧浓度影响,分为富氧区和贫氧区两个阶段。
(1)已知O2(g) O2(aq) ∆H=y kJ/mol,Na2SO3 溶液与O2(g)反应的热化学方程式为___________________。
(2)291.5 K时,1.0 L溶液中Na2SO3初始量分别为4、6、8、12 mmol,溶解氧浓度初始值为9.60 mg/L,每5 s记录溶解氧浓度,实验结果如图所示。当Na2SO3初始量为12 mmol,经过20 s溶解氧浓度降为6.40 mg/L,则0~20s内Na2SO3的平均反应速率为_______mol/(L·s)。
(3)为确定贫氧区速率方程v=k·ca(SO32-)·cb(O2)中的a、b的值(取整数),分析实验数据。
c(Na2SO3)×103
3.65
5.65
7.65
1165
v×106
10.2
24.4
44.7
103.6
①当溶解氧浓度为4.0 mg/L时,c(SO32-)与速率数值关系如表(甲)所示,则a=____。
②当溶解氧浓度小于4.0mg/L时,图中曲线皆为直线,Na2SO3氧化速率与溶解氧浓度无关,则b=_______。
(4)两个阶段不同温度的速率常数之比如表(乙)所示。已知,R为常数。Ea(富氧区)_____ (填“>”或“<”)Ea(贫氧区)。
反应阶段
速率方程
富氧区
v=k·c (SO32-)·c (O2)
1.47
贫氧区
v=k·ca (SO32-)·cb(O2)
2.59
II. (5)在容积固定的密闭容器中,起始充入0.2 mol SO2和0.1 mol O2,反应体系起始总压强0.1MPa。反应在一定温度下达到平衡时SO2的转化率为90%。该反应的压强平衡常数Kp=________ ( 分压=总压×物质的量分数)(写单位)。
(6)利用原电池原理,也可用SO2和O2来制备硫酸,该电池用多孔材料作电极。请写出该电池负极反应式_________________________。
【答案】(1). 2Na2SO3(aq) +O2(g)=2Na2SO4(aq) ∆H=(x+y)kJ/mol (2). 1×10-5 (3). 2 (4). 0 (5). < (6). 24300MPa-1 (7).
【解析】(1) 2Na2SO3(aq) +O2 (aq)=2Na2SO4(aq) ∆H=x kJ/mol ①;O2(g) O2(aq) ∆H=y kJ/mol②;
将方程式①+②得2Na2SO3 (aq) +O2 (g)=2Na2SO4(aq) ∆H=(x+y)kJ/mol;
(2) 0~20s内溶解氧浓度变化量=(9.60-6.40)mg/L=3.20mg/L=3.20×10-3g/L,则△c(O2)= =10-4mol/L,根据方程式得△c(Na2SO3)=2△c(O2)=2×10-4mol/L,0~20s内Na2SO3的平均反应速率v= =1×10-5mol•L-1•s-1;
(3)①当溶解氧浓度为4.0 mg/L时,c(SO32-)与速率数值关系如表(甲)所示,v1:v2=c1a(SO32-):c2a(SO32-),,解得a=2;
②当溶解氧浓度小于4.0mg•L-1时,图中曲线皆为直线,说明该方程为一次函数,k为常数,v与c(SO32-)有关,溶解氧浓度对v无影响,所以b=0;
(4) ln随着Ea的增大而增大,富氧区的ln较小,故Ea(富氧区)<Ea(贫氧区);
(5)
设平衡时的总压强P, ,P=0.07 MPa,Kp= 24300MPa-1;
(6)SO2和O2来制备硫酸,硫元素化合价升高,负极为SO2失电子生成硫酸根离子,反应的离子方程式是。
14.聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为:
已知v正= k正χ(CH3COOCH3)·χ(C6H13OH),v逆= k逆χ(CH3COO C6H13)·χ(CH3OH),
其中v正、v逆 为正、逆反应速率,k正、k逆为速率常数,χ为各组分的物质的量分数。
(1)反应开始时,已醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如下图所示。
该醇解反应的ΔH_________0(填>或<)。348K时,以物质的量分数表示的化学平衡常数Kx=____________(保留2位有效数字)。
在曲线①、②、③中,k正-k逆值最大的曲线是___________________;A、B、C、D四点中,v正最大的是_____________,v逆最大的是___________________。
(2)343K时,己醇和乙酸甲酯按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比_____________时,乙酸甲酯转化率最大;与按1:2投料相比,按2:1投料时化学平衡常数Kx____________(填增大、减小或不变)。
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是______。
a. 参与了醇解反应,但并不改变反应历程 b. 使k正和k逆增大相同倍数
c. 降低了醇解反应的活化能 d. 提高乙酸甲酯的平衡转化率
【答案】(1)> 3.2 ① A C (2)2:1 不变 (3)bc
【解析】(1)根据图像,①的速率最快,说明①对应的是最高温度348K,温度升高,平衡时转化率增大,说明正向是吸热的,所以ΔH>0。348K时,设初始投入为1mol,则有:
起始: 1 1 0 0
转化: 0.64 0.64 0.64 0.64
平衡: 0.36 0.36 0.64 0.64
带入平衡常数表达式:Kx=χ(CH3COOC6H13) ·χ(CH3OH) / [χ(CH3COOCH3) ·χ(C6H13OH)] = 0.32×0.32 / (0.18×0.18) = 3.2
k正、k逆是温度的函数,根据平衡移动的规律,k正受温度影响更大,因此温度升高,k正增大的程度大于k逆,因此,k正-k逆值最大的曲线是①。根据v正= k正χ(CH3COOCH3)·χ(C6H13OH),v逆= k逆χ(CH3COO C6H13)·χ(CH3OH),A点χ(CH3COOCH3)·χ(C6H13OH)大,温度高,因此A点v正最大,C点χ(CH3COO C6H13)·χ(CH3OH)大且温度高,因此C点v逆最大。
(2)增大己醇的投入量,可以增大乙酸甲酯转化率,因此,2:1时乙酸甲酯转化率最大。化学平衡常数Kx只与温度有关,因此不变。
(3)催化剂参与了醇解反应,改变了反应历程,a错误;催化剂不影响化学平衡,说明催化剂使k正和k逆增大相同倍数,b正确;催化剂能够降低反应的活化能,c正确;催化剂不改变化学平衡,d错误。因此,选择bc。








