
江西省临川二中临川二中实验学校2020届高三上学期期中考试化学试题
展开
高三年级化学试题
可能用到的相对原子质量: N:14 O:16 Na:23
一、选择题(每题3分,共48分,每题只有一个选项符合题意。)
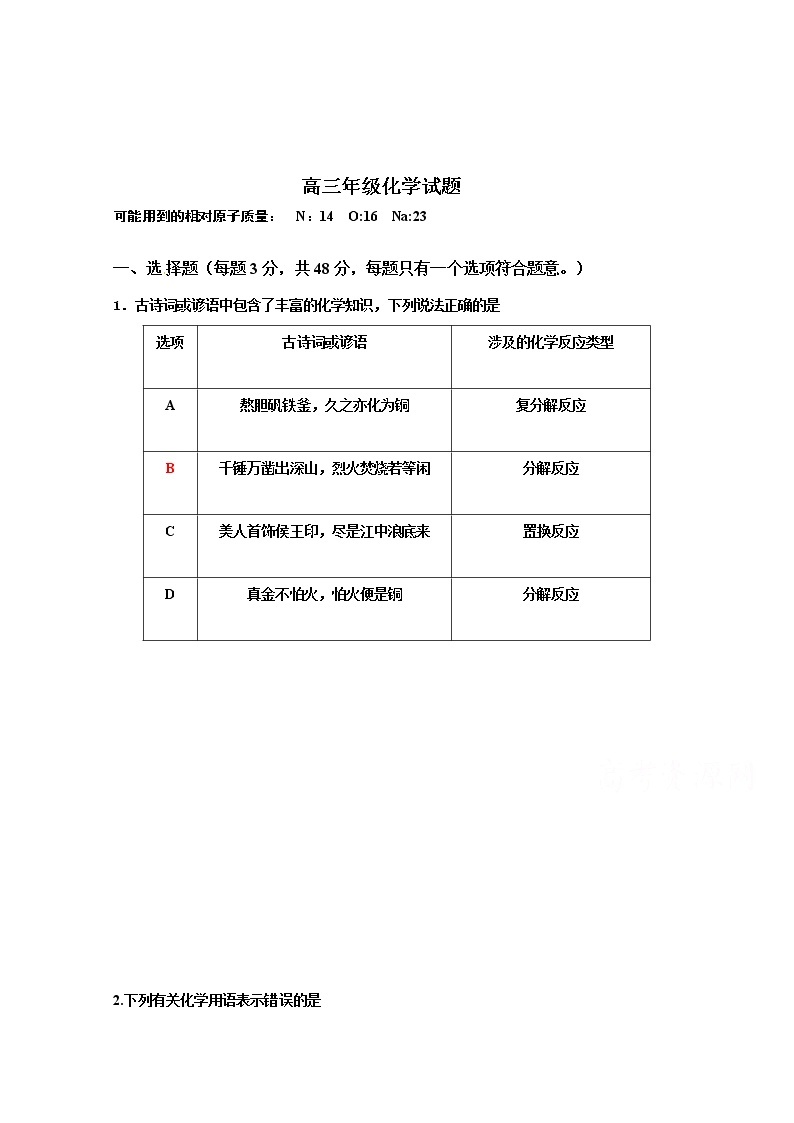
1.古诗词或谚语中包含了丰富的化学知识,下列说法正确的是[来源:学|科|网Z|X|X|K]
选项
| 古诗词或谚语 | 涉及的化学反应类型 |
A | 熬胆矾铁釜,久之亦化为铜
| 复分解反应
|
B | 千锤万凿出深山,烈火焚烧若等闲
| 分解反应
|
C | 美人首饰侯王印,尽是江中浪底来
| 置换反应
|
D | 真金不怕火,怕火便是铜
| 分解反应
|
2.下列有关化学用语表示错误的是
A. 冰晶石的化学式: Na3AlF5 B. 中子数为13的铝原子: 2613Al
C. CaF2的电子式: D. 氯离子的结构示意图:
3.下列变化中,前者是物理变化,后者是化学变化,且都有明显颜色变化的是
A.打开盛装NO的集气瓶;冷却NO2气体
B.用冰水混合物冷却SO3气体;加热氯化铵晶体
C.木炭吸附NO2气体;将氯气通入品红溶液中
D.向品红溶液中加入Na2O2 ;向FeCl3溶液中滴加KSCN溶液
4.图表示的一些物质或概念间的从属关系中正确的是
| X | Y | Z |
A.[来源:学科网ZXXK] | 酸 | 含氧酸 | 纯净物 |
B. | 电解质 | 盐 | 化合物 |
C. | 胶体 | 溶液 | 分散系 |
D. | 碱性氧化物 | 氧化物 | 化合物 |
5.某款香水中的香氛主要由以下三种化合物构成,下列说法正确的是
A.月桂烯分子中所有原子可能共平面[来源:学#科#网]
B.柠檬醛和香叶醇是同分异构体
C.香叶醇能发生加成反应、氧化反应、酯化反应
D.三种有机物的一氯代物均有7种(不考虑立体异构)
6.设NA表示阿伏加德罗常数的值,下列叙述正确的是
A.1 mol NH3含有的电子数为10NA
B.标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA
C.1 L 0.1 mol·L-1氨水含有0.1NA个OH-
D.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
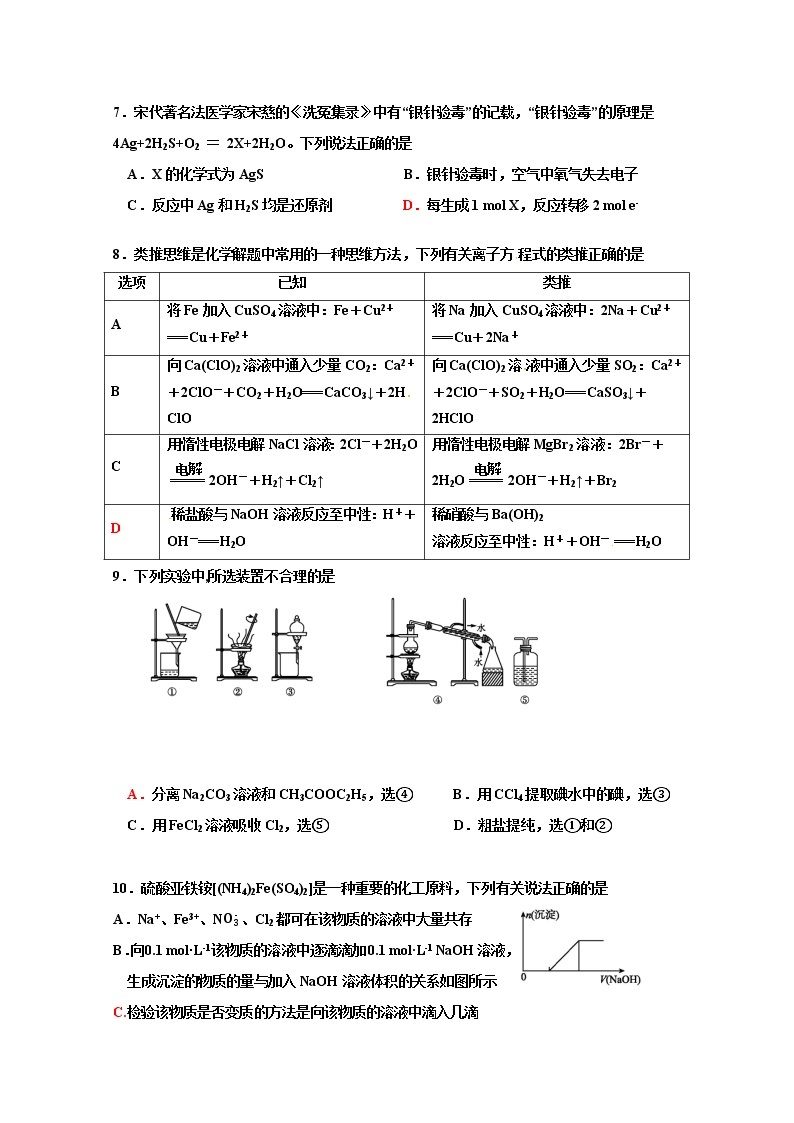
7.宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2 = 2X+2H2O。下列说法正确的是
A.X的化学式为AgS B.银针验毒时,空气中氧气失去电子
C.反应中Ag和H2S均是还原剂 D.每生成1 mol X,反应转移2 mol e-
8.类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是
选项 | 已知 | 类推 |
A | 将Fe加入CuSO4溶液中:Fe+Cu2+===Cu+Fe2+ | 将Na加入CuSO4溶液中:2Na+Cu2+===Cu+2Na+ |
B | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO |
C | 用惰性电极电解NaCl溶液:2Cl-+2H2O2OH-+H2↑+Cl2↑ | 用惰性电极电解MgBr2溶液:2Br-+2H2O2OH-+H2↑+Br2 |
D | 稀盐酸与NaOH溶液反应至中性:H++OH-===H2O | 稀硝酸与Ba(OH)2 溶液反应至中性:H++OH-===H2O |
9.下列实验中,所选装置不合理的是
A.分离Na2CO3溶液和CH3COOC2H5,选④ B.用CCl4提取碘水中的碘,选③
C.用FeCl2溶液吸收Cl2,选⑤ D.粗盐提纯,选①和②
10.硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是
A.Na+、Fe3+、N、Cl2都可在该物质的溶液中大量共存
B.向0.1 mol·L-1该物质的溶液中逐滴滴加0.1 mol·L-1 NaOH溶液,
生成沉淀的物质的量与加入NaOH溶液体积的关系如图所示
C.检验该物质是否变质的方法是向该物质的溶液中滴入几滴
KSCN溶液,观察溶液是否变红色
D.向该物质的溶液中滴加Ba(OH)2溶液,恰好使S完全沉淀的离子方程式为
Fe2++2S+2Ba2++2OH-2BaSO4↓+Fe(OH)2↓
11.短周期元素X、Y、Z、W的原子序数依次增大,q是X的单质,m为黄绿色气体,p、s、r是由这些元素构成的化合物,s为常见的液体,
将室温下pH=13的r溶液稀释10倍,测得pH=12。
m、p、s、r之间有如图所示转化关系。
下列说法中正确的是
A.气态氢化物的沸点:Y<W
B.元素X与Y、Z、W形成的化学键类型相同
C.简单阴离子的还原性:X<Y
D.Z和W的最高价氧化物对应的水化物可反应生成正盐
12.已知电导率越大导电能力越强。常温下用0.100 mol·L-1 NaOH溶液分别滴定 10.00 mL 浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法正确的是
A.曲线①代表滴定盐酸的曲线
B.滴定醋酸的过程应该选择甲基橙作为指示剂
C.a、b、c三点溶液中水的电离程度:c>a>b
D. b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+ c(CH3COOH)
硫酸 化学纯(CP) (500 mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84 g/cm3 质量分数:98% |
13.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。下列说法正确的是
A.该硫酸中溶质的物质的量浓度为9.2 mol/L
B.1 mol Zn与足量的该硫酸反应产生2 g氢气
C.配制250 mL 4.6 mol/L的稀硫酸需取该硫酸62.5 mL
D.等质量的水与该硫酸混合后所得溶液中溶质的物质的量浓度大于9.2 mol/L
14.ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是
A.该装置可以在高温下工作
B.X、Y依次为阳离子、阴离子选择性交换膜
C.负极反应为CH3COO− +2H2O− 8e− =2CO2↑+7H+
D.该装置工作时,电能转化为化学能[来源:学科网ZXXK]
15. 甲、乙两个密闭容器中均发生反应:C(s)+2H2O(g)CO2(g)+2H2(g) ΔH>0。有关实验数据如下表:
容器[来源:学|科|网] | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol[来源:学.科.网Z.X.X.K] | 平衡 常数 | |
C(s) | H2O(g) | H2(g) | ||||
甲 | 2 | T1 | 2.0 | 4.0 | 3.2 | K1 |
乙 | 1 | T2 | 1.0 | 2.0 | 1.2 | K2 |
下列说法正确的是
A.K1=12.8 B.T1<T2
C.T1 ℃时向甲容器中再充入0.1 mol H2O(g),则平衡正向移动,CO2(g)的体积分数增大
D.若在T2℃下,向2 L密闭容器中充入1.0 mol CO2和2.0 mol H2 ,达平衡时,CO2的
转化率等于40%
16. 某澄清透明溶液中,可能大量存在下列离子中的若干种:H+、NH4+、K+、Mg2+、Cu2+、Br-、AlO2-、Cl-、SO42-、CO32-。现进行如下实验:
①用试管取少量溶液,逐滴加入稀盐酸至过量,溶液先变浑浊后又变澄清,有无色气体放出,将溶液分为3份。②在第1份溶液中逐滴加入NaOH溶液至过量,溶液先变浑浊后又变澄清。加热溶液,将湿润的红色石蕊试纸置于试管口,未见明显现象。③在第2份溶液中加入新制的氯水和CCl4,振荡后静置,下层溶液显橙红色。下列推断正确的是
A.溶液中一定有K+、Br-、AlO2-、CO32- B. 溶液中一定没有NH4+、Mg2+、Cu2+、C1-
C.不能确定溶液中是否有K+、C1-、SO42-
D.向第3份溶液中滴加硝酸酸化的硝酸银溶液可确认是否有Cl-
第II卷(非选择题 共52分)
17.(13分)作为食品添加剂时,亚硝酸钠(NaNO2)可以增加肉类的鲜度,抑制微生物,保持肉制品的结构和营养价值;但是过量摄入会导致中毒。某实验小组设计实验制备亚硝酸钠并进行含量测定。
I.NaNO2制备
实验室以木炭、浓硝酸、Na2O2为主要原料按照如图所示装置制各亚硝酸钠(加热装置及部分夹持装置已略去),反应原理为: 2NO+Na2O2=2NaNO2
回答下列问题:
(1)连接好装置之后,下一步实验操作是__________________________。
(2)B装置中铜的作用是__________________________________________。
(3)E装置用于尾气处理,E中反应的离子方程式为___________________________
(4)实验结束阶段,熄灭酒精灯之后继续通入N2直至装置冷却。此时通入N2的目的是_____________________________________________________。
Ⅱ.含量的测定
查阅资料可知:酸性KMnO4溶液可将NO2-氧化为NO3-,MnO-4还原成Mn2+。
(5)溶液配制:称取装置D中反应后的固体4.000g,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,全部转移至250mL的_________中,加蒸馏水至_____________。
滴定:取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行淌定,实验所得数据如下表所示:
(6)第4组实验数据出现异常,造成这种异常的原因可能是
A.锥形瓶洗净后未干燥 B.滴定终点仰视读数
C.滴定终点俯视读数 D.酸式滴定管用蒸馏水洗浄后未用标准液润洗
(7)根据表中数据,计算所得固体中亚硝酸钠的质量分数 ______%(保留2位小数)。
18. (11分)某科研小组利用工业废料(主要成分为NiO,含有少量Al2O3、FeO、CuO、BaO)回收NiO,并制备其他工业产品的工艺流程如图所示:
已知:①溶液中离子浓度小于等于1.0×10-5 mol·L-1时,认为该离子沉淀完全。
②25 ℃时,部分难溶物的溶度积常数如下表所示:
难溶物 | CuS | Al(OH)3 | Ni(OH)2 | Fe(OH)3 | Fe(OH)2 |
溶度积常数(Ksp) | 6.3×10-36 | 1.3×10-33 | 2.0×10-15 | 4.0×10-38 | 1.8×10-16 |
请回答下列问题:
(1)H2S的电子式为 。
(2)“酸浸”时,Ni的浸出率与温度的关系如图所示。温度高于70 ℃,Ni的浸出率降低的主要原因为 。
(3)“沉淀1”的主要成分为 (填化学式)。
(4)“滤液1”中通入H2S的作用为 。
(5)“转化”过程中,发生反应的主要离子方程式为 。
(6)25 ℃时,“调节pH2”使沉淀3中金属阳离子沉淀完全后,所得溶液中的c(H+)最大为 (保留三位有效数字,已知 ≈ 1.4)。
(7)“操作Ⅰ”主要包括蒸发浓缩、 、过滤、洗涤、干燥。
(8)NiO可通过铝热反应冶炼Ni,该反应的化学方程式为 。
19.(14分)氮及其化合物对环境具有显著影响。
(1)已知汽车气缸中氮及其化合物发生如下反应:
△H=+180 kJ·mol-1
△H=+68 kJ·mol-1
则 △H=__________ kJ·mol-1
(2)对于反应的反应历程如下:
第一步: 第二步:
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v正=k1正·c2(NO),
υ逆=k1逆·c(N2O2),k1正、k1逆为速率常数,仅受温度影响。下列叙述正确的是______(填标号)
A. 整个反应的速率由第一步反应速率决定
B. 同一温度下,平衡时第一步反应k1正/k1逆越大,反应正向程度越大
C. 第二步反应速率低,因而转化率也低
D. 第二步反应的活化能比第一步反应的活化能高
(3)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为: △H<0。某温度下,向10 L密闭容器中分别充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/kPa | 75 | 73.4 | 71.95 | 707 | 69.7 | 68.75 | 68.75 |
在此温度下,反应的平衡常数Kp=___________kPa-1(Kp为以分压表示的平衡常数);若降低温度,再次平衡后,与原平衡相比体系压强( P总)减小的原因是____________________。
(4)汽车排气管装有的三元催化装置,可以消除CO、NO等的污染,反应机理如下
I: NO+Pt(s)=NO(*) [Pt(s)表示催化剂,NO(*)表示吸附态NO,下同]
Ⅱ:CO+Pt(s)=CO(*) III:NO(*)=N(*)+O(*)
IV:CO(*)+O(*)=CO2+2Pt(s) V:N(*)+N(*)=N2+2 Pt(s)
VI:NO(*)+N(*)=N2O+2 Pt(s)
尾气中反应物及生成物浓度随温度的变化关系如图。
①330℃以下的低温区发生的主要反应的化学方程式是__________________________。
②反应V的活化能 _____反应VI的活化能(填“<”、“>”或“=”),理由是_________________________________________________________。
20.(14分)氨甲环酸(G),别名止血环酸,是一种已被广泛使用半个世纪的止血药,它的一种合成路线如下(部分反应条件和试剂略):
回答下列问题:
(1)A的结构简式是 。C的化学名称是 。
(2)②的反应类型是 。E中不含N原子的官能团名称为 。
(3)氨甲环酸(G)的分子式为 。
(4)写出满足以下条件的所有E的同分异构体的结构简式: 。
a.含苯环 b.含硝基 c.核磁共振氢谱有三组峰
(5)写出以和为原料,制备医药中间体的合成路线:
(无机试剂任选)。
高三期中考试化学试题答案
第一卷答题卡
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
选项 | B | A | C | D | C | A | D | D | A | C | D | D | C | C | A | A |
第
卷(非选择题 共52分)
17.(13分)(1). 检查(装置)气密性
(2). Cu可以和NO2和H2O反应生成的HNO3反应,提高NO的产率
(3). 5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O
(4). 将装置中的NO全部排入E装置吸收,并防止倒吸
(5). 容量瓶 刻度线 (6). B、D (7). 94.88
18. (11分) (1) (2)温度升高,Ni2+的水解程度增大
(3)BaSO4 (4)将Cu2+转化为CuS沉淀分离出去
(5)2Fe2+ +ClO-+2H+=2Fe3++Cl-+H2O (6)7.14×10-10 mol·L-1
(7)降温结晶(或冷却结晶) (8)3NiO+2AlAl2O3 + 3Ni
19. (14分) (1). -112 (2). BD (3). 0.04
(4). 降低温度,由于反应放热,所以平衡向正反应方向移动,容器中气体分子数减少,总压强也减小;若温度降低,体积不变,根据阿伏加德罗定律,总压强减小
(5). CO+2NOCO2+N2O (6). >
(7). 生成N2O的选择性高,说明反应VI的化学反应速率大,该反应的活化能就小
20.(14分)(1)CH2=CH-CH=CH2 (2)2-氯-1,3丁二烯
(3)消去反应 (4)碳碳双键、酯基
(5)C8H15NO2
(6)、
(7)








