





高中化学人教版 (2019)必修 第二册化学反应与能量单元综合与测试复习ppt课件
展开1.能从化学反应限度和快慢的角度解释生产、生活中简单的化学现象。2.能描述化学平衡状态,判断化学反应是否达到平衡。3.能运用变量控制的方法探究化学反应速率的影响因素,并初步解释化学实验和化工生产中反应条件的选择问题。4.能举出化学能转化为电能的实例,能辨识简单原电池的构成要素,并能分析简单原电池的工作原理。5.能从物质及能量变化的角度评价燃料的使用价值。能举例说明化学电源对提高生活质量的重要意义。
氢氧化钡和氯化铵的反应;盐酸和碳酸氢钠的反应;碳与二氧化碳的化合反;
金属和酸的反应;木炭、氢气、甲烷的燃烧反应;氢气和氯气的化合反;中和反应
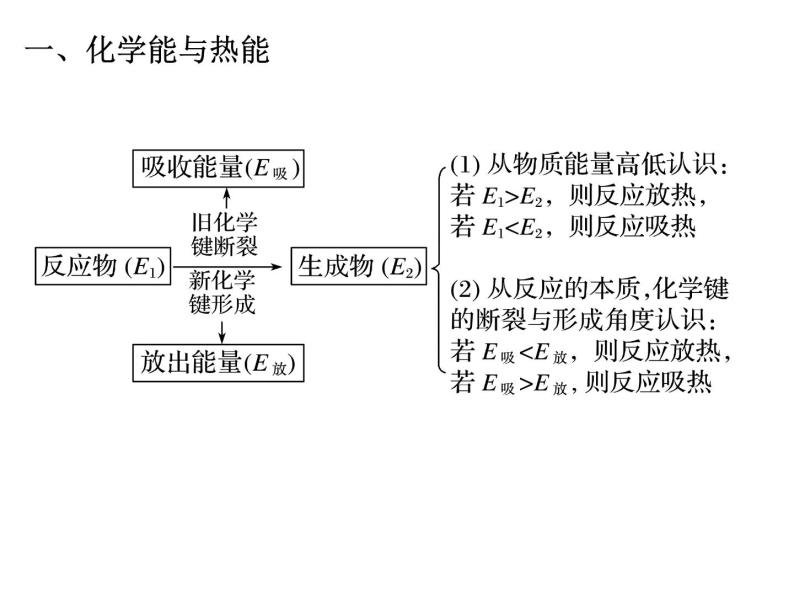
例1 已知:①1 ml H2分子中化学键断裂时需吸收436 kJ 的能量;②1 ml Cl2分子中化学键断裂时需吸收243 kJ的能量;③由氢原子和氯原子形成1 ml HCl分子时释放 431 kJ 的能量。则1 ml H2和1 ml Cl2反应生成氯化氢气体时的能量变化为( )A.放出能量183 kJ B.吸收能量183 kJC.吸收能量248 kJ D.吸收能量862 kJ
例2 下列有关化学反应中能量变化的理解,正确的是( )A.凡是伴随能量变化的过程都是化学变化B.在化学反应过程中总是伴随着能量的变化C.在确定的化学反应中反应物的总能量一定等于生成物的总能量D.在确定的化学反应中反应物的总能量总是高于生成物的总能量
例3 下列说法正确的是( )①需要加热才能发生的反应一定是吸热反应 ②放热反应在常温下一定很容易发生 ③反应是放出能量还是吸收能量必须看反应物和生成物所具有的总能量的相对大小 ④有的放热反应加热到一定温度引发后,停止加热反应也能继续进行A.只有③④ B.只有①②C.①②③④ D.②③④
二、化学能与电能——原电池
1.原电池的构成 原电池是由两个活动性不同的电极、电解质溶液构成的闭合回路,也就是说原电池的构造是:①两个活动性不同的电极;②电解质溶液;③闭合回路,如下图。
锌为负极,发生氧化反应:Zn-2e-===Zn2+,铜为正极,发生还原反应:2H++2e-===H2↑
原电池实质上是将氧化反应和还原反应分到了两个电极上进行,使其分别成为一个“半反应”,因此,根据氧化还原反应方程式可以很容易地设计原电池装置。
3. 原电池的工作原理
(1) 根据电极材料判断 一般是活泼性较强的金属为负极,活泼性较弱的金属或能导电的非金属为正极。(2) 根据电流方向或电子流动方向判断 电流由正极流向负极;电子由负极流向正极。(3)根据原电池里电解质溶液中离子的移动方向 在原电池的电解质溶液中,阳离子移向的极为正极,阴离子移向的极为负极。
4. 原电池正极和负极的判断方法
4.根据原电池两极发生的变化判断 原电池的负极发生失电子的氧化反应,正极发生得电子的还原反应。5.根据现象判断 溶解的一极为负极,增重或有气泡放出的一极为正极。
例4 人造地球卫星上使用的一种高能电池——银锌蓄电池,其电池的电极反应式为Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-。据此判断Ag2O是( )A.负极,被氧化 B.正极,被还原C.负极,被还原 D.正极,被氧化
例5 (1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流表。锌片上发生的电极反应为 。银片上发生的电极反应为 。
Zn-2e-===Zn2+
2H++2e-===H2↑
例6 根据反应:2Ag++Cu===Cu2++2Ag,设计如图所示原电池,下列说法错误的是( )A.X可以是银或石墨B.Y是硫酸铜溶液C.电子从铜电极经外电路流向X电极D.X极上的电极反应式为Ag++e-===Ag
例7 钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为2Fe+2H2O+O2=2Fe(OH)2。以下说法正确的是( )A.负极发生的反应为Fe-2e- =Fe2+B.正极发生的反应为2H2O+O2+2e- =4OH-C.原电池是将电能转变为化学能的装置D.钢柱在水下部分比在空气与水交界处更容易被腐蚀
三、化学反应速率和限度(化学平衡)
1. 影响化学反应速率的因素
例8 反应E+F===G在温度T1下进行,反应M+N===K在温度T2下进行,已知:T1>T2,且E和F的浓度均大于M和N的浓度,则两者的反应速率( )A.前者大 B.后者大C.一样大 D.无法判断
例9 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )A.反应的化学方程式为2M ⇌ NB.t2时,正、逆反应速率相等,达到平衡C.t3时,正反应速率大于逆反应速率D.t1时,N的浓度是M浓度的2倍
2. 化学平衡状态的建立
(1) 逆:讨论的对象是可逆反应 (前提)
(2) 等:同一物质 v正 = v逆≠0 (实质)
(3) 动:化学平衡是一种动态平衡。化学反应达到平衡时,反应并没有停止。
(4) 定:在平衡混合物中,各组成成分的含量保持不变 (标志)
(5) 变:化学平衡状态是有条件的,当影响化学平衡的外界条件发生改变,化学平衡就会被破坏,在新的条件下建立新的化学平衡。
3. 化学平衡状态的特征
(2)间接判断依据 以mA(g)+nB(g) pC(g)+qD(g)为例
4. 化学平衡状态的判断依据
例10 下列关于化学反应限度的说法中正确的是( )A.一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的最大限度B.当一个可逆反应达到平衡状态时,正向反应速率和逆向反应速率相等且等于零C.平衡状态时,各物质的浓度保持相等D.化学反应的限度不可以通过改变条件而改变
1. 下列图示变化为吸热反应的是
2. 下列叙述中正确的是 ( )A.原电池的负极得到电子,发生还原反应B.原电池中较活泼的金属作正极C.原电池中的电极一定是两种不同的金属D.原电池中发生氧化反应的电极是负极
3.(1)铝—空气燃料电池是一种新型的燃料电池,其工作原理如图所示,其中电解质溶液是KOH溶液,正极反应式为O2+2H2O+4e-===4OH-。试完成下列问题:①通入空气的电极是___(填“正”或“负”)极。②Al电极是___(填“X”或“Y”)电极。③电池总反应式为______________________(写离子方程式)。
(2)航天技术中使用的氢氧燃料电池具有高能、轻便和无污染等优点。氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式都为2H2+O2===2H2O。①酸式氢氧燃料电池的电解质溶液是稀硫酸,其负极反应式为2H2-4e-===4H+,则其正极反应式为_______________________。
4.铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:__________________________。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式:负极反应:________________;正极反应:____________________。
5.一种以NaBH4和H2O2为原料的新型电池的工作原理如图所示。下列说法错误的是A.电池的正极反应为H2O2+2e-===2OH-B.电池放电时Na+从a极区移向b极区C.电子从电极b经外电路流向电极aD.b极室的输出液经处理后可输入a极室循环利用
6. 在2A+3B=2C+D的反应中,表示反应速率最快的是A.v(A)=0.5 ml·L-1·min-1B.v(B)=0.6 ml·L-1·min-1C.v(C)=0.35 ml·L-1·min-1D.v(D)=0.4 ml·L-1·min-1
7.草酸与高锰酸钾在酸性条件下能够发生如下反应:2MnO +5H2C2O4+6H+===2Mn2++10CO2↑+8H2O。用4 mL 0.001 ml·L-1 KMnO4溶液与2 mL 0.01 ml·L-1 H2C2O4溶液,研究反应的温度、反应物的浓度与催化剂等因素对化学反应速率的影响。改变的条件如表所示:
(1)实验Ⅰ和Ⅱ可得出的结论:影响化学反应速率的因素是 ;如果研究温度对化学反应速率的影响,使用实验Ⅰ和 (用Ⅰ~Ⅳ表示)。
(2)实验Ⅳ中加入1 mL蒸馏水的目的是_________________________________________________。
8.一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生NO2(g)+SO2(g)SO3(g)+NO(g)的可逆反应,下列能说明反应达到平衡状态的是A.体系压强保持不变B.混合气体颜色保持不变C.SO3和NO的体积比保持不变D.每消耗1 ml SO3的同时生成1 ml NO2
2023版 创新设计 高考总复习 化学 人教版第六章 化学反应与能量: 这是一份2023版 创新设计 高考总复习 化学 人教版第六章 化学反应与能量,文件包含2023版创新设计高考总复习化学人教版最新版第1讲化学能与热能pptx、2023版创新设计高考总复习化学人教版最新版第2讲原电池化学电源pptx、2023版创新设计高考总复习化学人教版最新版第3讲电解池金属的腐蚀与防护pptx、2023版创新设计高考总复习化学人教版最新版第3讲电解池金属的腐蚀与防护doc、2023版创新设计高考总复习化学人教版最新版第1讲化学能与热能doc、2023版创新设计高考总复习化学人教版最新版第2讲原电池化学电源doc、2023版创新设计高考总复习化学人教版最新版本章电池电极反应式或总反应式书写强化练pptx、2023版创新设计高考总复习化学人教版最新版本章电池电极反应式或总反应式书写强化练doc等8份课件配套教学资源,其中PPT共196页, 欢迎下载使用。
人教版 (2019)必修 第二册第一节 化学反应与能量变化集体备课ppt课件: 这是一份人教版 (2019)必修 第二册第一节 化学反应与能量变化集体备课ppt课件,共49页。PPT课件主要包含了NO1,释放热量,吸收热量,反应物的总能量与生成,物的总能量,树枝杂草,不可再生,燃烧效率,利用率,可以再生等内容,欢迎下载使用。
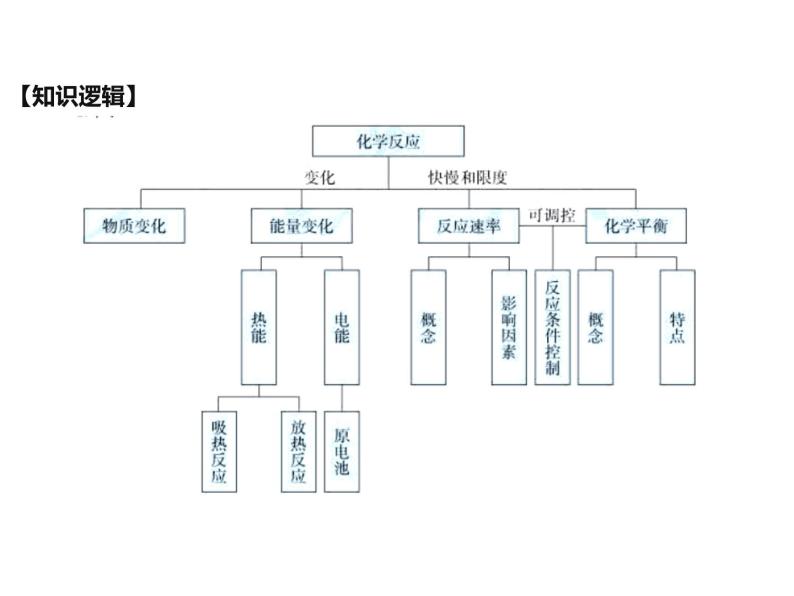
人教版 (2019)必修 第二册化学反应与能量单元综合与测试复习课件ppt: 这是一份人教版 (2019)必修 第二册化学反应与能量单元综合与测试复习课件ppt,共30页。PPT课件主要包含了学习目标,知识逻辑,化学能与热能,常见的吸热反应,常见的放热反应,课堂练习,v正=v逆,等动定变,1直接判断依据等内容,欢迎下载使用。













