

浙江省舟山中学2023-2024学年高二下学期4月月考化学试卷(含答案)
展开一、单选题
1.下列化学用语或图示表达正确的是( )
A.HCl分子中的σ键电子云轮廓图:
B.基态Cl原子的价电子轨道表示式:
C.二氧化硅的分子式为
D.NaOH的电子式为
2.下面关于四种短周期元素的原子比较正确的是( )
①基态原子的电子排布式:
②3p轨道半充满的原子
③原子核外有4种不同能量的电子,且只有一个单电子
④s能级电子总数等于p能级电子总数的p区原子
A.最高正化合价:④=①>②>③B.原子半径:③>②>①>④
C.电负性;③>②>①>④D.第一电离能:④>①>②>③。
3.优氯净()是常用的杀菌消毒剂。下列与优氯净组成元素有关的说法正确的是( )
A.电负性:O>N>C
B.原子半径:Cl>Na>O
C.O在周期表中的位置是第2周期ⅣA族
D.热稳定性:
4.2-噻吩乙醇()是抗血栓药物氯吡格雷的重要中间体,其制备方法如下:
下列说法错误的是( )
A.噻吩中S原子有1对孤对电子
B.生成2-噻吩钠的化学方程式为:2+2Na2
C.噻吩沸点低于咪唑()的原因:咪唑分子间存在氢键,使熔、沸点升高
D.噻吩()中所有原子共平面
5.设为阿伏加德罗常数的值。下列有关叙述正确的是( )
A.1ml白磷中含有P-P共价键的数目为
B.1mlHF平均可形成个氢键
C.分子中含有的σ键数目为
D.中含有的中子数为
6.3-氨基-1-金刚烷醇可用于合成药物维格列汀(治疗2型糖尿病),其分子结构如图所示。下列说法不正确的是( )
A.分子中O原子和N原子均为杂化
B.分子中的键角大于的键角
C.分子中的极性大于的极性
D.分子式为
7.下列分子或离子的空间结构和中心原子的杂化方式均正确的是( )
A.、平面三角形、杂化B.、平面三角形、杂化
C.、V形、杂化D.、三角锥形、杂化
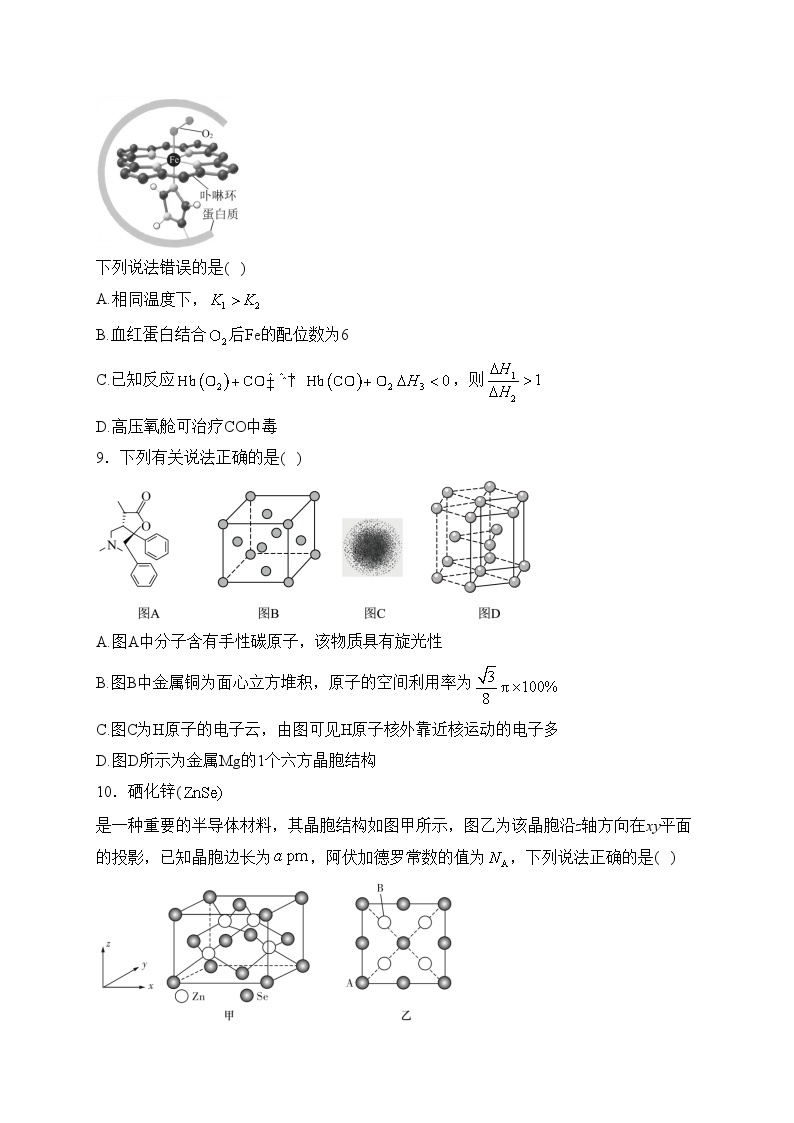
8.已知:血红蛋白可与结合,血红蛋白更易与CO配位,血红蛋白与配位示意如图所示,血红蛋白(Hb)与、CO结合的反应可表示为①;②。
下列说法错误的是( )
A.相同温度下,
B.血红蛋白结合后Fe的配位数为6
C.已知反应,则
D.高压氧舱可治疗CO中毒
9.下列有关说法正确的是( )
A.图A中分子含有手性碳原子,该物质具有旋光性
B.图B中金属铜为面心立方堆积,原子的空间利用率为
C.图C为H原子的电子云,由图可见H原子核外靠近核运动的电子多
D.图D所示为金属Mg的1个六方晶胞结构
10.硒化锌(是一种重要的半导体材料,其晶胞结构如图甲所示,图乙为该晶胞沿z轴方向在xy平面的投影,已知晶胞边长为,阿伏加德罗常数的值为,下列说法正确的是( )
A.位于元素周期表的d区
B.基态原子核外有17种不同空间运动状态的电子
C.A点原子的坐标为(0,0,0),则B点原子的分数坐标为
D.该晶体密度为
11.的配位化合物较稳定且运用广泛。可与、、等配体形成溶液呈浅紫色的、红色的、无色的配离子。某同学按如下步骤完成实验:
已知:向的溶液中加入KSCN溶液生成蓝色的的配离子,不能与形成配位离子。下列说法错误的是( )
A.Fe晶体中原子通过金属阳离子和自由电子间的静电作用相结合
B.可用NaF和KSCN溶液检验溶液中是否含有
C.溶液Ⅰ中仅参与形成范德华力和氢键
D.上述实验可得出,与形成配合物的能力:
12.下列对一些实验事实的理论解释错误的是( )
A.AB.BC.CD.D
13.由四种短周期主族元素形成的某有机物甲的结构如图所示,甲分子中所有原子共平面,X、Y、Z、W的原子序数依次增大,Y、Z、W、X的原子半径依次减小。下列说法错误的是( )
A.通常状况下,由于甲分子间形成氢键使甲呈固态
B.为直线形分子,其中2个Y原子均采取sp杂化
C.由于甲分子中所有原子共平面,所以甲分子中Z的杂化方式为
D.电负性:Z
14.六方硫化锌的结构是S原子作六方最密堆积,其晶胞如图所示,图中A点分数坐标为点分数坐标为;底,高。设为阿伏加德罗常数的值。下列说法错误的是( )
A.晶胞中,填充空隙类型为正四面体空隙
B.图中S原子的配位数为6
C.图中的核间距约为
D.该晶体的化学式为
15.钴酞菁(Pc-C,已知酞菁分子中所有原子共平而)和金属分子笼1通过“一锅法”合成了超分子复合物Pc-C@1,以Pc-C@1为催化剂将转化为CO的反应机理如图所示。
下列叙述错误的是( )
A.酞菁中a、b、c三处氮原子的杂化类型相同
B.上述过程总反应式为
C.反应过程中有键形成
D.钴酞菁分子中两个氮原子提供孤对电子,与形成配位键
16.下列由实验操作及现象能够得出相应结论的是( )
A.AB.BC.CD.D
二、填空题
17.《自然》杂志曾报道我国科学家通过测量中和两种核素的比例确定“北京人”生存年代的研究结果,这种测量方法叫“铝铍测年法”。自然界一共存在三种硅的稳定同位素,分别是、和。完成下列填空:
(1)和_______。
A.是不同核素,具有相同的物理性质
B.是同一种核素
C.具有相同的中子数
D.具有相同的化学性质
(2)Si原子的结构示意图为_______。
(3)基态Si原子能量最高的能层和该能层中电子排布式分别为_______。
A.K层,B.M层,C.M层,D.L层,
(4)的中子数为_______;一个原子的质量为_______g。(用表示)
(5)空间结构与相似,分子中存在的化学键为_______,空间构型_______。
A.离子键B.共价键C.金属键
(6)与碳的氢化物类似,硅元素的氢化物硅烷的通式为:。下列有关说法不正确的是_____。
A.没有同分异构体
B.键能比键能小,故热稳定性:
C.中Si原子杂化方式均为
D.可与水反应生成氢气
(7)在硅酸盐中,四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为_______,Si与O的原子数之比为_______。
18.某抗失眠药物的结构简式为,其分子式为。回答下列问题:
(1)C、O、N中原子半径最小的是_______(填元素符号),解释其原因:_______。
(2)、和分子的价层电子对互斥模型是否相同_______(填“是”或“否”,下同),中心原子的杂化类型是否相同_______,分子空间构型是否相同_______,分子中共价键键角最小的是(填化学式)。三种分子中甲烷的沸点最低,解释其原因是_______。
(3)在由H元素与O元素形成的化合物中,含有非极性键的某极性分子的结构式为_______,在由C元素与O元素形成的化合物中,含有极性键的某非极性分子的电子式为_______。
(4)元素周期表中位于斜对角线的两种元素及其性质十分相似,称之为对角线规则。根据元素周期表对角线规则,金属铍Be与铝单质性质十分相似。写出金属铍Be与NaOH溶液反应的化学方程式_______。
(5)用“*”标出下列化合物中的手性碳原子:_______。
19.X、Y、Z、M、Q、R是元素周期表前四周期元素,且原子序数依次增大,其相关信息如下表所示:
(1)X元素位于元素周期表的位置_______。
(2)X、Y、Z三种元素的原子半径由小到大的排列顺序_______。
(3)含Z元素的化合物在灼烧时火焰呈黄色。许多金属盐在灼烧时都会使火焰呈特征颜色,其原因是_______。
(4)M的原子结构示意图为_______,基态M原子的核外电子填充时最高能级符号为_______。
(5)写出Q元素基态原子的价层电子排布图(即轨道表示式)_______。
(6)写出基态简化的电子排布式_______,基态价层电子排布图(即轨道表示式)_______。
20.铬(Cr)广泛应用于冶金、化工、航天等领域。工业上以络铁矿(主要成分为,含有少量)为原料制备金属铬的工艺流程如图所示:
回答下列问题;
(1)中Fe为+2价,Cr的化合价为______,“焙烧”中反应的化学方程式为__________。
(2)“沉铝”中所得滤渣的成分为________,需控制pH=6~10的原因为_______________。
(3)“酸化”中反应的离子方程式为____________;若该反应的平衡常数,已知:“酸化”后溶液中,则溶液中=_______ml/L。
(4)Ca、O、Cr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中采用面心立方最密堆积方式(处于面对角线上的钙离子与氧离子紧密相邻)。
已知钙离子、氧离子半径分别为xpm、ypm,晶胞中位于所形成的正八面体的体心,该正八面体的边长为________pm。
三、实验题
21.四氮化四硫(,S为+2价)是重要的硫一氮二元化合物,室温下为橙黄色固体,难溶于水,能溶于等有机溶剂,可用与(红棕色液体)反应制备,反应装置如图所示(夹持装置略)。
已知:,回答下列问题:
(1)仪器a的名称为_______;装置D的作用是_______。
(2)四氮化四硫()为双楔形笼状结构,如下图(a)所示。S和N原子交替构成一个假想的八元环,各S-N键长几乎相等。请回答以下问题:
①的双楔形笼状结构可通过_______实验测得。
②分子中正、负电荷的重心完全重合,则为分子_______(填“极性”或“非极性”)。
③已知:多原子分子中相互平行的多条p轨道,连贯重叠构成一个整体,p电子在多个原子间运动形成大π键,如苯分子存在型大π键。有研究者提出的另一种平面八元环结构,如上图(b),S原子的杂化方式为_______;请写出平面中的大π键类型_______。
(3)装置C中生成的同时,还生成一种常见固体单质和一种盐,该反应的化学方程式为_______;证明反应完全的现象是_______。
(4)分离产物后测定产品纯度:
ⅰ.取0.1000g样品加入三颈烧瓶中,再加入足量NaOH溶液并加热蒸出;
ⅱ.将蒸出的通入含甲基橙的标准溶液中,消耗。
根据上述实验,计算样品中的纯度_______(列出表达式)。
参考答案
1.答案:B
解析:B、基态Cl原子的价电子表示式,其价电子轨道表示式为,B正确。
2.答案:B
解析:
3.答案:A
解析:A.一般来说,同周期元素从左到右,电负性逐渐增大,所以电负性:O>N>C,A项正确;
B.同周期主族元素自左至右,原子半径逐渐减小,所以原子半径:Na>Cl,B项错误;
C.O位于元素周期表中第2周期ⅥA族,C项错误;
D.非金属性:N
解析:A.在噻吩分子中,硫原子与两个相邻的碳原子共享两对电子,形成了两个共价键,没有孤对电子,A错误;B.噻吩与钠的化学方程式为:,B正确;C.噻吩分子间不存在氢键,咪唑分子间存在氢键,故沸点低于咪唑,C正确;D.噻吩()中所有原子共平面,D正确。
5.答案:D
解析:
6.答案:B
解析:
7.答案:C
解析:A.中心原子的价层电子对数=,As的杂化方式为,含有一对孤电子对,分子的立体构型为三角锥形,选项A错误;
B.的中心原子的价层电子对数,O的杂化方式为,含有一对孤电子对,分子的立体构型为三角锥形,选项B错误;
C.中心原子的价层电子对数,Se的杂化方式为,含有两对孤电子对,分子的立体构型为V形,选项C正确;
D.中心原子的价层电子对数,C的杂化方式为,没有孤电子对,分子的立体构型为平面三角形,选项D错误;
答案选C。
8.答案:A
解析:
9.答案:A
解析:A.手性碳原子是指与四个各不相同原子或基团相连的碳原子,A中含有手性碳原子为,该物质具有旋光性,A正确。
10.答案:D
解析:A.Zn的价层电子排布式为,位于元素周期表的ds区,A错误;
B.基态原子核外电子排布式为,电子的空间运动状态数=电子所占原子轨道数,s、p、d原子轨道数分别为1、3、5,所以基态原子核外有种不同空间运动状态的电子,B错误;
C.A点原子坐标为,由图乙可知,B点原子的坐标为,C错误;
D.该晶胞中位于晶胞内部的原子个数为4,位于顶点和面心的原子个数为,则,D正确。故答案选D。
11.答案:C
解析:
12.答案:D
解析:A.两种晶体都是共价晶体,原子半径越小,键长越短,键能越大,熔点越高,原子半径:C
B.氟的电负性大于氯的电负性,F-C的极性大于Cl-C的极性,导致羧基中羟基的极性更大,更易电离出酸性:,B正确;
C.C-F的键能比C-H的键能大,键能越大,化学性质越稳定,则聚四氟乙烯的化学稳定性高于聚乙烯,C正确;
D.对羟基苯甲醛受距离影响无法形成分子内氢键而形成分子间氢键,熔沸点更高,而邻羟基苯甲醛可以形成分子内氢键而熔沸点较低,D错误;
故选D。
13.答案:D
解析:
14.答案:B
解析:
15.答案:A
解析:A.酞菁钴中,单键氮原子采用,双键氨原子采用杂化,A错误;
B.根据图示可知,上述过程总反应式为,B正确;
C.由图可知,反应过程中,过程③④均有键形成,C正确;
D.钴酞菁分子中,失去了2个的酞菁离子与钴离子通过配位键结合成分子,其中氮原子提供孤对电子与钴离子形成配位键,D正确;
故选A。
16.答案:A
解析:A,溶解度小的沉淀可以转化为溶解度更小的沉淀,向ZnS(白色)悬浊液中加入少量溶液,有黑色沉淀(CuS)生成,说明沉淀由ZnS转化为CuS,即,A正确。
17.答案:(1)D
(2)
(3)B
(4)14;
(5)B;正四面体结构
(6)BD
(7);1:3
解析:
18.答案:(1)O;C、O、N核电荷数逐渐变大,对核外电子的引力增大,导致原子半径依次减小
(2)是;是;否;;水分子、氨分子均能形成氢键,导致其沸点升高
(3)H-O-O-H;
(4)
(5)
解析:(1)C、O、N核电荷数逐渐变大,对核外电子的引力增大,导致原子半径依次减小,最小的是0;
(2)和分子的中心原子的价电子对数均为4,则其价层电子对互斥模型相同,中心原子的杂化类型均为杂化,和分子的孤电子对数分别为0、1、2,导致其分子空间构型分别为正四面体形、三角锥形、V形;孤电子对与成键电子对之间的斥力大于成键电子对之间的斥力,故分子中共价键键角最小的是。三种分子中甲烷的沸点最低,其原因是水分子、氨分子均能形成氢键,导致其沸点升高;
(3)由H元素与O元素形成的化合物中,含有非极性键的某极性分子为过氧化氢,结构式为H-O-O-H,在由C元素与O元素形成的化合物中,含有极性键的某非极性分子为二氧化碳,电子式为:;
(4)金属铍Be与铝单质性质十分相似,铝和氢氧化钠反应为:,则金属铍Be与NaOH溶液反应的化学方程式。
(5)手性碳原子是连有四个不同基团的碳原子;化合物中的手性碳原子为:。
19.答案:(1)第二周期ⅣA族
(2)O
(4);3p
(5)
(6);
解析:
20.答案:(1)+3;
(2);使完全沉淀
(3);
(4)
解析:(1)中Fe为+2价,根据化合价的代数和为零,Cr的化合价为+3价;“焙烧”中被氧化为和,反应的化学方程式为;
(2)“沉铝”中所得滤渣的成分为,控制pH=6~10,使完全沉淀;
(3)“酸化”使转化为,反应的离子方程式为:;,pH=1,,则;
(4)该晶胞中Ca个数=8×=1,O个数=6×=3,Cr个数是1,因此化学式为;处于对角线上的钙离子、氧离子紧密相邻,晶胞边长是二者半径之和的倍,故该晶胞参数(边长)为pm。该正八面体的边长为晶胞边长的倍,故正八面体的边长为pm。
21.答案:(1)分液漏斗;吸收多余的氨气,防止污染空气,同时防止倒吸
(2)X射线衍射;非极性;;
(3);溶液红棕色褪去
(4)92cV%
解析:
选项
实验事实
理论解释
A
熔点:碳化硅<金刚石
C-Si键能小于C-C键能
B
酸性:
氟的电负性大于氯的电负性,F-C的极性大于Cl-C的极性,导致羧基中羟基的极性更大,更易电离出
C
聚四氟乙烯的化学稳定性高于聚乙烯
C-F的键能比C-H的键能大,键能越大,化学性质越稳定
D
对羟基苯甲醛()比邻羟基苯甲醛()的沸点低
对羟基苯甲醛形成分子内氢键,邻羟基苯甲醛形成分子间氢键
选项
实验操作及现象
结论
A
向ZnS(白色)悬浊液中加入少量溶液,有黑色沉淀(CuS)生成
B
将石灰石与盐酸反应产生的气体直接通入水玻璃中,生成白色沉淀
非金属性:
C
向盛有溶液的试管中边滴入水溶液边振荡,有白色沉淀生成
生成的白色沉淀为
D
取溶液,加入溶液,加入萃取分液后,向水层滴入溶液,溶液变成红色
与所发生的反应为可逆反应
元素
相关信息
X
原子核外有6种不同运动状态的电子
Y
基态原子中s电子总数与p电子总数相等
Z
位于第三周期,且原子半径是同周期主族元素中最大的
M
基态原子核外最外层所有p轨道为半充满状态
Q
基态原子核外最外层p轨道上有两个电子的自旋方向与最外层p轨道上其他电子的自旋方向相反
R
基态原子核外有7个能级且d轨道上有6个电子
浙江省舟山中学2023-2024学年高二下学期4月月考化学试卷(Word版附解析): 这是一份浙江省舟山中学2023-2024学年高二下学期4月月考化学试卷(Word版附解析),共33页。试卷主要包含了考试结束后,只需上交答题卷, 已知, 下列有关说法正确的是等内容,欢迎下载使用。
浙江省浙江省舟山中学2023-2024学年高三上学期12月月考化学试题含答案: 这是一份浙江省浙江省舟山中学2023-2024学年高三上学期12月月考化学试题含答案,共27页。试卷主要包含了考试结束后,只需上交答题卷, 下列说法正确的是, 下列离子方程式书写正确的是等内容,欢迎下载使用。
浙江省舟山中学2023-2024学年高二上学期期中考试化学试卷(含答案): 这是一份浙江省舟山中学2023-2024学年高二上学期期中考试化学试卷(含答案),共18页。试卷主要包含了单选题,填空题,实验题,推断题等内容,欢迎下载使用。












