






(人教A版选择性必修第一册)高二化学同步精品课件课后练习+解析讲义 第18讲+酸碱中和滴定(PPT课件)+
展开一、酸碱中和滴定的概念和原理1.概念:利用中和反应,用已知浓度的酸/碱来测定未知浓度的碱/酸的浓度。2.原理:H+ + OH- === H2O,中和反应中H+与OH-的物质的量相等, 即c(H+)·V(H+) = c(OH-)·V(OH-)。3.待测液的浓度计算:c待测=
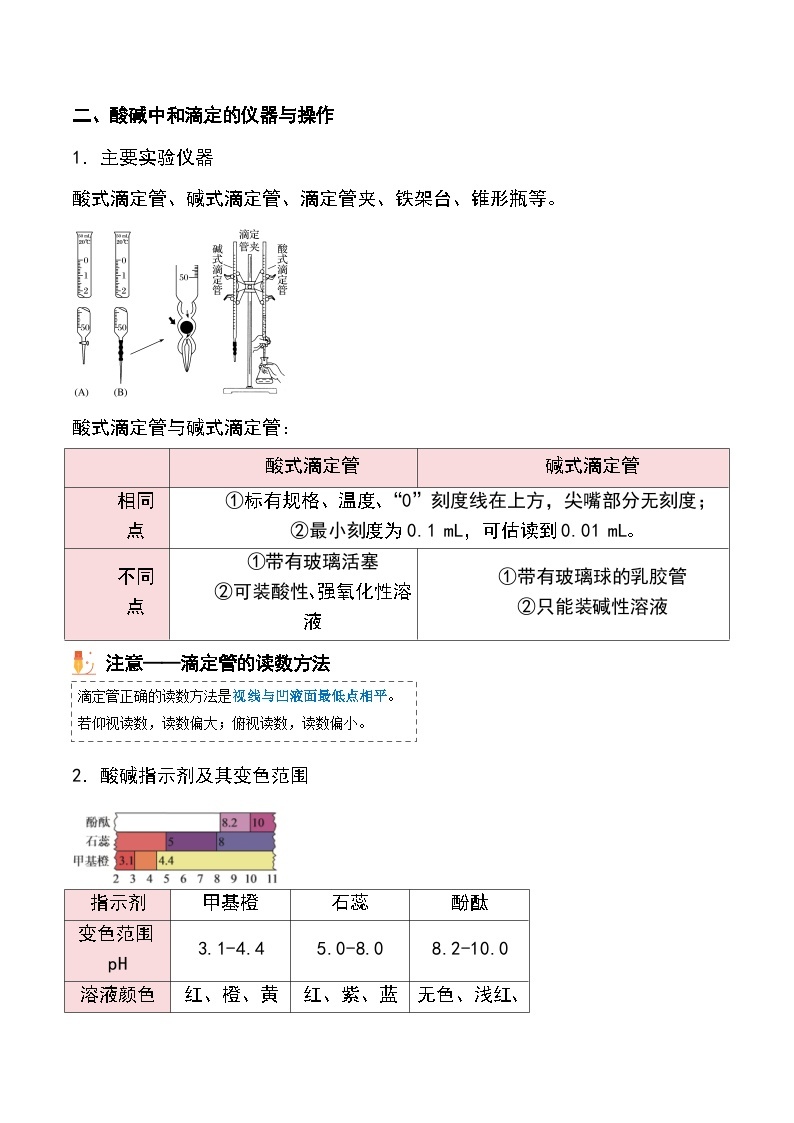
二、酸碱中和滴定的仪器与操作1.主要实验仪器 酸式滴定管、碱式滴定管、滴定管夹、铁架台、锥形瓶等。
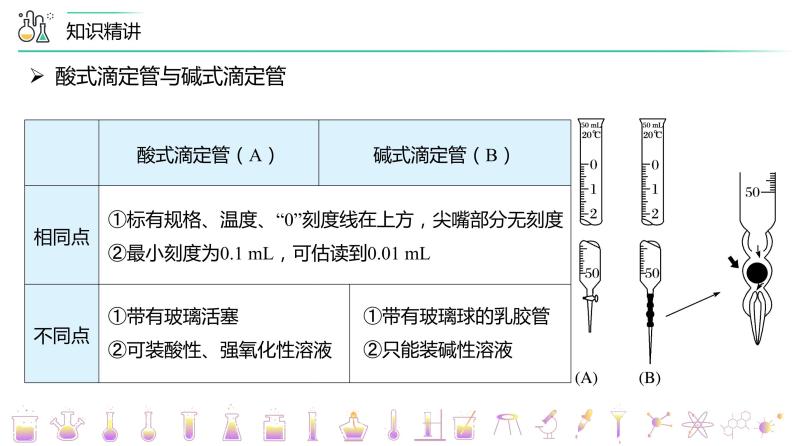
①标有规格、温度、“0”刻度线在上方,尖嘴部分无刻度②最小刻度为0.1 mL,可估读到0.01 mL
①带有玻璃活塞②可装酸性、强氧化性溶液
①带有玻璃球的乳胶管②只能装碱性溶液
酸式滴定管与碱式滴定管
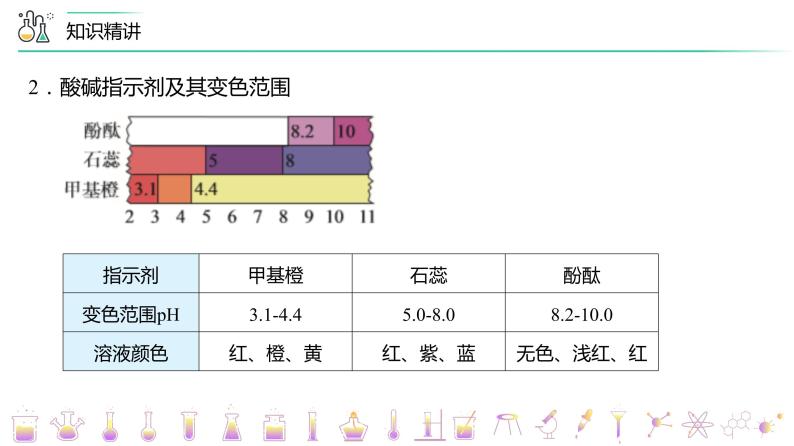
2.酸碱指示剂及其变色范围
3. 中和滴定实验操作(以盐酸标准溶液滴定NaOH待测溶液)(1)滴定前的准备:①滴定管
如果滴定管内部有气泡,应快速放液以赶走气泡
3. 中和滴定实验操作(以盐酸标准溶液滴定NaOH待测溶液)(1)滴定前的准备: ②锥形瓶
调节滴定管活塞,排出尖嘴部分的气泡,使其充满反应液(如果滴定管内部有气泡,应快速放液以赶走气泡;除去碱式滴定管乳胶管中气泡的方法如下图所示)
3. 中和滴定实验操作(以盐酸标准溶液滴定NaOH待测溶液)(2)滴定:
边滴边振荡→滴速先快后慢→左手控制滴定管活塞,且结束前不能离开,右手摇动锥形瓶,眼睛注视锥形瓶内溶液变化→判定终点→读数
3. 中和滴定实验操作(以盐酸标准溶液滴定NaOH待测溶液)(3)终点判断当滴入半滴标准液,指示剂变色,且在半分钟内不变色,视为滴定终点。
用0.200 0 ml/L盐酸滴定20.00 mL 0.200 0 ml/LNaOH溶液
=1×10-4 ml/L
溶液中剩余 n(OH-) = 半滴标准液中 n(H+)
4. 酸碱中和滴定曲线以标准液体积为横坐标,以pH为纵坐标,作图(以HCl 滴定NaOH为例)
3. 中和滴定实验操作(以盐酸标准溶液滴定NaOH待测溶液)(4)数据处理:为减少实验误差,重复实验2~3次,求所用标准液体积的平均值,计算待测液的浓度c待测=
c = 0.1048ml·L-1
三、酸碱中和滴定的误差分析由c待测= 可知,c标准和V待测均为定值,所以c待测的误差主要来自V标准V标准偏大则c待测偏高,V标准偏小则c待测偏低
(1)若以盐酸标准液滴定未知浓度的NaOH溶液,常见的误差分析如下:
(2)若先配制NaOH标准液,滴定未知浓度的盐酸,配制NaOH标准液时:
(1)滴定终点就是酸碱恰好中和的点_________。(2)滴定管盛标准溶液时,调液面一定要调到“0”刻度________。(3)KMnO4溶液应用碱式滴定管盛装 ________。(4)用碱式滴定管准确量取20.00 mL的NaOH溶液________。(5)将液面在0 mL处的25 mL的酸式滴定管中的液体全部放出,液体的体积为25 mL________。(6)中和滴定操作中所需标准溶液越浓越好,指示剂一般加入2~3 mL________。(7)中和滴定实验时,滴定管、锥形瓶均用待测液润洗________。
错误 错误 错误 正确 错误 错误 错误
(8)用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂________。(9)滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 ________。(10)用稀NaOH滴定盐酸,用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 ________。(11)25 ℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH________。(12)等体积、等物质的量浓度的盐酸和醋酸分别与NaOH溶液反应,得到pH=7的溶液所消耗的n(NaOH)相等________。(13)用NaOH溶液滴定白醋,使用酚酞作指示剂,溶液颜色恰好由无色变为浅红色,且半分钟内不褪色时为滴定终点________。
错误 正确 错误 错误 错误 正确
【变1】在一支50 mL酸式滴定管中盛入0.1 ml/L HCl溶液,其液面恰好在20 mL刻度处。若把滴定管中的溶液全部放入锥形瓶中,滴人3滴酚酞试液,然后以0.1 ml/L NaOH溶液进行滴定,当溶液刚好变为浅红色时,消耗NaOH镕液的体积A.等于20 mL D.小于20 mL C.等于30 mL D.大于30 ml
【变3-2】用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作会引起测量结果偏高的是①用天平称量氢氧化钠固体时,将小烧杯放在右盘,砝码放在左盘,并移动游码使之平衡②配制烧碱溶液时,将称量后的氢氧化钠固体溶于水,立即移入容量瓶,将洗涤烧杯的液体注入容量瓶后,加蒸馏水至刻度线③滴定前滴定管中无气泡,滴定后有气泡④酸式滴定管用蒸馏水洗后,未用标准液润洗⑤读取滴定管终点读数时,仰视刻度线A.①②③④⑤B.②③④⑤C.②④⑤D.③④⑤
题型三:中和滴定误差分析
【变4-1】下图是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是A.酚酞不能用作本实验的指示剂B.盐酸的物质的量浓度为1 ml·L-1C.P点时恰好完全中和,溶液呈中性D.曲线b是氢氧化钠溶液滴定盐酸的曲线
题型四:酸碱中和滴定曲线
【例5】用0.2000ml·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:①用蒸馏水洗涤碱式滴定管,注入0.2000ml·L-1的标准NaOH溶液至“0”刻度线以上②固定好滴定管并使滴定管尖嘴充满液体③调节液面至“0”或“0”刻度线以下,并记下读数④量取20.00mL待测液注入润洗过的锥形瓶中,并加入2滴酚酞溶液⑤用标准液滴定至终点,记下滴定管液面读数⑥重复以上滴定操作2~3次请回答下列问题:(1)以上步骤有错误的是___(填编号)。(2)步骤④中,量取20.00mL待测液应使用___(填仪器名称)。(3)步骤⑤滴定时眼睛应注视__;判断到达滴定终点的依据是___。
题型五:酸碱中和滴定综合考查
【例5】(4)以下是实验数据记录表从表中可以看出,其中1次滴定记录的NaOH溶液体积明显和另外两次的体积相差过大,其可能的原因是___。A.锥形瓶装液前,留有少量蒸馏水 B.滴定结束时,仰视计数C.滴定前滴定管尖嘴有气泡,滴定结束无气泡D.滴定过程刚变色就立即停止滴定(5)根据表中记录数据,计算该盐酸浓度为___ml·L-1。(保留4位有效数字)
【答案】(1)①④(2)酸式滴定管(3) 锥形瓶中溶液颜色变化 滴入最后一滴标准液,溶液由无色变为粉红色,且半分钟不恢复原来颜色 (4)BC(5)0.1618
【例6】某学习小组用“间接碘量法”测定CuCl2·2H2O晶体的纯度(杂质不参与反应),过程如下:取1.90g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀(CuI)。过滤,将滤液稀释为100 mL,取20.00mL于锥形瓶中,滴加指示剂,用0.1000ml/LNa2S2O3标准溶液进行滴定,消耗体积为20.00mL。己知:I2+2S2O32- =S4O62- +2I-。下列说法错误的是 A.该实验中指示剂为淀粉溶液B.加入过量KI固体发生的反应为:2Cu2+ + 4I- = 2CuI↓+I2C.该样品CuCl2·2H2O晶体的纯度为:90%D.Na2S2O3标准溶液应该装在酸式滴定管中
高中化学人教版 (2019)选择性必修1整理与复习图文课件ppt: 这是一份高中化学人教版 (2019)选择性必修1<a href="/hx/tb_c4037491_t3/?tag_id=26" target="_blank">整理与复习图文课件ppt</a>,文件包含人教A版选择性必修第一册高二化学同步精品课件讲义第17讲溶液的酸碱性与pH的计算PPT课件pptx、人教A版选择性必修第一册高二化学同步讲义第17讲溶液的酸碱性与pH的计算学生版+教师版docx等2份课件配套教学资源,其中PPT共33页, 欢迎下载使用。
人教版 (2019)第四节 化学反应的调控图文ppt课件: 这是一份人教版 (2019)<a href="/hx/tb_c4002422_t3/?tag_id=26" target="_blank">第四节 化学反应的调控图文ppt课件</a>,文件包含人教A版选择性必修第一册高二化学同步精品课件讲义第12讲化学反应的调控PPT课件pptx、人教A版选择性必修第一册高二化学同步讲义第12讲化学反应的调控学生版+教师版docx等2份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第三节 化学反应的方向教课课件ppt: 这是一份人教版 (2019)选择性必修1<a href="/hx/tb_c4002421_t3/?tag_id=26" target="_blank">第二章 化学反应速率与化学平衡第三节 化学反应的方向教课课件ppt</a>,文件包含人教A版选择性必修第一册高二化学同步精品课件讲义第11讲化学反应的方向PPT课件pptx、人教A版选择性必修第一册高二化学同步讲义第11讲化学反应的方向学生版+教师版docx等2份课件配套教学资源,其中PPT共23页, 欢迎下载使用。












