





专题09+化学反应原理综合(题型突破)(课件)-2024年高考化学二轮复习讲练测(新教材新高考)
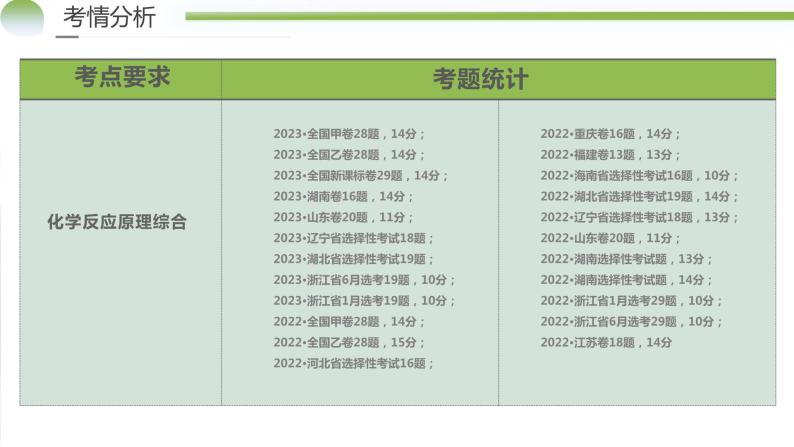
展开考点要求考题统计考情分析物质的组成、性质、分类2023**卷**题,**分2022**卷**题,**分2021**卷**题,**分……传统文化中的性质与变化2023**卷**题,**分2022**卷**题,**分2021**卷**题,**分
2023•全国甲卷28题,14分;2023•全国乙卷28题,14分;2023•全国新课标卷29题,14分;2023•湖南卷16题,14分;2023•山东卷20题,11分;2023•辽宁省选择性考试18题;2023•湖北省选择性考试19题;2023•浙江省6月选考19题,10分;2023•浙江省1月选考19题,10分;2022•全国甲卷28题,14分;2022•全国乙卷28题,15分;2022•河北省选择性考试16题;
2022•重庆卷16题,14分;2022•福建卷13题,13分;2022•海南省选择性考试16题,10分;2022•湖北省选择性考试19题,14分;2022•辽宁省选择性考试18题,13分;2022•山东卷20题,11分;2022•湖南选择性考试题,13分;2022•湖南选择性考试题,14分; 2022·浙江省1月选考29题,10分;2022·浙江省6月选考29题,10分;2022•江苏卷18题,14分
1.围绕能源、环境问题、化工生产等主题,以“拼盘”形式呈现,每小题相对独立,将热化学、化学反应速率、电化学及三大平衡知识融合在一起进行考查;2.题目结合图象、表格、数据、装置等信息,考查学生阅读、读图、分析归纳的能力;3.考点主要涉及盖斯定律与热化学方程式、化学反应速率的计算及其影响因素、平衡常数计算及其影响因素、化学平衡移动及其影响因素、电极反应方程式书写等。
1.预计2024年试题将以填空、读图、作图、计算等形式呈现,以实际情景(场景)为背景,体现核心素养的要求;2.主要以“多因素影响”出现,考查考生的综合分析判断能力。
选材热点如下:1.安全与健康——人体必需的营养元素;重金属对人体的危害;食品添加剂;有关化学与健康方面的材料等。2.环境保护新进展——“雾霾”的产生、危害和治理;工业“三废”和生活垃圾的处理;废电池对饮用水和土壤的污染;绿色化学在工农业生产中的导向作用等。3.新能源的使用——新型的燃料电池、高能绿色电池;新能源开发利用的新进展。4.新型无机非金属材料和有机高分子材料在社会、生活中的应用等。5.涉及碳中和、碳达峰的知识。
反应热及热化学方程式书写
化学反应速率变化图像分析
影响化学反应速率的因素
化学平衡常数(K平)的计算
转化率α的计算:α(A)=(c0A-c平A)÷c0A×100%
电离平衡:电离产生离子的速率=离子结合成弱电解质的速率时,溶液中各粒子的浓度不再变化,电离过程达到平衡
Kw,溶液的pH:Kw=c(H+)·c(OH-)
盐类水解:在溶液中盐的离子跟水所电离出来的H+或OH-生成弱电解质的过程叫做盐类的水解。
化学平衡移动(比较转化率大小)
Ksp计算:KSP(AmBn)=cm(An+)·cn(Bm-),式中的浓度都是平衡浓度
反应热:化学反应中放出或吸收的热量,一定条件下用焓变表示:ΔH,单位为 kJ·ml-1
①“一方程”:写出方程式②“二状态”:s、l、g、aq标物质聚集状态③“三条件”:温度和压强④“四ΔH”:注明-、+号⑤“五数值”:计算ΔH的值
化学反应:ΔH=E1-E2
键能:键能越大物质相对越稳定
内因:反应物本身的性质(主要因素)
浓度(c):增大反应物浓度,反应速率加快
压强(P):有气体参加,增大压强,反应速率加快
温度(T):升高温度,反应速率加快
其他:表面积大小、光、超声波、射线等
表达式:mA(g)+nB(g) ⇌pC(g)+qD(g) K=
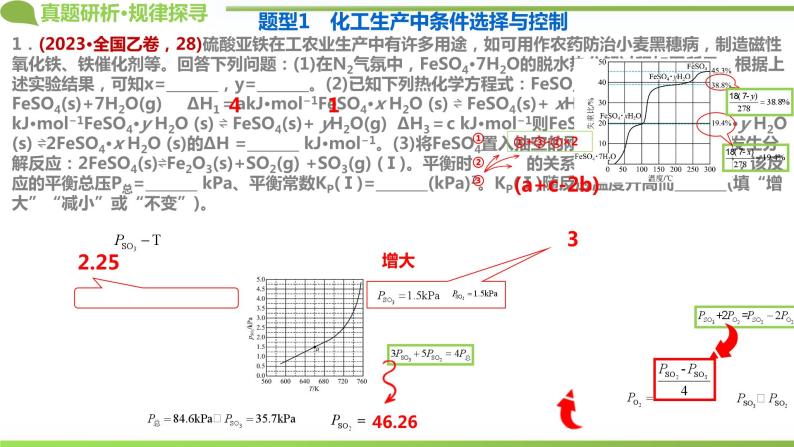
1.(2023•全国乙卷,28)硫酸亚铁在工农业生产中有许多用途,如可用作农药防治小麦黑穗病,制造磁性氧化铁、铁催化剂等。回答下列问题:(1)在N2气氛中,FeSO4·7H2O的脱水热分解过程如图所示:根据上述实验结果,可知x=_______,y=_______。(2)已知下列热化学方程式:FeSO4·7H2O(s) ⇌ FeSO4(s)+7H2O(g) ΔH1=akJ·ml−1FeSO4·x H2O (s) ⇌ FeSO4(s)+ xH2O(g) ΔH2=b kJ·ml−1FeSO4·y H2O (s) ⇌ FeSO4(s)+ yH2O(g) ΔH3=c kJ·ml−1则FeSO4·7H2O(s)+FeSO4·y H2O (s) ⇌2FeSO4·x H2O (s)的ΔH =_______ kJ·ml−1。(3)将FeSO4置入抽空的刚性容器中,升高温度发生分解反应:2FeSO4(s)⇌Fe2O3(s)+SO2(g) +SO3(g) (Ⅰ)。平衡时 的关系如下图所示。660K时,该反应的平衡总压P总=_______ kPa、平衡常数KP(Ⅰ)=_______(kPa)2。KP(Ⅰ)随反应温度升高而_______(填“增大”“减小”或“不变”)。 (4)提高温度,上述容器中进一步发生反应2SO3(g)⇌2SO2(g) +O2(g) (Ⅱ),平衡时 _______(用 表示)。在929K时, 则 _______ kPa,KP(Ⅱ)=_______ kPa (列出计算式)。
题型1 化工生产中条件选择与控制
2. (2023•全国新课标卷,29)氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:(1)根据图1数据计算反应 的ΔH =_______ kJ·ml-1。(2)研究表明,合成氨反应在Fe催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,N2*表示被吸附于催化剂表面的N2 )。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为_______(填步骤前的标号),理由是_________________________________。(3)合成氨催化剂前驱体(主要成分为Fe3O4)使用前经H2还原,生成α-Fe包裹的Fe3O4。已知α-Fe属于立方晶系,晶胞参数a=287pm,密度为7.8 g ·c m-3,则α-Fe晶胞中含有Fe的原子数为( ) (列出计算式,阿伏加德罗常数的值为NA)。
2. (2023•全国新课标卷,29)氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题: (4)在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为 ,另一种为 。(物质i的摩尔分数: ) ①图中压强由小到大的顺序为_______,判断的依据是_______。②进料组成中含有情性气体Ar的图是_______。③图3中,当P2=20MPa、 时,氮气的转化率 ___。该温度时,反应 的平衡常数Kp=_______ (化为最简式)。
合成氨的反应为气体分子数减少的反应,压强越大平衡时氨的摩尔分数越大
3. (2023•湖南卷,16)聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。Ⅰ.苯乙烯的制备(1)已知下列反应的热化学方程式:① ② ③ 计算反应④C6H5C2H5(g)⇌C6H5CH=CH2(g)+H2(g)的ΔH4=_______kJ·ml-1;(2)在某温度、100kPa下,向反应器中充入1ml气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入_______ml水蒸气作为稀释气(计算时忽略副反应);
题型2 设置情景制备新型工业材料
①-②-③:∆H4=-4386.9kJ/ml-(-4263.1kJ/ml)-(-241.8kJ/ml)=+118kJ/ml
平衡时混合气体总物质的量为1.5ml,此时容器的体积为V
乙苯、苯乙烯、H2物质的量之和为1.75ml,混合气的总物质的量为(1.75+x)ml,在恒温、恒压时,体积之比等于物质的量之比,此时容器的体积为
3. (2023•湖南卷,16)聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。Ⅰ.苯乙烯的制备(3)在913K、100kPa下,以水蒸气作稀释气。Fe2O3作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:⑤C6H5C2H5(g) ⇌C6H6(g)+CH2=CH2(g)⑥C6H5C2H5(g) +H2(g) ⇌C6H5CH3(g)+CH4(g)以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S( )随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是_______,理由是_______;
反应④为主反应,反应⑤⑥为副反应,苯乙烯的选择性最大;在恒温恒压下,随乙苯转化率的增大,反应⑤正向移动,反应⑥不移动,则曲线b代表产物苯
曲线a代表产物苯乙烯的选择性,减小压强,反应④⑤正移,反应⑥平衡不移动
3. (2023•湖南卷,16)聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。Ⅰ.苯乙烯的制备
(4)关于本反应体系中催化剂Fe2O3的描述错误的是_______;A.X射线衍射技术可测定Fe2O3晶体结构B.Fe2O3可改变乙苯平衡转化率C.Fe2O3降低了乙苯脱氢反应的活化能D.改变Fe2O3颗粒大小不影响反应速率Ⅱ.苯乙烯的聚合苯乙烯聚合有多种方法,其中一种方法的关键步骤是某Cu (Ⅰ)的配合物促进C6H5CH2X (引发剂,X表示卤素)生成自由基C6H5CH2•,实现苯乙烯可控聚合。(5)引发剂C6H5CH2 Cl、C6H5CH2Br、C6H5CH2I中活性最高的是___________________;(6)室温下,①Cu+在配体L的水溶液中形成[Cu(L)2]+,其反应平衡常数为K;②CuBr在水中的溶度积常数为Ksp。由此可知,CuBr在配体L的水溶液中溶解反应的平衡常数为_______(所有方程式中计量系数关系均为最简整数比)。
4.(2023•辽宁省选择性考试,18)硫酸工业在国民经济中占有重要地位。(1)我国古籍记载了硫酸的制备方法——“炼石胆(CuSO4·5H2O)取精华法”。借助现代仪器分析,该制备过程中CuSO4·5H2O分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如下图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有SO2、_______和_______(填化学式)。 (2)铅室法使用了大容积铅室制备硫酸(76%以下),副产物为亚硝基硫酸,主要反应如下:NO2+SO2+H2O=NO+H2SO42NO+O2=2NO2(ⅰ)上述过程中NO2的作用为___________________。(ⅱ)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是_______(答出两点即可)。
反应中有污染空气的NO和NO2放出影响空气环境、NO2可以溶解在硫酸中给产物硫酸带来杂质、产率不高
(3)接触法制硫酸的关键反应为SO2的催化氧化:SO2(g)+ O2(g) ⇌SO3(g) ΔH=-98.9kJ·ml-1(ⅰ)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如下图所示,下列说法正确的是_______。a.温度越高,反应速率越大b.α=0.88的曲线代表平衡转化率c.α越大,反应速率最大值对应温度越低d.可根据不同α下的最大速率,选择最佳生产温度(ⅱ)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如下图所示,催化性能最佳的是_______(填标号)。 (ⅲ)设O2的平衡分压为p,SO2的平衡转化率为αe,用含p和αe的代数式表示上述催化氧化反应的Kp= (用平衡分压代替平衡浓度计算)。
设SO2初始量为m ml,平衡时n(SO2)=m·αe,n(SO3)=m-m·αe=m(1-αe)
题型3 运用化学反应原理利用能源
5.(2023•湖北省选择性考试,19)纳米碗C40H10是一种奇特的碗状共轭体系。高温条件下,C40H10可以由C40H20分子经过连续5步氢抽提和闭环脱氢反应生成。C40H20 (g) C40H18 (g) + H2(g)的反应机理和能量变化如下:
回答下列问题:(1)已知C40Hx中的碳氢键和碳碳键的键能分别为431.0 kJ·ml-1和298.0 kJ·ml-1,H-H键能为436.0 kJ·ml-1。估算C40H20 (g) ⇌C40H18 (g) + H2(g)的ΔH =_______ kJ·ml-1。 (2)图示历程包含_______个基元反应,其中速率最慢的是第_______个。(3) C40H10纳米碗中五元环和六元环结构的数目分别为_______、_______。 (4)1200K时,假定体系内只有反应C40H12 (g) ⇌C40H10(g) + H2(g)发生,反应过程中压强恒定为p0(即C40H12的初始压强),平衡转化率为α,该反应的平衡常数Kp为_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
假定体系内只有反应C40H12 (g)⇌C40H10(g) + H2(g)发生,反应过程中压强恒定为p0 (即C40H12的初始压强),平衡转化率为α,设起始量为1ml,则根据信息列出三段式:
(5) (g) ⇌C40H18 (g) + H• (g)及 ⇌C40H10 (g) + H• (g)反应的lnK (K为平衡常数)随温度倒数的关系如图所示。已知本实验条件下, (R为理想气体常数,c为截距)。图中两条线几乎平行,从结构的角度分析其原因是________________________。 (6)下列措施既能提高反应物的平衡转化率,又能增大生成C40H10的反应速率的____(填标号)。 a.升高温度 b.增大压强 c.加入催化剂
在反应过程中,断裂和形成的化学键相同
6.(2023•浙江省6月选考,19)水煤气变换反应是工业上的重要反应,可用于制氢。水煤气变换反应:H2O(g)+ CO(g) ⇌CO2 (g)+ H2(g) ΔH=-41.2 kJ·ml-1该反应分两步完成:3Fe2O3(s)+CO(g) ⇌2Fe3O4(s)+CO2(g) ΔH1=-47.2 kJ·ml-12Fe3O4 (s)+H2O(g) ⇌3Fe2O3 (s)+H2(g) ΔH2请回答:(1) ΔH2=_______ kJ·ml-1。(2)恒定总压1.70MPa和水碳比[n (H2O)/ n(CO)] =12:5投料,在不同条件下达到平衡时CO2和H2的分压(某成分分压=总压×该成分的物质的量分数)如下表:①在条件1下,水煤气变换反应的平衡常数K=___________。②对比条件1,条件2中H2产率下降是因为发生了一个不涉及CO2的副反应,写出该反应方程式____。(3)下列说法正确的是______。A.通入反应器的原料气中应避免混入O2B.恒定水碳比[n (H2O)/ n(CO)],增加体系总压可提高H2的平衡产率C.通入过量的水蒸气可防止Fe3O4被进一步还原为FeD.通过充入惰性气体增加体系总压,可提高反应速率
CO+3H2⇌CH4+H2O
(4)水煤气变换反应是放热的可逆反应,需在多个催化剂反应层间进行降温操作以“去除”反应过程中的余热(如图1所示),保证反应在最适宜温度附近进行。 ①在催化剂活性温度范围内,图2中b-c段对应降温操作的过程,实现该过程的一种操作方法是______。A.按原水碳比通入冷的原料气 B.喷入冷水(蒸气) C.通过热交换器换热②若采用喷入冷水(蒸气)的方式降温,在图3中作出CO平衡转化率随温度变化的曲线____。(5)在催化剂活性温度范围内,水煤气变换反应的历程包含反应物分子在催化剂表面的吸附(快速)、反应及产物分子脱附等过程。随着温度升高,该反应的反应速率先增大后减小,其速率减小的原因是________。
温度过高时,不利于反应物分子在催化剂表面的吸附,从而导致其反应物分子在催化剂表面的吸附量及浓度降低,反应速率减小;温度过高还会导致催化剂的活性降低,从而使化学反应速率减小
ΔH=H1(生成物的总能量)-H2(反应物的总能量)
ΔH=E1(反应物的键能总和)-E2(生成物的键能总和)
ΔH=E1(正反应活化能)-E2(逆反应活化能)
①气体反应物压强增大→浓度增大→速率加快。②惰性气体总压强增大→各气体物质的量浓度不变→反应速率不变。
充入惰性气体→压强不变→体积增大→各物质浓度减小→反应速率减慢。
1.温度:对任何反应的速率都有影响2.催化剂:同等程度改变正逆反应速率
浓度视为常数,用量不改变速率,但固体颗粒的大小决定反应物接触面积的大小,会影响化学反应速率。
增大压强→体积缩小→浓度增大→化学反应速率加快。
催化剂:同等程度改变v正、v逆,平衡不移动
增大反应物浓度或减小生成物浓度→
减小反应物浓度或增大生成物浓度→
反应前后气体体积改变→增大压强→
反应前后气体体积改变→减小压强→
反应前后气体体积不变→改变压强→
α(A)=(c0A-c平A)÷c0A×100%
向气体分子总数减小的方向移动
向气体分子总数增大的方向移动
表达式:mA(g)+nB(g) ⇌pC(g)+qD(g) Q=
原电池:负极:氧化反应——电极材料溶解、质量减轻;正极:还原反应——质量不变或增重、有气体产生。
电解池:与电源负极连接:阴极材料:不反应;与电源正极连接:阳极(除惰性电极外)材料:氧化反应,可能出现电极溶解、质量减轻等现象。
Fe在原电池与电解池反应中发生氧化反应时失去2个电子生成Fe2+
可充电电池:放电反应:原电池反应——负极发生氧化反应充电反应:电解池反应——阴极发生还原反应。
电离平衡、水解平衡和溶解平衡应用中注意
书写电离平衡、水解平衡、溶解平衡方程式时要用可逆号连接。
分析离子的存在形式时要考虑弱酸弱碱的电离和离子能否发生水解。
分析离子浓度大小时要考虑酸碱盐对水电离的影响。
利用溶度积常数分析沉淀是否能完成转化时,要考虑溶解平衡式中阴阳离子计量数与溶度积常数关系,溶度积大的其溶解度不一定大。
1.(2024·浙江省衢州、丽水、湖州三地市教学质量检测)合成氨是人工固氮最重要的途径。合成氨反应为:N2(g)+3H2(g) ⇌2NH3(g) ΔH=-92.4kJ·ml−1请回答:(1)该反应能自发进行的条件是 。(2)现代常用工艺条件以Fe作催化剂,一定压强下,控制温度500℃,反应历程为(*表示吸附态)化学吸附: (速率慢); (速率快) 表面反应: ; ; (速率快)脱附: (速率快)关于合成氨工艺的下列理解,正确的是___________。A.控制温度远高于室温,是为了提高平衡转化率B.原料气须经过净化处理,以防止催化剂中毒和安全事故发生C.不断将液氨移去,利于反应正向进行同时提高正反应速率D.实际生产中,N2适度过量有利于提高H2的转化率同时有利于提高整体反应速率
(3)为降低合成氨的能耗,我国科学家提出使用M-LiH复合催化剂,催化效果如图1所示。若一定压强下,以相同的投料,500℃用Fe作催化剂和350℃用Fe-LiH作催化剂,氨气的产率随时间变化如图2。请在图2中画出相同压强下350℃用Cr-LiH作催化剂氨气的产率随时间变化的曲线 。
(4)压强为20MPa下,以 、 (x代表物质的量分数)进料,反应达平衡时氮气的转化率与温度的结果如下图3中曲线b所示。①若保持压强不变,以 、 、 进料,则平衡时氮气的转化率与温度的结果是曲线 (填“a”或“c”)。判断的依据是 。②若保持压强不变,当平衡时 ,则该温度下,反应N2(g)+3H2(g) ⇌2NH3(g)平衡常数KP= (化为最简式)。[对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作KP,如 ,p为平衡总压强,x(B)为平衡系统中B的物质的量分数]。
相同温度下,恒压充入稀有气体反应物分压减小,平衡逆向移动
2.(2023·广东省佛山市二模)工业利用N2、H2催化合成氨实现了人类“向空气中要面包”的梦想。(1)原料气(含N2、H2、CO)中的CO能被催化剂吸附,需经过铜氨液处理除去,反应为:[Cu(NH3)3]++CO+NH3⇌[Cu(NH3)3CO]+ ΔH<0。①除去原料气中CO的理由是______________________。②为提高CO吸收率,应选择的条件为___________。A.高温高压 B.高温低压 C.低温高压 D.低温低压③[Cu(NH3)3CO]+中的配体为____________(2)研究发现铁催化剂表面上合成氨的反应历程如图所示,其中吸附在铁催化剂表面上的物种用*标注。 ①该反应历程中最大活化能对应步骤的化学方程式为____________________。合成氨反应: 的ΔH =___________ kJ·ml-1 (用图中字母表示)。②铁催化合成氨时N2与H2需吸附在催化剂表面活性位点进行反应,由合成氨反应的速率方程 (k为速率常数)可知,c(NH3)越大,反应速率越小。原因是___________。(3)反应N2(g)+ 3H2(g)⇌2NH3 (g)的标准平衡常数可表达为: ,其中 为标准压强(0.1MPa),pNH3、pN2、pH2和分别为各组分的平衡分压(分压=总压×物质的量分数)。若N2和H2起始物质的量之比为1∶3,反应在恒温、恒压(10MPa)下进行,平衡时N2转化率为50%,则 _____________(写出计算过程,结果保留两位有效数字)。
NH3浓度较大时,占据催化剂表面更多活性位点,阻碍N2的吸附
3.(2023·广西三模)氨是工农业生产中的重要原料,研究氨的合成和转化是一项重要的科研课题。回答下列问题:(1)已知:工业合成氨合成塔中每产生2mlNH3,放出92.2kJ热量, 则1mlN-H键断裂吸收的能量为___________kJ。(2)在密闭容器中合成氨气,有利于加快反应速率且能提高H2转化率的措施是___________(填字母)A.升高反应温度 B.增大反应的压强C.及时移走生成的NH3 D.增加H2的物质的量
3.(2023·广西三模)氨是工农业生产中的重要原料,研究氨的合成和转化是一项重要的科研课题。回答下列问题:(3)将0.6mlN2和0.8mlH2充入恒容密闭容器中,在不同温度下,平衡时NH3的体积分数随压强变化的曲线如图。 甲、乙、丙中温度从高到低的顺序是___________。d点N2的转化率是___________,d点Kp=___________(Kp是以平衡分压表示的平衡常数,平衡分压=平衡时各组分的物质的量分数×总压)。
3.(2023·广西三模)氨是工农业生产中的重要原料,研究氨的合成和转化是一项重要的科研课题。回答下列问题:(4)催化氧化法消除NO反应原理为:6NO+4NH35N2+6H2O。不同温度条件下,氨气与一氧化氮的物质的量之比为2:1时,得到NO脱除率曲线如图甲所示。脱除NO的最佳温度是___________。在温度超过1000°C时NO脱除率骤然下降的原因可能是___________。 (5)研究发现NH3与NO的反应历程如图乙所示。下列说法正确的是___________(填字母)。A.该反应历程中形成了非极性键和极性键B.每生成2mlN2,转移的电子总数为8NAC.Fe2+能降低总反应的活化能,提高反应速率D.该反应历程中存在:NO+Fe2+-NH2=Fe2++N2↑+H2O
4.(2023·重庆市九龙坡区高三学业质量调研抽测二模)尿素CO(NH2)2是一种高效化肥,也是一种化工原料。(1)尿素-SCR技术可用于汽车尾气的处理,该过程中会生成NH3,反应如下。Ⅰ.CO(NH2)2(s) ⇌HNCO(g)+NH3(g) ΔH>0 Ⅱ. HNCO(g)+H2O(g) ⇌NH3(g)+CO2(g) ΔH <0一定温度下,向恒容容器中投入足量CO(NH2)2 (s)和一定量的H2O(g),当上述反应达到平衡时,测得 、 。则 _______ ml·L-1 (用含p、q的代数式表示,下同),反应Ⅰ的平衡常数为_______( ml·L-1)2。
(2)工业上以CO2和NH3为原料合成尿素,图1是反应历程及能量变化,历程中的所有物质均为气态。①该反应历程中,若ΔE2=241.0kJ·ml−1,则ΔE1=_______ kJ·ml−1。②在T1℃和T2℃时(T1<T2),向恒容容器中投入等物质的量的HNCO(g)和NH3(g),发生以下反应:HNCO(g)+NH3(g)⇌CO(NH2)2(g)。平衡时lgp(NH3)与lgp [CO(NH2)2]的关系如图2所示,p为物质的分压强(单位为kPa)。若 、 。T1℃时, _______kPa-1。若点A时继续投入等物质的量的两种反应物,再次达到平衡时(温度不变),CO(NH2)2的体积分数_______(填“变大”“变小”或“不变”)。
(3)某实验小组用Zn –CO2水介质电池电解含有尿素的碱性废水,装置如图3(电极a为Zn,b、c、d均为惰性电极)。装置Ⅰ中双极膜为阳离子交换膜和阴离子交换膜复合而成,与b极室相连的交换膜为_______离子交换膜(填“阴”或“阳”),装置Ⅱ阳极上的反应式为_______。
CO(NH2)2+2H2O-6e-=N2+CO32-+8H+
1.(2024·浙江省宁波市高三选考模拟考试)丙烯是一种重要的化工原料,其主要产品聚丙烯是生产口罩喷溶布的原料。铬基催化剂下丙烷生产丙烯相关主要反应有:Ⅰ.C3H8(g)⇌C3H6(g)+H2(g) ΔH1=+124.14kJ·ml−1Ⅱ.C3H8(g)⇌C2H4(g)+CH4(g)Ⅲ.C3H8(g)⇌3(s)+4H2(g)请回答:(1)已知键能: , 。C=C的键能与C-C的键能相差约 kJ/ml。
(2)600℃时,容器压强恒为P,铬基催化剂下两个密闭容器中分别按下表投料发生反应: ①容器B生成C3H6的反应流程如下:下列有关说法正确的是 。A.原料气中通入N2可提高C3H8的平衡转化率B.升高温度,一定能提高的C3H6平衡产率C.过程1产生C3H6的量大于过程2和过程3产生的C3H6D.在铬基催化剂中适当加入CaO可促进过程2平衡正移而提高C3H8的平衡转化率②若容器A中只发生反应Ⅰ和反应Ⅱ,C3H8的平衡转化率为α,C3H6的选择性(选择性 )为w,计算反应Ⅰ的平衡常数Kp= 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③按照容器A和容器B的气体组分比,将两组气体按相同流速分别通过催化剂固定床反应器,C3H8的转化率和C3H6的选择性随时间变化如图所示: 随反应进行,A组中C3H8转化率明显降低的可能原因是_________________________________________,B组中CO2的作用是___________________________________________________________________________________________ (用化学方程式和必要的文字说明)。(3)恒温恒容的密闭容器中通入气体分压比为 的混合气体, ,已知某反应条件下只发生反应Ⅳ和反应Ⅴ( , 为速率常数,只与温度有关且 ):反应Ⅳ:C3H8(g)+ CO2(g)=C3H6(g)+H2O(g)+ CO(g) 反应Ⅴ:C3H8(g)+6CO2(g)=9CO(g)+3H2O(g) 实验测得丙烯的净生成速率方程为 ,请在下图中画出丙烯的物质的量随时间的变化趋势 。
C3H8分解产生的C附着于催化剂表面,使催化剂失活,反应速率迅速减小
(曲线起点为0,纵坐标最大值不超过2且终点时为1)
2.(2024·黑龙江龙东五地市高三联考)甲烷和乙烯是重要的气体燃料和化工原料。回答下列问题:(1)甲烷化反应即为氢气和碳氧化物反应生成甲烷,有利于实现碳循环利用。已知涉及的反应如下:反应Ⅰ:CO(g)+3H2 (g)⇌CH4 (g)+ H2O(g) ΔH1=-206.2kJ·ml-1反应Ⅱ:CO (g)+ H2O(g)⇌CO2(g)+H2 (g) ΔH2反应Ⅲ:CO2(g)+4H2 (g)⇌CH4 (g)+2 H2O(g) ΔH3=-165 kJ·ml-1则ΔH2=_______________kJ·ml-1。(2)研究表明CO2(g)和CH4 (g)在催化剂存在下可发生反应制得合成气CO2(g)+ CH4(g)⇌2CO(g)+2H2 (g) ΔH。在其他条件相同,不同催化剂(A、B)作用下,使原料CO2(g)和CH4 (g)反应相同的时间,CO(g)的产率随反应温度的变化如图所示: ①在催化剂A.B作用下,它们正、逆反应活化能差值分别用 和 表示,则 (填“>”“<”或“=”)。②y点对应的逆反应速率v(逆) z点对应的正反应速率v(正)(填“>”“<”或“=”)。
(3)西北工业大学的张健教授、德累斯顿工业大学的冯新亮院士等人报道了一种电催化半氢化策略,在室温条件下,水溶液介质中可选择性地将C2H2还原为C2H4,其原理示意图如下: ①阴极的电极反应式为_______________________________________。②同温同压下,相同时间内,若进口处气体物质的量为aml,出口处气体的总体积为进口处的x倍,则C2H2转化率为__________________。
C2H2+2H2O+2e- =C2H4+2OH-
(2x-2)×100%
(4)利用多晶铜高效催化电解CO2制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现CO2的连续转化。 ①电解过程中HCO3-向 (填“铂”或“多晶铜”)电极方向移动。②多晶铜电极上的电极反应式为__________________________________________。③理论上当生产0.05ml乙烯时,铂电极产生的气体在标况下体积为 (不考虑气体的溶解)。
14CO2+8H2O+12e- =C2H4+12HCO3-
3.(2024·广西部分高中高三一模)绿色能源是未来能源发展的方向,积极发展氢能,是实现“碳达峰、碳中和”的重要举措,可以用以下方法制备氢气。I.甲烷和水蒸气催化制氢气。主要反应如下:i.CH4(g)+H2O(g) ⇌CO(g)+3H2(g) △H=+206.2kJ•ml-1ii.CO(g)+H2O(g) ⇌CO2(g)+H2(g) △H=-41.2kJ•ml-1(1)反应CH4(g)+CO2(g) ⇌2CO(g)+2H2(g)的△H=__________kJ•ml-1。(2)在容积不变的绝热密闭容器中发生反应i,下列能说明反应达到平衡状态的是___________(填标号)。A.气体混合物的密度不再变化 B.CH4消耗速率和H2的生成速率相等C.CO的浓度保持不变 D.气体平均相对分子质量不再变化E.体系的温度不再发生变化
(3)恒定压强为P0MPa时,将n(CH4):n(H2O)=1:3的混合气体投入反应器中发生反应i和ii,平衡时,各组分的物质的量分数与温度的关系如图所示。 ①图中表示CO2的物质的量分数与温度的变化曲线是__________(填字母)。②结合图中数据,其他条件不变,若要H2的产量最大,最适宜的反应温度是__________(填标号)。A.550~600℃ B.650~700℃ C.750~800℃在其他条件不变的情况下,向体系中加入CaO可明显提高平衡体系中H2的含量,原因是_______________。③600℃时,反应ii的平衡常数的计算式为Kp=_______________________(Kp是以分压表示的平衡常数,分压=总压×物质的量分数)。Ⅱ.电解法制氢气。某科研小组设计如图所示电解池,利用CO2和H2O在碱性电解液中制备水煤气(H2、CO),产物中H2和CO的物质的量之比为1∶1。
CaO为碱性氧化物,能吸收酸性氧化物CO2,导致CO2浓度减小,促使反应ii平衡正向移动,导致CO浓度减小,引起反应i平衡也正向移动
(4)电极B是 极,生成水煤气的电极反应式为_________________________________.
CO2+2H2O+2e-=H2+CO+2OH-
4.(2023·云南省二模)CO2与氢气在固载金属催化剂上可发生以下反应: 反应i. CO2(g)+H2(g)⇌HCOOH(g) ΔH1反应ii. CO2(g)+H2(g)⇌H2O(g)+CO(g) ΔH2>0反应iii.……可能的反应机理如下(M为催化剂); 回答下列问题:(1)反应iii的化学方程式为___________________________________________。(2)已知下列几种物质的标准摩尔生成焓(在101kPa时,由最稳定单质合成1ml指定产物时所放出的热量): 依据以上信息,ΔH1=__________________。
CO2(g)+2H2(g)⇌HCHO(g)+ H2O(g)
+31.21kJ·ml-1
(3)在一定压强下,按n(H2):n(CO2)=1:1 投料,发生反应i和反应ii (忽略反应iii), 反应相同时间,CO2的转化率及HCOOH选择性(甲酸选择性= 随温度变化曲线如下图所示。 ①下列措施能提高CO2平衡转化率的是___________ ( 填标号)。A.降低温度 B.再充入Ar C.分离出HCOOH②673.15K,反应后体系中H2的分压为a MPa,则反应i的压力商计算式Qp=___________ MPa-1。③当温度高于673.15K,随温度升高,反应i与反应ii的反应速率相比,增加更显著的是反应___________ (填“ i”或“ii”),判断的理由是___________________________________________________________________。
随温度升高,二氧化碳的转化率升高,但HCOOH的选择性却迅速下降
(4)若在Bi或Bi/CeO2催化剂表面还原CO2生成HCOOH, 模拟经历两种中间体的能量变化如图所示。HCOOH的合成更倾向于通过生成___________中间体,且___________ (填 “Bi”或“Bi/CeO2”)的催化活性更优异。
5.(2023·广东省茂名市二模)二氧化碳催化加氢直接合成二甲醚(DME)既可以实现碳减排又可以得到重要的有机原料,对于保证经济的高速发展和实现长期可持续发展战略均具有重要意义,其中涉及的反应有:(ⅰ) CO2(g)+3H2(g)⇌CH3OH(g)+ H2O(g) ΔH1= a kJ·ml-1(ⅱ) 2CH3OH(g)⇌CH3OCH3(g)+ H2O(g) ΔH2=b kJ·ml-1(ⅲ)CO2(g)+H2(g)⇌CO(g)+ H2O(g) ΔH3=c kJ·ml-1已知:生成物A的选择性回答下列问题:(1) 2CO2(g)+3H2(g)⇌CH3OH(g)+ 3H2O(g)的ΔH4=___________ kJ·ml-1 (用含a、b或c的代数式表示)。(2)反应ⅰ、ⅱ、ⅲ的吉布斯自由能随温度变化如图,下列说法正确的是___________。A.常温下,反应ⅰ、ⅱ、ⅲ均能自发B.410K时,反应ⅰ和反应ⅲ的反应速率相等C.温度升高,CH3OH的选择性提高,CO的选择性降低D.提高二甲醚产率的关键是寻找对甲醇具有高选择性的催化剂
(3)在3.0MPa下,研究人员在体积固定的容器中充入4mlH2和1mlCO2发生反应,CO2的平衡转化率和生成物的选择性随温度变化如图(不考虑其他因素影响)。 ①ΔH3___________0(填“>”或“<”)。②若在220℃下,平衡时n(H2O)=___________,计算反应2CH3OH(g)⇌CH3OCH3(g)+ H2O(g)在220℃下的平衡常数___________(写出计算过程,结果保留三位有效数字)。③当其他条件不变,压强为4.0MPa、温度为260℃时,图中点___________(填“A”、“B”、“C”或“D”)可表示二甲醚的选择性。(4)在Cu/ZnO/ZrO2基催化剂下发生反应,机理如图: 该机理表示的是反应___________(填“ⅰ”、“ⅱ”或“ⅲ”)的反应过程。写出转化③的反应方程式_________________________________________________。
HCOO-+4H=H2O+CH3O-
6.(2023·吉林省长春市三模)环己烯是重要的有机化工原料,广泛用于制备各种中间体,进而用于农药、医药、塑料等生产。回答下列问题:(1)已知:苯( )、环己烯( )和氢气的燃烧热(ΔH)分别为:-3265KJ/ml、-3747KJ/ml和-285.8KJ/ml。则反应Ⅰ: ΔH=_______kJ·ml−1。(2)某温度下,将等物质的量的苯蒸汽和H2加入刚性容器内发生反应生成气态环己烯,起始总压为1MPa,平衡时总压减小了40%,该温度下反应的平衡常数Kp=_______ (保留一位小数)。达到平衡后,欲增加苯的平衡转化率,可采取的措施有_______(填标号)。A.通入惰性气体 B.再加入等物质的量的苯蒸汽和H2C.增加催化剂的用量 D.增加氢气的浓度
(3)液相中水作为添加剂苯选择性加氢制备环己烯(反应Ⅰ)过程的示意图如图1,采用能够吸附氢气的含钉(Ru)催化剂,将氢气以一定速率通入液态苯与水的混合体系中生成环己烯,环己烯会进一步加成生成副产物环己烷。(已知:苯和环己烯在水中的溶解度分别为:2.1g/L和0.22g/L)①研究表明使用水作为添加剂时,催化剂表面会被一层水吸附层覆盖,使得环己烯的选择性明显提高,原因是_______________________________________________________________。②反应温度与苯加氢反应速率的关系如图2所示,温度高于60℃时,苯加氢速率降低的原因可能是__________________________________________________________________________。
环己烯在水中的溶解度相对较小,促使环己烯及时从催化剂表面脱附,降低了生成环己烷的速率,提高环己烯的选择性
反应温度过高,氢气溶解度减小,降低苯加氢的反应速度;反应温度过高使催化剂失活
(4)环氧环己烷( )是有机合成的重要中间体,有着广泛的应用。以环己烯和溴化钠为原料,采用间接电解法是制备环氧环己烷的常用方法,其过程如下图:①采用无隔膜法电解NaBr溶液,阳极电极反应方程式为__________________________。②从践行绿色发展理念,保护生态环境的角度分析,采用该方法制备环氧环己烷的优点是___________________________________________________________。
Br-+3H2O -6e- =BrO3-+6H+
NaBr溶液可以循环利用,提高了溴原子利用率,减少排放
题型3 运用化学反应原理环境保护
1.(2024·湖北鄂东南省级示范高中教育教学改革联盟高三联考)空气中CO2含量的控制和CO2资源利用具有重要意义。(1)已知25℃、101kPa下,在合成塔中,可通过二氧化碳和氢气合成甲醇,后续可制备甲酸。某反应体系中发生反应如下:Ⅰ.CO2(g)+H2 (g)⇌CO (g)+ H2O(g) ΔH1=+41.2 kJ·ml-1Ⅱ.CO2(g)+3H2 (g)⇌CH3OH (g)+ H2O(g) ΔH2=-49 kJ·ml-1Ⅲ.CO2(g)+4H2 (g)⇌CH4 (g)+2 H2O(g) ΔH3=-165 kJ·ml-1①几种化学键的键能如表所示,则a= 。②反应Ⅰ的速率方程为 ,其中x表示相应气体的物质的量分数,Kp为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后 ,此时反应Ⅰ的速率v= (用含k的代数式表示)。
(2)向刚性密闭容器中通入一定量CO2和H2,发生反应Ⅰ和反应Ⅱ,温度对CO和CH3OH的物质的量分数影响如图所示。 图中表示CO物质的量分数的为______(填“m”或“n”);为提高CH3OH的选择性,可采取的措施有__________________________(写出1条即可)。
(3)催化电解吸收CO2的KOH溶液可将CO2转化为有机物。在相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如图所示。 其中,Qx=nF,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。①当电解电压为U1V时,电解过程中含碳还原产物的FE%为0,阴极主要还原产物为________(填化学式)。②当电解电压为U2V时,阴极由CO2生成HCOO-的电极反应式为__________________________________。③当电解电压为U3V时,电解生成的C2H4和HCOO-的物质的量之比为_________________。
CO2+H2O+2e- =HCOO-+OH-
2.(2023·广东省高三模拟)绿水青山就是金山银山。燃烧煤的烟气含有SO2和NOx,直接排放会造成环境污染,排放前需要进行处理。试回答下列问题:(1)某实验小组设想利用CO还原SO2。已知S和CO的燃烧热分别是296.0kJ·ml-l、283.0kJ·ml-l,试写出CO还原SO2生成CO2和S(s)的热化学方程式____________________________________________________。(2)采用Na2SO3溶液吸收法处理SO2,25℃时用1ml·L-1的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为________________________________________________。(已知25℃时:H2SO3的电离常数Kal=l.3×l0-2,Ka2=6.2×l0-8)(3)采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在脱硫、脱硝过程中,反应器中一直维持下列条件:温度为298K,pH=12,NaClO2溶液浓度为5×l0-3ml·L-1。通入含有SO2和NO的烟气,则反应一段时间后溶液中离子浓度的分析结果如下表。
2CO(g)+SO2(g)=2CO2(g)+S(s) ΔH=-270kJ·ml-1
c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。 ①写出NaClO2溶液脱硫过程中主要反应的离子方程式______________________________________________。脱硫、脱硝反应的△H_________0(填“<”“>”或“=”)。②已知脱硝主要反应为;4NO+3 ClO2-+4OH-=4NO3-+3C1-+2H2O。由实验结果可知,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是________(写出其中一个原因)。欲提高烟气中NO的脱硝反应速率,可以采用的措施是_________________________(写出其中一条措施)。
4OH-+ClO2-+2SO2⇌2 SO42-+Cl-+2H2O
在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。 ③脱硝主要反应的平衡表达式为: ,其中pe(NO)为平衡分压。结合题目信息,计算298K时脱硫过程主要反应的化学平衡常数:K=_________________________(只列算式代入数据,不作运算)(4)如果采用Ca(ClO2)2替代NaClO2,能得到更好的烟气脱硫效果,其原因是_____________________。
2OH-+ClO-+SO2⇌ SO42-+Cl-+H2O,Ca2+与SO42-形成CaSO4沉淀,反应平衡向产物方向移动,SO2转化率提高
3.(2023·安徽省高三质量检测)SO2是形成酸雨的主要气体,减少SO2的排放和研究SO2综合利用意义重大。回答下列问题:(1)已知25℃时:xSO2(g)+2xCO(g)⇌2xCO2(g)+Sx(s) ΔH=a kJ·ml-1;2xCOS(g)+xSO2(g)⇌2xCO2(g)+3Sx(s) ΔH=bkJ·ml-1。则25℃时,CO与Sx(s)反应生成COS(g)的热化学方程式为______________________________________________________。(2)焦炭催化还原SO2既可削除SO2,同时还可得到硫(S2),化学方程式为2C(s)+2SO2(g) ⇌S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1mlSO2发生反应,测得SO2(g)的生成速率与S2(g)的生成速率随温度(T)变化的关系如图1所示。图中A、B、C、D四点中,处于平衡状态的是_______点。
(3)某科研小组研究臭氧氧化脱除SO2和NO的工艺,反应原理及反应热活化能数据如下:反应Ⅰ:NO(g)+O3(g)⇌NO2(g)+O2(g) ΔH1=-200.9kJ·ml-1,E1=3.2kJ·ml-1;反应Ⅱ:SO2(g)+O3(g)⇌SO3(g)+O2(g) ΔH2=-241.6kJ·ml-1,E2=58kJ·ml-1;已知该体系中臭氧还发生分解反应:2O3(g)⇌3O2(g)。保持其他条件不变,每次向容积为2L的反应器中充入含2.0mlNO、2.0mlSO2的模拟烟气和4.0mlO3,改变温度,反应相同时间t0min后,体系中NO和SO2的转化率如图2所示: ①Q点时反应开始至t0min内v(SO2)=_____________________。②由图可知相同温度下(温度小于300℃)NO的转化率远高于SO2,其原因可能是__________________________。③若反应达到平衡后,缩小容器的体积,则NO和SO2转化率_______(填“增大”“减少”或“不变”)。④假设100℃时,P、Q均为平衡点,此时发生分解反应的O3占充入O3总量的10%,体系中O3的物质的量是_______ml,反应I的平衡常数Kc=_______。
反应Ⅰ的活化能小于反应Ⅱ ,相同条件下反应更快
(4)在一定条件下,CO可以去除烟气中的SO2,其反应原理为2CO+SO2=2CO2+S。其他条件相同,以γ-Al2O3(一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明,γ-Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2的去除率随反应温度的变化如图3所示。240℃以后,随着温度的升高,SO2去除率迅速增大的主要原因是_________________________________________________。
温度升高,催化剂活性增强,反应速率加快
4.(2023·广东省梅州市二模)除去废水中Cr(Ⅵ)的方法有多种。请按要求回答下列问题。(1)室温下,含Cr(Ⅵ)的微粒在水溶液中存在如下平衡:H2CrO4(aq)⇌H+(aq)+ HCrO4-(aq) ΔH1HCrO4-(aq)⇌H+(aq)+ CrO42-(aq) ΔH22HCrO4-(aq)⇌Cr2O72-(aq)+H2O(l) ΔH3①室温下,反应2H+(aq)+ 2CrO42-(aq)⇌Cr2O72-(aq)+H2O(l)的ΔH=_________________(用含ΔH1、ΔH2或ΔH3的代数式表示)。②室温下,初始浓度为1.0ml·L-1的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示。 根据A点数据计算反应2CrO42-+2H+ ⇌Cr2O72-+H2O的K=_________,下列关于该反应的说法不正确的是_________。A.加水稀释,平衡右移,K值增大B.若达到A点的时间为5s,则C.若升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH>0
(2) NaHSO3与熟石灰除Cr(VI)法:向酸性废水中加入NaHSO3,再加入熟石灰,使Cr3+沉淀。①实验中的NaHCO3作用是____________________________________。②Cr(Ⅲ)在水溶液中的存在形态分布如图所示。当pH>12时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为____________________________。
将Cr(Ⅵ)还原为Cr(III)
Cr(OH)3+OH-=[Cr(OH)4]-
(3)微生物法:①用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水时,Cr(Ⅵ)去除率随温度的变化如图所示。55℃时,Cr(Ⅵ)的去除率很低的原因是_____________________________________________________。 ②水体中,Fe合金在SRB存在条件下腐蚀的机理如图所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为Fe2+,H2O得到电子转化为H,__________________________________________________。
55℃时,硫酸盐还原菌发生变性,几乎失去活性
SO42-被H还原为S2-,S2-与Fe2+结合为FeS
(4)可用电解法将废水中铬酸钾溶液制成重铬酸钾,其工作原理如图所示: ①该制备过程总反应的化学方程式为_______________________________________。②电解一段时间后,阳极区溶液中K+的物质的量由aml变成bml,则生成的重铬酸钾的物质的量为___________ml。
专题10++化学工艺流程(题型突破)(课件)-2024年高考化学二轮复习讲练测(新教材新高考): 这是一份专题10++化学工艺流程(题型突破)(课件)-2024年高考化学二轮复习讲练测(新教材新高考),共60页。PPT课件主要包含了PARTONE等内容,欢迎下载使用。
适用于新高考新教材2024版高考化学二轮复习大题突破练3化学反应原理综合题课件: 这是一份适用于新高考新教材2024版高考化学二轮复习大题突破练3化学反应原理综合题课件,共47页。PPT课件主要包含了H2O,sp3,催化剂的中间产物使,CH3CHO,p1p2p3等内容,欢迎下载使用。
2022-2023 高考化学 专题辅导 题型突破(二) 化学反应原理综合题课件PPT: 这是一份2022-2023 高考化学 专题辅导 题型突破(二) 化学反应原理综合题课件PPT,共60页。












