





专题08+水溶液中的离子反应与平衡(课件)-2024年高考化学二轮复习讲练测(新教材新高考)
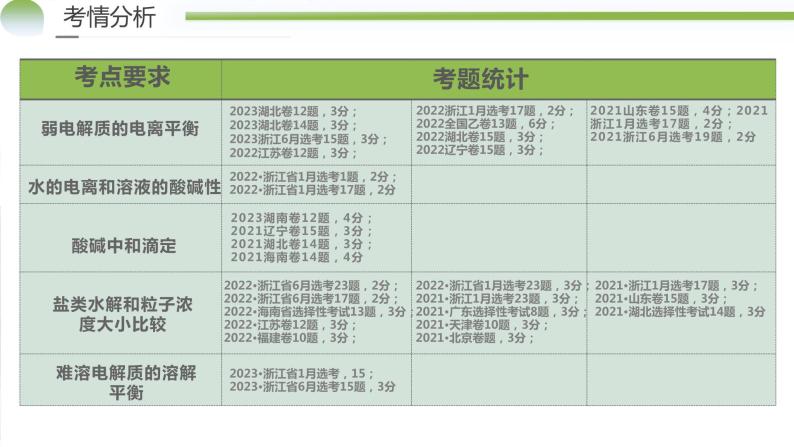
展开考点要求考题统计考情分析物质的组成、性质、分类2023**卷**题,**分2022**卷**题,**分2021**卷**题,**分……传统文化中的性质与变化2023**卷**题,**分2022**卷**题,**分2021**卷**题,**分
水的电离和溶液的酸碱性
2022·浙江省1月选考1题,2分;2022·浙江省1月选考17题,2分
2023湖南卷12题,4分;2021辽宁卷15题,3分;2021湖北卷14题,3分;2021海南卷14题,4分
盐类水解和粒子浓度大小比较
2022·浙江省1月选考23题,3分;2021•浙江1月选考23题,3分;2021•广东选择性考试8题,3分;2021•天津卷10题,3分;2021•北京卷题,3分;
2022·浙江省6月选考23题,2分;2022·浙江省6月选考17题,2分;2022•海南省选择性考试13题,3分;2022•江苏卷12题,3分;2022•福建卷10题,3分;
2021•浙江1月选考17题,3分;2021•山东卷15题,3分;2021•湖北选择性考试14题,3分
2023•浙江省1月选考,15;2023•浙江省6月选考15题,3分
1.高考对水溶液中的离子平衡重点考查方向有:(1)中和滴定图像分析及有关计算;(2)微粒浓度关系判断;(3)沉淀溶解平衡及溶度积常数的应用;(4)溶液中的离子反应(离子共存和离子推断);(5)结合图像考查弱电解质的电离和盐类的水解;2.考查方式:选择题某一选项中以图像或文字的形式考查,填空题中结合化学反应原理综合考查。
1.预计2024年会延续以曲线图的形式进行综合考查,利用平衡移动原理分析外界条件改变对溶液中电离平衡、水解平衡、难溶电解质的溶解平衡的影响,以及溶度积的相关计算;2.高考考查主流内容:溶液中离子浓度的大小比较、沉淀的溶解平衡和转化、多元弱酸弱碱分步电离平衡、多元弱酸弱碱离子的水解、化学反应速率。
选材热点如下:1.安全与健康——人体必需的营养元素;重金属对人体的危害;食品添加剂;有关化学与健康方面的材料等。2.环境保护新进展——“雾霾”的产生、危害和治理;工业“三废”和生活垃圾的处理;废电池对饮用水和土壤的污染;绿色化学在工农业生产中的导向作用等。3.新能源的使用——新型的燃料电池、高能绿色电池;新能源开发利用的新进展。4.新型无机非金属材料和有机高分子材料在社会、生活中的应用等。5.涉及碳中和、碳达峰的知识。
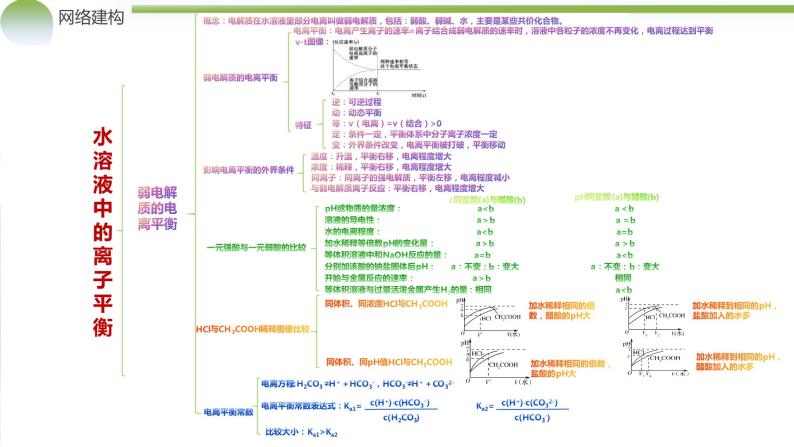
影响电离平衡的外界条件
电离平衡:电离产生离子的速率=离子结合成弱电解质的速率时,溶液中各粒子的浓度不再变化,电离过程达到平衡
概念:电解质在水溶液里部分电离叫做弱电解质,包括:弱酸、弱碱、水,主要是某些共价化合物。
一元强酸与一元弱酸的比较
c同盐酸(a)与醋酸(b)
pH同盐酸(a)与醋酸(b)
等:v(电离)=v(结合)>0
定:条件一定,平衡体系中分子离子浓度一定
变:外界条件改变,电离平衡被打破,平衡移动
温度:升温,平衡右移,电离程度增大
浓度:稀释,平衡右移,电离程度增大
同离子:同离子的强电解质,平衡左移,电离程度减小
与弱电解质离子反应:平衡右移,电离程度增大
同体积、同浓度HCl与CH3COOH
同体积、同pH值HCl与CH3COOH
pH或物质的量浓度: a溶液的导电性: a>b a=b
水的电离程度: a加水稀释等倍数pH的变化量: a>b a>b
等体积溶液中和NaOH反应的量: a=b a分别加该酸的钠盐固体后pH: a:不变;b:变大 a:不变;b:变大
开始与金属反应的速率: a>b 相同
等体积溶液与过量活泼金属产生H2的量:相同 aHCl与CH3COOH稀释图像比较
加水稀释相同的倍数,醋酸的pH大
加水稀释到相同的pH,盐酸加入的水多
加水稀释相同的倍数,盐酸的pH大
加水稀释到相同的pH,醋酸加入的水多
电离方程:H2CO3 ⇌H++HCO3-,HCO3-⇌H++CO32-
电离平衡常数表达式:Ka1= Ka2=
比较大小:Ka1>Ka2
酸碱中和滴定的概念:用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的方法
溶液中H+或OH-的来源分析
水的电离:H2O+H2O ⇌H3O++OH-,可简写为H2O ⇌H++OH-
水的离子积常数:Kw=c(H+)·c(OH-)
①室温下:Kw=1×10-14。②影响因素:只与温度有关,升高温度,Kw增大。③适用范围:Kw不仅适用于纯水,也适用于稀的电解质水溶液。④Kw揭示了在任何水溶液中均存在H+和OH-,只要温度不变,Kw不变
酸溶液:溶液中OH-全来自水电离,水电离:c(H+)=c(OH-)
碱溶液:溶液中H+全来自水电离,水电离:c(H+)=c(OH-)
水解呈酸性或碱性的盐溶液:pH=5的NH4Cl溶液中,H+全来自水电离,水电离:c(H+)=10-5 ml·L-1 pH=12的Na2CO3溶液中,OH-全来自水电离,水电离:c(OH-)=10-2 ml·L-1
酸碱中和滴定的原理:c待=
酸碱中和滴定的关键:(1)准确测定酸、碱体积;(2)选取适当指示剂,准确判断滴定终点。
酸碱中和滴定的实验用品
酸碱中和滴定的实验操作
仪器:酸式滴定管,碱式滴定管、滴定管夹、铁架台、锥形瓶
试剂:标准液、待测液、指示剂、蒸馏水
终点判断:等到滴入最后一滴反应液,指示剂变色,且在半分钟内不能恢复原来的颜色,视为滴定终点,并记录标准液的体积。
数据处理:按上述操作重复2~3次,求出用去标准盐酸体积的平均值,根据原理计算
洗:蒸馏水洗涤滴定管2-3次
润:待盛液润洗滴定管2-3次
装:滴定管装液至“0”刻度以上2-3mL处
排:调活塞使液面于“0”刻度或以下某刻度处
试剂:常见用于滴定的氧化剂有KMnO4、K2Cr2O7等;常见用于滴定的还原剂有亚铁盐、草酸、维生素C等。
指示剂:①氧化还原指示剂; ②专用指示剂,如在碘量法滴定中,可溶性淀粉溶液遇碘标准溶液变蓝; ③自身指示剂,如高锰酸钾标准溶液滴定草酸时,滴定终点为溶液由无色变为浅红色。
原理:以氧化或还原剂为滴定剂,滴定具有还原或氧化性物质,或滴定本身并无还原性或氧化性,但能与某些还原剂或氧化剂反应的物质。
概念:利用沉淀反应进行滴定、测量分析;应用最多的是银量法,即利用Ag+与卤素离子的反应来测定Cl-、Br-、I-浓度。
原理:滴定剂与被滴定物反应的生成物溶解度要比滴定剂与指示剂反应的生成物溶解度小,用AgNO3溶液测Cl-时常以CrO42-为指示剂,因为AgCl比AgCrO4更难溶。
电解质溶液中的守恒关系
1)判断溶液的酸碱性:FeCl3显酸性,原因是Fe3++3H2O ⇌Fe(OH)3+3H+2)配制或贮存易水解的盐溶液:配制CuSO4溶液时,加入少量H2SO4,防止Cu2+水解3)判断盐溶液蒸干产物:蒸干AlCl3[Al(NO3)3、FeCl3、AlBr3类似]溶液,挥发出HCl气体,平衡右移,得AI(OH)3,灼烧得Al2O34)胶体的制取:制Fe(OH)3胶体:Fe3++3H2O==Fe(OH)3(胶体)+3H+5)物质的提纯:除去MgCl2溶液中的Fe3+,可加入MgO、镁粉或Mg(OH)2或MgCO36)离子共存的判断:Al3+与AlO2-、CO32-、HCO3-、S2-、HS-等因相互促进水解而不共存7)泡沫灭火器原理:成分为NaHCO3与Al2(SO4)3,发生反应为Al3++3HCO3-=Al(OH)3↓+3CO2↑8)作净水剂:明矾可作净水剂,原理为A3++3H2O ⇌Al(OH)3(胶体)+3H+9)化肥的使用:铵态氮肥与草木灰不得混用:2NH4++CO32-=2NH3↑+CO2↑+H2O
1)判断弱酸(弱碱)的相对强弱:越弱越水解;2)相同条件下:正盐>相应酸式盐,如CO32->HCO3-;3)相互促进水解的盐>单水解的盐>相互抑制水解的盐。
1)电荷守恒:阳离子带正电荷数=阴离子带负电荷数 如NaHCO3溶液中:n(Na+)+n(H+)=n(HCO3-)+2n(CO32-)+n(OH-)2)物料守恒:离子发生变化变成其它离子或分子,但离子或分子中某种特定元素的原子的总数不会改变。 如NaHCO3溶液中:n(Na+)∶n(C)=1∶1,推出:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)3)质子守恒:分子或离子得到或失去质子(H+)的物质的量相等。 如在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3·H2O、OH-、CO32-为失去质子后的产物 :则 c(H3O+)+c(H2CO3)===c(NH3·H2O)+c(OH-)+c(CO32-)
1)多元弱酸,如H3PO4溶液:c(H+)>c(H2PO4-)>c(HPO42-)>c(PO43-)。2)多元弱酸的正盐溶液,如Na2CO3溶液:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)。3)不同溶液同离子浓度比较:如同物质的量浓度溶液中 a.NH4Cl b.CH3COONH4 c.NH4HSO4 c(NH)由大到小的顺序:c>a>b。4)混合溶液中各离子浓度的比较:如同浓度的NH4Cl溶液和氨水等体积混合,氨水电离程度大于NH4+水解程度,溶液中离子浓度顺序为:c(NH4+)>c(Cl-)>c(OH-)>c(H+) 。
判断在一定条件下沉淀能否生成或溶解①Qc>KSP:溶液过饱和,有沉淀析出②Qc=KSP:溶液饱和,处于平衡状态③Qc<KSP:溶液未饱和,无沉淀析出
以AmBn(s)⇌ mAn+(aq)+nBm-(aq)为例
概念:沉淀溶解的平衡常数
表达式:KSP(AmBn)=cm(An+)·cn(Bm-),式中的浓度都是平衡浓度
概念:溶液中有关离子浓度幂的乘积
表达式:Qc(AmBn)=cm(An+)·cn(Bm-),式中的浓度是任意浓度
外因:①浓度:加水稀释,平衡向溶解方向移动,但KSP不变。 ②温度:绝大多数难溶盐溶解是吸热过程,升高温度,平衡向溶解方向移动,KSP增大。 ③其他:向平衡体系中加入可与体系中某些离子反应生成更难溶物质或更难电离物质或气体的离子时,平衡向溶解方向移动,但KSP不变。
内因:难溶物质本身的性质,这是主要因素
(1)沉淀的生成①调节pH法:如除去NH4Cl溶液中的FeCl3杂质,可加氨水调节pH至7~8,离子方程式为Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+②沉淀剂法:如用H2S沉淀Cu2+,离子方程式:H2S+Cu2+=CuS↓+2H+(2)沉淀的溶解①酸溶解法:如CaCO3溶于盐酸,离子方程式:CaCO3+2H+=Ca2++H2O+CO2↑②盐溶液溶解法:如Mg(OH)2溶于NH4Cl溶液,离子方程式:Mg(OH)2+2NH4+=Mg2++2NH3·H2O③氧化还原溶解法:如不溶于盐酸的硫化物Ag2S溶于稀HNO3。④配位溶解法:如AgCl溶于氨水,离子方程式:AgCl+2NH3·H2O=[Ag(NH3)2]++Cl-+2H2O。(3)沉淀的转化①实质:沉淀溶解平衡的移动(沉淀的溶解度差别越大,越容易转化)。②应用:锅炉除垢、矿物转化等。
1.(2022•湖北省选择性考试,12)根据酸碱质子理论,给出质子(H+)的物质是酸,给出质子的能力越强,酸性越强。已知:N2H5++NH3=NH4++N2H4,N2H4+CH3COOH=N2H5++CH3COO-,下列酸性强弱顺序正确的是( )A.N2H5+>N2H4>NH4+B.N2H5+>CH3COOH>NH4+C.NH3>N2H4>CH3COO-D.CH3COOH>N2H5+>NH4+
CH3COOH>N2H5+
2.(2021•浙江6月选考)某同学拟用pH计测定溶液pH以探究某酸HR是否为弱电解质。下列说法正确的是( ) A.25℃时,若测得0.01ml·Lˉ1NaR溶液pH=7,则HR是弱酸B.25℃时,若测得0.01ml·Lˉ1HR溶液pH>2且pH<7,则HR是弱酸C.25℃时,若测得HR溶液pH= a,取该溶液10.0mL,加蒸馏水稀释至100.0mL,测得pH= b,b-a<1,则HR是弱酸 D.25℃时,若测得NaR溶液pH= a,取该溶液10.0mL,升温至50℃,测得pH= b,a>b,则HR是弱酸
3.(2022·浙江省1月选考,17)已知25℃时二元酸H2A的Ka1=1.3×10-7,Ka2=7.1×10-15。下列说法正确的是( )A.在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者B.向0.1ml·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013%C.向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-)D.取pH=a的H2A溶液10mL,加蒸馏水稀释至100mL,则该溶液pH=a+1
4.(2021•浙江1月选考,17)25℃时,下列说法正确的是( )A.NaHA溶液呈酸性,可以推测H2A为强酸B.可溶性正盐BA溶液呈中性,可以推测BA为强酸强碱盐C.0.010 ml·L-1、0.10ml·L-1的醋酸溶液的电离度分别为α1、α2,则α1<α2D.100 mL pH=10.00的Na2CO3溶液中水电离出H+的物质的量为1.0×10-5ml
5.(2022•全国乙卷)常温下,一元酸HA的Ka(HA)=1.0×10-3。在某体系中,H+与A-离子不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。设溶液中c总(HA)=c(HA)+c(A-),当达到平衡时,下列叙述正确的是( )A.溶液Ⅰ中c(H+)=c(OH-)+c(A-)B.溶液Ⅱ中的HA的电离度 为C.溶液Ⅰ和Ⅱ中的c(HA)不相等D.溶液Ⅰ和Ⅱ中的c总(HA)之比为10-4
电解质在水溶液里部分电离叫做弱电解质,包括:弱酸、弱碱、水,主要是某些共价化合物。
电离产生离子的速率=离子结合成弱电解质的速率时,溶液中各粒子的浓度不再变化,电离过程达到平衡。
(1)稀醋酸加水稀释,溶液中不一定所有的离子浓度都减小。因温度不变,Kw=c(H+)·c(OH-)是定值,加水稀释c(H+)减小,c(OH-)增大。(2)电离平衡右移,电解质分子的浓度不一定减小,离子的浓度不一定增大,电离程度也不一定增大。(3)加H2O稀释弱电解质的电离程度增大,离子浓度不一定减小,可能先增大后减小。
pH或物质的量浓度:
溶液的导电性:
水的电离程度:
加水稀释等倍数pH的变化量:
等体积溶液中和NaOH反应的量:
分别加该酸的钠盐固体后pH:
开始与金属反应的速率:
等体积溶液与过量活泼金属产生H2的量:
a<b
a=b
a:不变;b:变大
反映酸碱性的相对强弱,电离平衡常数越大,电离程度越大。多元弱酸的电离以第一步电离为主,各级电离平衡常数的大小差距较大。
NH3·H2O⇌NH4++OH-
Kb=1.8×10-5
CH3COOH⇌CH3COO-+H+
Ka=1.8×10-5
HClO⇌H++ClO-
Ka=3.0×10-8
电离平衡常数:电离时吸热过程,只与温度有关,升高温度,K值增大。
同c、同V的HCl 与 CH3COOH比较
c(H+) pH 中和碱的能力 与活泼金属反应产生H2的量 开始与金属反应的速率
HCl 与 CH3COOH
同pH、同V的HCl 与 CH3COOH比较
c(H+) pH 中和碱的能力 与活泼金属反应产生H2的量 开始与金属反应的速率
HCl : 大 小 相同 相同 大CH3COOH: 小 大 相同 相同 小
HCl : 相同 小 小 少 相同CH3COOH: 相同 大 大 多 相同
1.能证明亚硝酸是弱酸的实验事实是( )A.HNO2的酸性比CH3COOH强B.0.1 ml·L-1NaNO2溶液的pH大于7C.HNO2溶液与Na2CO3反应生成CO2D.HNO2不稳定可分解成NO和NO2
2.(2024·湖北腾云联盟高三联考)常温下,一种解释乙酰水杨酸(用HA表示,Ka=1.0×10-30)药物在人体吸收模式如下:假设离子不会穿过组织薄膜,而未电离的HA则可自由穿过该膜且达到平衡。下列说法错误的是( )A.血浆中HA电离程度比胃中大B.在胃中,C.在血浆中,D.总药量之比
3.(2023·北京市牛栏山一中高三检测)室温下,对于1L0.1mlֺ·L-1醋酸溶液,下列判断正确的是( )A.该溶液中CH3COO-的粒子数为6.02×1022个B.加入少量CH3COONa固体后,溶液的pH升高C.滴加NaOH溶液过程中,c(CH3COO-)与c(CH3COOH)之和始终为0.1ml/LD.与Na2CO3溶液反应的离子方程式为CO32-+2H+=H2O+CO2↑4.醋酸溶液中存在电离平衡:CH3COOH ⇌H++CH3COO-,下列叙述不正确的是( )A.0.1 ml/L 的CH3COOH 溶液加水稀释或加热均可使CH3COO-的物质的量增多B.0.1 ml/L 的CH3COOH 溶液加水稀释,c(CH3COO-)/[c(CH3COOH) ·c(OH-)]不变C.向0.1 ml/L CH3COOH溶液中加入少量纯醋酸,平衡向右移动,电离程度增大D.0.1 ml/L CH3COOH溶液加水稀释后,溶液中c(CH3COOH)/c(CH3COO-)的值减小
5.(2023·浙江省宁波市高三选考模拟考试)下列说法正确的是( )A.25℃时,将pH=5的醋酸溶液与pH=5的盐酸等体积混合,混合后溶液pH>5B.25℃时,等浓度的盐酸与醋酸分别稀释相同倍数,稀释后溶液pH:盐酸<醋酸C.25℃时,等体积、等pH的盐酸与醋酸分别用等浓度的NaOH溶液中和,盐酸消耗NaOH溶液多D.25℃时,pH=3的一元酸HA溶液与pH=11的一元碱MOH溶液等体积混合后溶液呈酸性,则HA是强酸6.已知某温度下CH3COOH和NH3·H2O 的电离常数相等,现向10 mL浓度为0.1 ml·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )A.水的电离程度始终增大B.c(NH4+)/c(NH3·H2O)先增大再减小C.c(CH3COOH)与c(CH3COO-)之和始终保持不变D.当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-)
7.(2023·浙江省诸暨市高三适应性考试)已知H2R为二元弱酸,Ka1(H2R)=5.4×10-2,Ka2(H2R)=5.4×10-5。室温下,下列说法不正确的是( )A.0.1ml/L NaHR溶液pH<7B.用NaOH溶液中和一定量的H2R溶液至呈中性时,溶液中c(HR-)<c(R2-)C.0.1ml/L H2R溶液:0.2ml/L+c(OH-)=c(H+)+c(H2R)+c(HR-)D.0.01ml/L的H2R溶液与pH=12的NaOH溶液完全中和时,消耗酸与碱溶液的体积比为1∶2
8.已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 ml·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )A.水的电离程度始终增大B. 先增大再减小C.c(CH3COOH)与c(CH3COO-)之和始终保持不变D.当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-)
9.(2024·天津河西高三期中)下列有关25℃时1ml/LNaHSO3溶液(H2SO3的Ka1=10-2,Ka2=10-8)的说法正确的是( )A.NaHSO3= Na++H++SO32-B.c(HSO3-)>c(SO32-)C.c(OH―)=c(H+) +2c(H2SO3)+c(HSO3-)D.n(SO32-)+n(HSO3-)+n(H2SO3)=1ml
10.(2024·河北石家庄高三第二次调研)已知25℃时,三种酸的电离常数为Ka(CH3COOH)=1.75×10-5,Ka(HCN)=6.2×10-10,Ka1(H2CO3)=4.5×10-7,Ka2(H2CO3)=4.7×10-11。下列说法正确的是( )A.醋酸滴入NaCN溶液的离子方程式为H++CN-=HCNB.NaHCO3在水溶液中的电离方程式为NaHCO3=Na++H++CO32-C.Na2CO3溶液中滴加HCN的离子方程式为CO32-+2HCN=2CN-+H2O+CO2↑D.结合质子的能力:CH3COO-
12.(2024·河南郑州·高三河南省实验中学校考期中)常温下,pH均为2、体积V0均为HA、HB、HC的溶液,分别加水稀释至体积为V,溶液pH随 的变化关系如图所示,下列叙述错误的是( )A.常温下:Ka(HB) > Ka(HC)B.HC的电离度:a点 < b点C.当 时,升高温度, 减小D.恰好中和pH均为2、体积均为V0的三种酸溶液,消耗的NaOH溶液一样多
13.(2023·河北省部分学校高三联考)在25℃下,稀释CH3COOH和某酸HA的溶液,溶液pH变化的曲线如图所示,其中V1表示稀释前的体积,V2表示稀释后的体积,下列说法错误的是( )A.m<4,两种酸溶液pH相同时,c(HA)<c(CH3COOH)B.a、b两点中,水的电离程度a小于bC.25℃时,等浓度的CH3COONa与NaA溶液中,c(A-)<c(CH3COO-)D.曲线上a、b两点中, 的比值一定相等
1.(2022·浙江省1月选考,1)水溶液呈酸性的盐是( )A.NH4Cl B.BaCl2C.H2SO4 D.Ca(OH)22.(2022·浙江省1月选考,17)已知25℃时二元酸H2A的Ka1=1.3×10-7,Ka2=7.1×10-15。下列说法正确的是( )A.在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者B.向0.1ml·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013%C.向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-)D.取pH=a的H2A溶液10mL,加蒸馏水稀释至100mL,则该溶液pH=a+1
初步判断最终溶液的酸碱性
先求最终溶液的n(H+),再求c(H+)
先求最终溶液的c(OH-),再根据Kw,求c(H+)
pH=-lgc(H+)
溶液中H+或OH-的来源分析:
溶液酸碱性判断中的常见误区
如pH=7的溶液在温度不同时,可能呈酸性或碱性,也可能呈中性。
如强酸和弱碱恰好中和时,溶液显酸性;强碱和弱酸恰好中和时,溶液显碱性,强酸和强碱恰好中和时,溶液显中性。
先润湿,若待测液为碱性溶液:偏小;若待测液为酸性溶液:偏大;则所测液为中性溶液:没有误差。
1.(2024·宁夏固原高三期中)在水电离出的c (H+)=10-14ml/L的溶液中,一定能大量共存的离子组是( )A.K+、Na+、HCO3-、Cl-B.K+、AlO2-、Br-、Cl-C.Na+、Cl-、NO3-、SO42-D.Al3+、NH4+、Cl-、SO42-
题型一 水的电离平衡概念理解
2.25 ℃时,Kw=1.0×10-14;100 ℃时,Kw=1×10-12,下列说法正确的是( )A.100 ℃时,pH=10的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的pH=7B.25 ℃时,0.2 ml·L-1 Ba(OH)2溶液和0.2 ml·L-1 HCl等体积混合,所得溶液的pH=7C.25 ℃时,0.2 ml·L-1 NaOH溶液与0.2 ml·L-1 CH3COOH恰好中和,所得溶液的pH=7D.25 ℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的pH>7
3.(2023·上海市宜川中学高三期中)已知温度T时水的离子积常数为Kw,该温度下,将浓度为a ml/L的一元酸HA与b ml/L的一元碱BOH等体积混合,可判断溶液呈中性的依据是( )A.a=bB.混合溶液中,c(H+)+c(B+)=c(OH﹣)+c(A﹣)C.混合溶液中,c(H+)=D.混合溶液的pH=7
4.已知NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42-。某温度下,向c(H+)=1×10-6 ml·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的c(H+)=1×10-2 ml·L-1。下列对该溶液的叙述不正确的是( )A.该温度高于25 ℃B.由水电离出来的H+的浓度为1×10-10 ml·L-1C.加入NaHSO4晶体抑制水的电离D.取该溶液加水稀释100倍,溶液中的c(OH-)减小
5.(2024·湖北恩施教育联盟统考)一些非水溶剂,会发生类似水的自耦解离:2SO2⇌SO2++SO32-,2NH3⇌NH4++NH2-,N2O4⇌NO++NO3-;据此推测下列反应方程式书写错误的是( )A.NOCl+ AgNO3=N2O3+ AgClO (液态N2O4中)B.SOCl2 +Cs2SO3 =2CsCl2+2 SO2 (液态SO2中)C.NH4Cl+ NaNH2 = NaCl+2NH3 (液氨中)D.4NH3+ COCl2=CO(NH2)2+2NH4Cl
6.一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )A.升高温度,可能引起由c向b的变化B.该温度下,水的离子积常数为1.0×10-13C.该温度下,加入FeCl3可能引起由b向a的变化D.该温度下,稀释溶液可能引起由c向d的变化
7.如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )A.两条曲线间任意点均有c(H+)·c(OH-)=Kw B.M区域内任意点均有c(H+)<c(OH-)C.图中T1<T2 D.XZ线上任意点均有pH=7
题型二 水的电离平衡曲线
8.(2022·四川省凉山州高三第一次诊断测试)水的电离平衡曲线如图所示,下列说法正确的是( )A.图中温度T1>T2B.T2温度时,将pH=10的NaOH溶液与pH=3的H2SO4溶液混合,若混合溶液呈中性,则NaOH溶液与H2SO4溶液的体积比为1:10C.b点到c点可以通过温度不变,在水中加入适量的CH3COONaD.图中五个点的Kw的关系为b>c>a>d=e
9.一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )A.升高温度,可能引起由c向b的变化B.该温度下,水的离子积常数为1.0×10-13C.该温度下,加入FeCl3可能引起由b向a的变化D.该温度下,稀释溶液可能引起由c向d的变化
10.常温下,向20.00 mL 0.1 ml·L-1 HA溶液中滴入0.1 ml·L-1 NaOH溶液,溶液中由水电离出的氢离子浓度的负对数[-lg c(H+)水]与所加NaOH溶液体积的关系如图所示,下列说法中不正确的是( )A.常温下,Ka(HA)约为10-5 B.M、P两点溶液对应的pH=7C.b=20.00 D.M点后溶液中均存在c(Na+)>c(A-)
1.(2023•湖南卷,12)常温下,用浓度为0.0200ml·L-1的NaOH标准溶液滴定浓度均为0.0200ml·L-1的HCl和CH3COOH的混合溶液,滴定过程中溶液的pH随( )的变化曲线如图所示。下列说法错误的是( )
A.Ka(CH3COOH)约为10-4.76B.点a:c(Na+)=c(Cl-)=c(CH3COOH)+c(CH3COO-)C.点b:c(CH3COOH)
3.(2021•湖北选择性考试,14)常温下,已知H3PO3溶液中含磷物料的浓度之和为0.1 ml·L-1,溶液中各含磷物种的pc-pOH关系如图所示。图中pc表示各含磷物种的浓度负对数(pc=-lgc),pOH表示OH-的浓度负对数[pOH=-lgc(OH-)];x、y、z三点的坐标:x(7.3,1.3)、y(10.0,3.6)、z(12.6,1.3)。下列说法正确的是( ) A.曲线①表示pc(H3PO3)随pOH的变化B.H3PO3的结构简式为C.pH=4的溶液中:c(H2PO2-)<0.1 ml·L-1-2c(HPO32-)D.H3PO3+HPO32- ⇌2H2PO3-的平衡常数K>1.0×105
4.(2021•海南选择性考试,14) 25℃时,向·L-1的NaHCO3溶液中滴加.1000ml·L-1的盐酸,溶液的pH随加入的盐酸的体积V变化如图所示。下列有关说法正确的是( )A.a点,溶液pH>7是由于HCO3-水解程度大于电离程度B.b点,c(Na+)=c(HCO3-)+2c(CO32-)+c(Cl-)C.c 点,溶液中的H+主要来自HCO3-的电离D.d点,c(Na+)= c(Cl-)= 0.1000ml·L-1
5.(2020•浙江1月选考)室温下,向20.00 mL 0.1000ml·L−1盐酸中滴加0.1000ml·L−1 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg5=0.7。下列说法不正确的是( )A.NaOH与盐酸恰好完全反应时,pH=7B.选择变色范围在pH突变范围内的指示剂,可减小实验误差C.选择甲基红指示反应终点,误差比甲基橙的大D.V(NaOH)=30.00 mL时,pH=12.3
强酸与强碱间进行滴定时,用甲基橙和酚酞都可以
例如:用NaOH溶液滴定醋酸
滴定终点为碱性时,用酚酞作指示剂
滴定终点为酸性时,用甲基橙作指示剂
例如:用标准的Na2SO3滴定KMnO4溶液时,KMnO4颜色恰好褪去时即为滴定终点
并不是所有的滴定都须使用指示剂
原理:以氧化或还原剂为滴定剂,滴定还原或氧化性物质,或滴定本身并无还原性或氧化性,但能与某些还原剂或氧化剂反应的物质。
1.下列有关滴定的说法正确的是( )A.用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中混有NaOH杂质,则结果偏低B.用c1 ml·L-1酸性高锰酸钾溶液滴定V2 mL未知浓度的H2C2O4溶液,至滴定终点用去酸性高锰酸钾溶液体积为V1 mL,则H2C2O4溶液的浓度为 ml·L-1C.用未知浓度的盐酸滴定已知浓度的NaOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏低D.用25 mL滴定管进行中和滴定时,用去标准液的体积为21.7 mL
题型一 滴定反应实验操作
2.下列滴定反应中,指示剂使用正确的是( )A.用H2O2溶液滴定KI溶液,淀粉做指示剂B.用酸性KMnO4标准溶液滴定NaHSO3溶液以测量其浓度,用甲基橙做指示剂C.用标准FeCl3溶液滴定KI溶液,KSCN溶液做指示剂D.用强酸标准溶液滴定测量弱碱浓度,用酚酞做指示剂
3.用标准的KOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是( )A.配制标准溶液的固体KOH中混有NaOH杂质B.滴定到终点读数时,仰视滴定管的刻度,其他操作正确C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液4.用已知浓度的盐酸滴定未知浓度的NaOH溶液,选用酚酞作指示剂,下列操作会导致测定结果偏低的是( )。A.酸式滴定管未润洗就装标准液滴定B.锥形瓶未用待测液润洗C.读取标准液体积时,滴前仰视,滴定到终点后俯视D.滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失
5.下列有关滴定操作的说法正确的是( )A.用25 mL滴定管进行中和滴定时,用去标准液的体积为21.7 mLB.用标准的KOH溶液滴定未知浓度的盐酸,洗净碱式滴定管后直接取标准KOH溶液进行滴定,则测定结果偏低C.用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中含有NaOH杂质,则测定结果偏高D.用未知浓度的盐酸滴定标准的KOH溶液时,若读取读数,滴定前仰视,滴定到终点后俯视,会导致测定结果偏高
6.白云石[CaMg(CO3)2]中钙含量测定常用KMnO4滴定的方法。具体做法是将其酸溶后转化为草酸钙,过滤后用酸溶解,再用KMnO4滴定。则下列说法错误的是( )A.KMnO4滴定草酸发生反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2OB.实验过程中两次用酸溶解,均需使用稀盐酸C.KMnO4滴定草酸过程中,标准状况下每产生448mLCO2气体理论上转移0.02mle-D.滴定过程中若滴加KMnO4过快会发生反应4MnO4-+12H+=4Mn2++5O2↑+6H2O,将导致测定结果偏高
7.(2024·北京朝阳高三期中)分别向相同浓度的Na2CO3、NaHCO3溶液中逐滴加入盐酸,滴定过程中溶液的pH变化如下图,下列说法不正确的是( ) A.曲线①、②分别表示盐酸滴定Na2CO3、NaHCO3溶液的过程B.a、b、c点水的电离程度:a>b>cC.a、b、d点均满足:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH―) D.ab段和de段发生的主要反应均为:HCO3- +H+=CO2↑+H2O
8.(2024·河北石家庄高三第二次调研)某活动小组为测定样品中NaBH4的纯度,设计了如下的实验步骤:步骤l:取5.0gNaBH4样品(杂质不参与反应),将样品溶于NaOH溶液后配成500mL溶液,取25.00mL置于碘量瓶中,加入的KIO3溶液充分反应(反应为3NaBH4+4KIO3=3NaBO2+4KI+6H2O);步骤2:向步骤1所得溶液中加入过量的KI溶液,用稀硫酸调节pH,使过量KIO3转化为I2,冷却后在暗处放置数分钟;步骤3:向步骤2所得溶液中加入某种缓冲溶液调pH至5.0,加入几滴指示剂,用0.1000ml/L的Na2S2O3标准溶液滴定至终点,消耗标准溶液的体积为20.70mL(反应为I2+2Na2S2O3=2NaI+Na2S4O6)。下列说法正确的是( )A.NaBH4中H元素化合价为+1价B.步骤2反应的离子方程式为IO3-+I-+6H+=I2+3H2OC.步骤3中加入几滴酚酞作指示剂D.样品中NaBH4的纯度为64.47%
题型二 滴定反应实际运用
9.(2024·湖南高三联考)K2Cr2O7(重铬酸钾)是一种常见的氧化剂。以铬渣(主要成分为Cr2O3、Fe2O3等)为原料制备K2Cr2O7并测定其纯度。其步骤如下:步骤1:铬渣粉碎和Na2CO3均匀混合在空气中焙烧;步骤2:用水浸取焙烧渣,过滤,得到水浸液(含Na2CrO4);步骤3:向步骤2中水浸液加入BaCO3,过滤,得到BaCrO4;步骤4:向BaCrO4中加入NaHSO4溶液,过滤,得到浸出液(Na2Cr2O7)和浸渣(BaSO4);步骤5:向步骤4中浸出液加入KCl粉末,蒸发浓缩、降温结晶、过滤,得到K2Cr2O7;步骤6:准确称取mgK2Cr2O7产品溶于蒸馏水,加入适量稀硫酸,加入足量KI溶液(还原产物为Cr3+),用水稀释为250mL溶液,量取25.00mL稀释后溶液于锥形瓶中。用c ml•L-1Na2S2O3溶液滴定至终点,消耗VmL滴定液。滴定反应为I2+2S2O32-=2I-+S4O62-下列叙述错误的是( ) A.步骤1中制备1mlNa2CrO4消耗0.75ml氧气B.步骤3目的是除去杂质,富集铬元素C.步骤6中KI作用是Cr2O72-+6I-+14H+=2Cr3++3I2+7H2OD.K2Cr2O7产品纯度为为w= %
10.(2024·山东潍坊五县区高三阶段监测)乙二胺四乙酸(EDTA)可与金属离子形成稳定的配合物。常用EDTA测定水中钙含量(EDTA与钙反应时物质的量之比均为1∶1)。基本步骤如下:①EDTA标定:取10.00 mL 0.1 ml·L-1标准CaCl2溶液,加入3滴甲基橙溶液作指示剂,用已配制好的EDTA溶液滴定至终点,消耗EDTA溶液V1 mL。②钙提取:取一定质量的有机物,并用酸性KMnO4溶液氧化,再经萃取、反萃取将金属转移到水中,得到提取液。加入掩蔽剂(掩蔽除钙之外的金属)并将pH调至11.3。③EDTA滴定:取20.00mL提取液,加入指示剂钙黄绿素(钙与钙黄绿素生成能发出绿色荧光的配合物),在黑色背景下用标定后的EDTA溶液滴定至终点,消耗EDTA溶液V2 mL。根据上述实验原理,下列说法错误的是( )A.若对提取液的其他金属不进行掩蔽,测定的钙含量结果偏高B.EDTA标定时,滴定管尖嘴开始有气泡终点无气泡,会使钙含量测定结果偏高C.EDTA滴定若选用其他物质作指示剂,提取液的pH可能发生变化D.pH为11.3时,EDTA与钙的配合能力强于钙黄绿素与钙的配合能力
11.中华人民共和国国家标准(GB 27602011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。 图1 图2 (1)仪器A的名称是____________,水通入A的进口为______。(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为__________________________________。(3)除去C中过量的H2O2,然后用0.090 0 ml·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________g·L-1。(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:______________________________。
SO2+H2O2===H2SO4
改进措施:用不挥发强酸如硫酸代替盐酸(或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响)
12.某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请填写下列空白:(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛________________________________。(2)滴定终点的判断:____________________________________________。(3)某学生根据3次实验分别记录有关数据如表:
浅红色变为无色且半分钟内不恢复原色
12.根据表中数据该NaOH溶液的物质的量浓度为______________。(4)以下操作会导致测得的NaOH溶液浓度偏高的是______________。A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥C.酸式滴定管在滴定前有气泡,滴定后气泡消失D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数E.盛放碱液的碱式滴定管开始俯视读数,后来仰视读数(5)氧化还原滴定实验的原理与中和滴定相同(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。为测定某样品中所含晶体FeSO4•7H2O的质量分数,取晶体样品ag,溶于稀硫酸配成100.00mL溶液,取出20.00mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.2000ml•L-1KMnO4溶液20.00mL,所得晶体中FeSO4•7H2O的质量分数为_______________(用a表示)。
13.过氧化氢的水溶液适用于医用消毒、环境消毒和食品消毒。Ⅰ.过氧化氢性质探究实验(1)酸性条件下H2O2可将Fe2+转化成Fe3+,由此说明H2O2具有______性。(2)已知H2O2是一种二元弱酸,其中Ka1=2.20×10-12、Ka2=1.05×10-25,则H2O2的电离方程式为_________________________,常温下,1ml∙L-1的H2O2溶液的pH约为______。Ⅱ.过氧化氢含量的测定实验。某兴趣小组同学用0.1000ml∙L-1的酸性高锰酸钾标准溶液滴定试样中的过氧化氢,反应原理为2 MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑。(3)滴定达到终点的现象是________________________________________________________。(4)用移液管移取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗酸性高锰酸钾标准溶液的体积如表所示:计算试样中过氧化氢的浓度为______ml∙L-1。(5)若滴定前滴定管尖嘴处有气泡,滴定后消失,则测定结果______(填“偏高”“偏低”或“不变”)。
H2O2 ⇌H++HO2-、HO2-⇌H++O22-
锥形瓶内溶液恰好由无色变为浅紫色,且30秒内溶液不褪色
14.乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。该组同学的研究课题是:探究测定草酸晶体((H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++5CO2↑+8H2O。学习小组的同学设计了如下步骤用滴定的方法测定x值。①称取1.260 g纯草酸晶体,将其制成100.00mL水溶液为待测液。②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4。③用浓度0.1000ml·L-1为的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00mL。(1)上述步骤②中使用的锥形瓶是否需要用待测液润洗_______,(填“是”或“否”)滴定时,将酸性KMnO4标准液装入_______(填“酸式”或“碱式”)滴定管中。(2)本实验滴定达到终点的标志是_______。(3)通过上述数据,求得x=_______。(4)若滴定终点时俯视滴定管刻度,则由此测得的x值会_______(填偏“大”、“偏小”或“不变”)。(5)根据上述实验计算的数据可信性不强,为了提高实验的准确性,请写出改进措施_______。
当最后半滴KMnO4溶液滴入,溶液颜色恰好由无色变为浅红色,且半分钟不恢复至原来的颜色
重复操作②③步骤2-3次,取平均值
1.(2022·浙江省6月选考,23)25℃时,向20mL浓度均为0.1ml·L-1的盐酸和醋酸的混合溶液中逐滴加入0.1ml·L-1的NaOH溶液(醋酸的Ka=1.8×10-5;用0.1ml·L-1的NaOH溶液滴定20mL等浓度的盐酸,滴定终点的pH突跃范围4.3~9.7)。下列说法不正确的是( )A.恰好中和时,溶液呈碱性B.滴加NaOH溶液至pH=4.3的过程中,发生反应的离子方程式为:H++OH-=H2OC.滴定过程中,c(Cl-)=c(CH3COO-)+c(CH3COOH)D.pH=7时,c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
2.(2022·浙江省6月选考,17)25℃时,苯酚(C6H5OH)的Ka=1.0×10-10,下列说法正确的是( )A.相同温度下,等pH的C6H5ONa和CH3COONa溶液中,c (C6H5O-)>c(CH3COO-) B.将浓度均为0.1ml·L-1的C6H5ONa和NaOH溶液加热,两种溶液的pH均变大 C.25℃时,C6H5OH溶液与NaOH溶液混合,测得pH=10.00,则此时溶液中c (C6H5O-)= c (C6H5OH) D.25℃时,0.1ml·L-1的C6H5OH溶液中加少量C6H5ONa固体,水的电离程度变小
3.(2022•海南省选择性考试,13)NaClO溶液具有漂白能力,已知25℃时,Ka=(HClO)=4.0×10-8。下列关于NaClO溶液说法正确的是( )A.0.01ml/L溶液中,c(ClO-)<0.01ml/LB.长期露置在空气中,释放Cl2,漂白能力减弱C.通入过量SO2,反应的离子方程式为SO2+ClO-+H2O=HSO3-+HClOD.25℃,pH=7.0的NaClO和HClO的混合溶液中,c(HClO)>c(ClO-)=c(Na+)
4.(2022•江苏卷,12)一种捕集烟气中CO2的过程如图所示。室温下以0.1ml∙L-1KOH溶液吸收CO2,若通入CO2所引起的溶液体积变化和H2O挥发可忽略,溶液中含碳物种的浓度c总=c(H2CO3)+c(HCO3- )+c(CO32-)。H2CO3电离常数分别为Ka1=4.4×10-7、Ka2=4.4×10-11。下列说法正确的是( ) A.KOH吸收CO2所得到的溶液中:c(H2CO3)>c(HCO3-)B.KOH完全转化为K2CO3时,溶液中:c(OH-)= c(H+)+c(HCO3-)+c(H2CO3)C.KOH溶液吸收CO2,c总=0.1ml∙L-1溶液中:c(H2CO3)>c(CO32-)D.如图所示的“吸收”“转化”过程中,溶液的温度下降
5.(2022•福建卷,10)氨是水体污染物的主要成分之一,工业上可用次氯酸盐作处理剂,有关反应可表示为:①2NH3+3ClO-=N2↑+3Cl-+3H2O②NH3+4ClO-+OH-=NO3-+4Cl-+2H2O在一定条件下模拟处理氨氮废水:将1L0.006ml·L-1的氨水分别和不同量的NaClO混合,测得溶液中氨去除率、总氮(氨氮和硝氮的总和)残余率与NaClO投入量(用x表示)的关系如下图所示。下列说法正确的是( ) A.x1的数值为0.009B.x>x1时,c(Cl-)=4c(NO3-)C.x>x1时,x越大,生成N2的量越少D.X=x1时,c(Na+)+c(H+)+ c(NH4+)= c(Cl-)+ c(OH―)+c(ClO-)
6.(2022·浙江省1月选考,23)某同学在两个相同的特制容器中分别加入20mL0.4ml·L-1Na2CO3溶液和40mL0.2ml·L-1NaHCO3溶液,再分别用0.4ml·L-1盐酸滴定,利用pH计和压力传感器检测,得到如图曲线: 下列说法正确的的是( )A.图中甲、丁线表示向NaHCO3溶液中滴加盐酸,乙、丙线表示向Na2CO3溶液中滴加盐酸B.当滴加盐酸的体积为V1mL时(a点、b点),所发生的反应用离子方程式表示为:HCO3-+H+=CO2↑+H2OC.根据pH—V(HCl)图,滴定分析时,c点可用酚酞、d点可用甲基橙作指示剂指示滴定终点D.Na2CO3和NaHCO3溶液中均满足:c(H2CO3)-c(CO32-)=c(OH-)-c(H+)
7.(2021•浙江1月选考,23)实验测得10 mL 0.50 ml·L-1NH4Cl溶液、10 mL 0.50ml·L-1CH3COONa溶液的pH分别随温度与稀释加水量的变化如图所示。已知25 ℃时CH3COOH和NH3·H2O的电离常数均为1.8×10-5.下列说法不正确的是( ) A.图中实线表示pH随加水量的变化,虚线表示pH随温度的变化B.将NH4Cl溶液加水稀释至浓度 ml·L-1,溶液pH变化值小于lgxC.随温度升高,Kw增大,CH3COONa溶液中c(OH- )减小,c(H+)增大,pH减小D.25 ℃时稀释相同倍数的NH4Cl溶液与CH3COONa溶液中:c(Na+ )-c(CH3COO- )=c(Cl-)-c(NH4+)
8.(2021•广东选择性考试,8)鸟嘌呤(G)是一种有机弱碱,可与盐酸反应生成盐酸盐(用GHCl表示)。已知GHCl水溶液呈酸性,下列叙述正确的是( )A.0.001ml·L-1GHCl水溶液的pH=3B.0.001ml·L-1GHCl水溶液加水稀释,pH升高C.GHCl在水中的电离方程式为:GHCl=G+HClD.GHCl水溶液中:c(OH-)+c(Cl-)=c(GH+)+c(G)
9.(2021•天津卷,10)常温下,下列有关电解质溶液的叙述正确的是( )A.在0.1ml·L-1H3PO4溶液中c(H3PO4)>c(H2PO4-)>c(HPO42-)>c(PO43-)B.在0.1ml·L-1Na2C2O4溶液中c(Na+)+c(H+)= c(OH―)+c(HC2O4-)+c(C2O42-)C.在0.1ml·L-1NaHCO3溶液中c(H2CO3)+ c(HCO3-)=0.1ml·L-1D.氨水和NH4Cl溶液混合,形成pH=9的溶液中c(Cl-)>c(NH4+)>c(OH―)>c(H+)
10.(2021•北京卷)以下4个实验中均产生了白色沉淀。 下列说法不正确的是( )A.Na2CO3溶液、NaHCO3溶液含有的微粒种类相同B.Ca2+促进了CO32-、HCO3-的水解C.Al3+促进了CO32-、HCO3-的水解D.滴入溶液后,4支试管内溶液的pH都变小
11.(2021•浙江1月选考,17)25℃时,下列说法正确的是( )A.NaHA溶液呈酸性,可以推测H2A为强酸B.可溶性正盐BA溶液呈中性,可以推测BA为强酸强碱盐C.0.010 ml·L-1、0.10ml·L-1的醋酸溶液的电离度分别为α1、α2,则α1<α2D.100 mL pH=10.00的Na2CO3溶液中水电离出H+的物质的量为1.0×10-5ml
12.(2021•山东卷)赖氨酸[H3N+(CH2)4CH(NH2)COO-,用HR表示]是人体必需氨基酸,其盐酸盐(H3RCl2)在水溶液中存在如下平衡:H3R2+ H2R+ HR R-。向一定浓度的H3RCl2溶液中滴加NaOH溶液,溶液中H3R2+、H2R+、HR和R-的分布系数δ(x)随pH变化如图所示。已知δ(x)= ,下列表述正确的是( )A. >B.M点,c(Cl-) +c(OH-)+c(R-)=2c(H2R+)+c(Na+)+c(H+)C.O点,pH=D.P点,c(Na+)>c(Cl-)>c(OH-)>c(H+)
13.(2021•湖北选择性考试)常温下,已知H3PO3溶液中含磷物料的浓度之和为0.1 ml·L-1,溶液中各含磷物种的pc-pOH关系如图所示。图中pc表示各含磷物种的浓度负对数(pc=-lgc),pOH表示OH-的浓度负对数[pOH=-lgc(OH-)];x、y、z三点的坐标:x(7.3,1.3)、y(10.0,3.6)、z(12.6,1.3)。下列说法正确的是( ) A.曲线①表示pc(H3PO3)随pOH的变化B.H3PO3的结构简式为C.pH=4的溶液中:c(H2PO2-)<0.1 ml·L-1-2c(HPO32-)D.H3PO3+HPO32- ⇌2H2PO3-的平衡常数K>1.0×105
14.(2020•江苏卷,14)室温下,将两种浓度均为0.1ml·L-1的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是( )A.NaHCO3-Na2CO3混合溶液(pH=10.30):NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)B.氨水-NH4Cl混合溶液(pH=9.25):c(NH4+)+ c(H+)= c(NH3∙H2O)+c(OH-)C.CH3COOH - CH3COONa混合溶液(pH=4.76):c(Na+)>c(CH3COOH)>c(CH3COO−)>c(H+)D.H2C2O4-NaHC2O4混合溶液(pH=1.68,H2C2O4为二元弱酸):c(H+)+c(H2C2O4)= c(Na+)+c(OH-)+c(C2O42-)
离子浓度大小关系分析判断的基本解题框架
得c(OH-)与c(H+)大小关系
得水解与电离程度相对大小
一边全是阴离子,一边全是阳离子
一边全含一种元素,一边全含另一种元素
一边微粒能电离H+,一边微粒能结合H+
抓“恰好”反应点,生成什么溶质,溶液的酸碱性,是什么因素造成的
抓溶液“中性”点,生成什么溶质,哪种反应物过量或不足
抓反应“一半”点,判断是什么溶质的等量混合
抓反应“过量”点,溶质是什么,判断谁多、谁少还是等量
9)化肥的使用:铵态氮肥与草木灰不得混用:2NH4++CO32-=2NH3↑+CO2↑+H2O
1)判断溶液的酸碱性:FeCl3显酸性,原因是Fe3++3H2O ⇌Fe(OH)3+3H+
2)配制或贮存易水解的盐溶液:配制CuSO4溶液时,加入少量H2SO4,防止Cu2+水解
3)判断盐溶液蒸干产物:蒸干AlCl3[Al(NO3)3、FeCl3、AlBr3类似]溶液,挥发出HCl气体,平衡右移,得AI(OH)3,灼烧得Al2O3
5)物质的提纯:除去MgCl2溶液中的Fe3+,可加入MgO、镁粉或Mg(OH)2或MgCO3
6)离子共存的判断:Al3+与AlO2-、CO32-、HCO3-、S2-、HS-等因相互促进水解而不共存
7)泡沫灭火器原理:成分为NaHCO3与Al2(SO4)3,发生反应为Al3++3HCO3-=Al(OH)3↓+3CO2↑
8)作净水剂:明矾可作净水剂,原理为A3++3H2O ⇌Al(OH)3(胶体)+3H+
3)相互促进水解的盐>单水解的盐>相互抑制水解的盐。
1)判断弱酸(弱碱)的相对强弱:越弱越水解;
2)相同条件下:正盐>相应酸式盐,如CO32->HCO3-;
3)质子守恒:分子或离子得到或失去质子(H+)的物质的量相等。 如在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3·H2O、OH-、CO32-为失去质子后的产物 :则 c(H3O+)+c(H2CO3)===c(NH3·H2O)+c(OH-)+c(CO32-)
1)电荷守恒:阳离子带正电荷数=阴离子带负电荷数 如NaHCO3溶液中:n(Na+)+n(H+)=n(HCO3-)+2n(CO32-)+n(OH-)
2)物料守恒:离子发生变化变成其它离子或分子,但离子或分子中某种特定元素的原子的总数不会改变。 如NaHCO3溶液中:n(Na+)∶n(C)=1∶1,推出:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
1)多元弱酸: 如H3PO4溶液:c(H+)>c(H2PO4-)>c(HPO42-)>c(PO43-)。
2)多元弱酸的正盐溶液: 如Na2CO3溶液:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)。
3)不同溶液同离子浓度比较: 如同物质的量浓度溶液中 a.NH4Cl b.CH3COONH4 c.NH4HSO4 c(NH)由大到小的顺序:c>a>b。
4)混合溶液中各离子浓度的比较:如同浓度的NH4Cl溶液和氨水等体积混合,氨水电离程度大于NH4+水解程度,溶液中离子浓度顺序为:c(NH4+)>c(Cl-)>c(OH-)>c(H+) 。
1.(2023·广东省广州市二模)二乙胺[(C2H5)2NH]是一种有机弱碱,可与盐酸反应生成盐酸盐(C2H5)2NH2Cl。下列叙述正确的是( )A.0.01ml·L-1 (C2H5)2NH2Cl水溶液的pH=2B.(C2H5)2NH2Cl水溶液的pH随温度升高而减小C.(C2H5)2NH2Cl水溶液加水稀释,pH降低D.(C2H5)2NH2Cl水溶液中:c(Cl-)+c(OH-)= c[(C2H5)2NH2+]+ c[(C2H5)2NH]
题型一 水解概念的理解
2.(2023·浙江省诸暨市高三适应性考试)已知H2R为二元弱酸,Ka1(H2R)=5.4×10-2,Ka2(H2R)=5.4×10-5。室温下,下列说法不正确的是( )A.0.1ml/L NaHR溶液pH<7B.用NaOH溶液中和一定量的H2R溶液至呈中性时,溶液中c(HR-)<c(R2-)C.0.1ml/L H2R溶液:.2ml/L+c(OH-)=c(H+)+c(H2R)+c(HR-)D.0.01ml/L的H2R溶液与pH=12的NaOH溶液完全中和时,消耗酸与碱溶液的体积比为1∶2
3.25℃时浓度都是1 ml·L-1的四种正盐溶液:AX、BX、AY、BY;AX的溶液pH=7且溶液中c(X-)=1 ml·L-1,BX的溶液pH=4,BY的溶液pH=6。下列说法正确的是( )A.电离平衡常数K(BOH)小于K(HY)B.AY溶液的pH小于BY溶液的pHC.稀释相同倍数,溶液pH变化BX等于BYD.将浓度均为1 ml·L-1的HX和HY溶液分别稀释10倍后,HX溶液的pH大于HY
4.(2024·辽宁省部分县级重点中学高三联考)小组探究Na2CO3和NaHCO3与碱的反应,实验过程及结果如下。下列说法不正确的是( )A.Ⅰ是空白实验,排除因体积变化对Ⅱ、Ⅲ溶液pH的影响B.Ⅱ和Ⅰ的pH曲线基本重合,说明CO32-与OH-不反应C.Ⅲ中石灰水恰好完全反应时,溶液pH=7D.若将试剂X换为Ca(HCO3)2,所得的pH曲线与Ⅲ的pH曲线不重合
5.常温下,浓度均为0.1 ml·L-1的下列四种盐溶液,其pH测定如下表所示:下列说法正确的是( ) A.四种溶液中,水的电离程度:①>②>④>③B.Na2CO3和NaHCO3溶液中,粒子种类相同C.将等浓度的CH3COOH和HClO溶液比较,pH小的是HClOD.Na2CO3溶液中,c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
6.(2023·广东省深圳市龙岗区高三期中)25℃时,用0.1000ml∙L-1NaOH溶液滴定0.1000ml∙L-1醋酸溶液,由水电离出的c(H+)水与加入NaOH溶液的体积V(NaOH)的关系如下图所示[已知 ]。下列说法正确的是( ) A.图中x=10-11.13B.b、d两点溶液组成相同,且均存在c(Na+)=c(CH3COO-)C.c点溶液中存在c(CH3COOH)>c(OH-)D.稀释e点溶液时, 减小
7.天门冬氨酸( ,记为H2Y)是一种天然氨基酸,水溶液显酸性,溶液中存在H2Y⇌H++HY-,HY-⇌H++Y2-,与足量NaOH反应生成Na2Y ,与盐酸反应生成YH3Cl。下列说法正确的是( )A.常温下,0.05 ml·L-1的H2Y溶液的pH=1B.pH=2.97的H2Y溶液稀释100倍,所得溶液pH=4.97C.YH3Cl水溶液中:c(H+)+c(YH3-)= c(OH-)+ c(Cl-)+c(HY-)D.Na2Y溶液中:c(OH-)=c(H+)+c(HY-)+ 2c(H2Y)+3c(YH3-)
题型二 离子浓度大小的比较
8.(2024·江苏盐城高三期中联考)碳酸钠俗称纯碱,是一种重要的化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠的过程如下: 已知:碳酸电离常数Ka1(H2CO3)=4.3×10-7、Ka2(H2CO3)=5.61×10-11;NH3·H2O电离常数Kb(NH3·H2O)=1.8×10-5。下列说法正确的是( )A.0.5 ml·L-1NH4HCO3溶液中存在:c(NH4+)>c(HCO3-)>c(OH―)>c(H+)B.滤液中存在:c(Cl-)+ c(OH―)=c(H+)+c(NH4+)C.0.5 ml·L-1 NaHCO3溶液中存在:c(OH―)=c(H+)+c(HCO3-)+c(CO32-)D.0.5 ml·L-1 Na2CO3溶液中存在:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-)
9.向1 L含0.01 ml NaAlO2和0.02 ml NaOH的溶液中缓慢通入CO2,随n(CO2)增大,先后发生三个不同的反应,当0.01 ml
11.室温下,通过下列实验探究0.1ml·L-1NaHS溶液的性质。下列有关说法正确的是( ) A.实验①溶液中:c(S2-)>c(H2S)B.实验②所得溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)C.实验③中反应的离子方程式:Cu2++HS-→CuS↓+H+D.实验④中反应的离子方程式:2HS-+ClO-→2S↓+Cl-+H2O
12.碳酸和亚硫酸电离平衡常数(25℃)如下表所示:下列说法正确的是( ) A.pH相同的①Na2CO3②Na2SO3溶液中c(Na+):①>②B.少量CO2通入Na2SO3溶液中反应的离子方程式为:CO2+H2O+2SO32-=CO32-+HSO3-C.某NaHSO3溶液pH=5,则该溶液中的c(H2SO3)>c(SO32-)D.等浓度的NaHSO3和NaHCO3等体积混合后,则c(H+)-c(OH-)= c(CO32-)-c(H2CO3)+ c(SO32-)-c(H2SO3)
13.室温下,通过下列实验探究0.100ml·L-1K2C2O4溶液的性质。已知:25℃时H2C2O4的Ka1=10-1.22,Ka2=10-4.19。下列说法正确的是( ) A.实验①溶液中: =10-4.21B.实验②反应所得溶液中:c(K+)=2c(C2O42-)+c(HC2O4-)C.实验③反应所得溶液中:c(C2O42-)
15.(2024·河南周口项城5校高三联考)常温下将NaOH溶液滴加到H2A和HB的混合溶液中,溶液中H2A、HA-、A2-、HB、B-的分布分数δ[如 , ]随pH变化的关系如图所示。下列说法正确的是( ) A.曲线b、d分别表示 、 随pH变化的关系B.NaB的水解常数Kh(NaB)=10-5.7,NaHA溶液中c(H2A)>c(A2―)C.NaHA溶液与NaB溶液混合过程中发生反应的离子方程式为HA-+B-=HB+A2-D.当溶液呈中性时,c(Na+)=c(HA-)+c(A2―)+c(B-)
16.(2024·河北石家庄高三第二次调研)室温下,向一定浓度的Na2CO3溶液中滴加盐酸,溶液中 、 随溶液酸度AG[AG= ]的变化如图所示。下列说法正确的是( ) A.Ⅱ表示 随AG的变化B.AG=0时,溶液中c(Na+)=2c(CO32-)+c(HCO3-)C.随着AG的增大, 的值保持不变D.H2CO3的Ka1=10-10.33
(3)沉淀的转化①实质:沉淀溶解平衡的移动(沉淀的溶解度差别越大,越容易转化)。②应用:锅炉除垢、矿物转化等。
(1)沉淀的生成①调节pH法:如除去NH4Cl溶液中的FeCl3杂质,可加氨水调节pH至7~8,离子方程式为Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+②沉淀剂法:如用H2S沉淀Cu2+,离子方程式:H2S+Cu2+=CuS↓+2H+
(2)沉淀的溶解①酸溶解法:如CaCO3溶于盐酸,离子方程式:CaCO3+2H+=Ca2++H2O+CO2↑②盐溶液溶解法:如Mg(OH)2溶于NH4Cl溶液,离子方程式:Mg(OH)2+2NH4+=Mg2++2NH3·H2O③氧化还原溶解法:如不溶于盐酸的硫化物Ag2S溶于稀HNO3。④配位溶解法:如AgCl溶于氨水,离子方程式:AgCl+2NH3·H2O=[Ag(NH3)2]++Cl-+2H2O。
(2)已知溶度积、溶液中某离子的浓度,求溶液中的另一种离子的浓度,如某温度下AgCl的Ksp=a在0.1 ml/L的NaCl溶液中加入过量的AgCl固体,达到平衡后c(Ag+)=10a ml/L
阴、阳离子的个数比相同的难溶电解质:Ksp越小,其物质的溶解性就越小;
阴、阳离子的个数比不同的难溶电解质:它们的溶解性就不能直接用Ksp的大小来比较。
Ksp相差不大时,调节某种离子的浓度,溶度积小→溶度积大
1.(2023•浙江省1月选考,15)碳酸钙是常见难溶物,将过量碳酸钙粉末置于水中达到溶解平衡:CaCO3(s)⇌Ca2+(aq)+CO32-(aq)[已知Ksp(CaCO3)=3.4×10-9,Ksp(CaSO4)=4.9×10-5,H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11],下列有关说法正确的是( )A.上层清液中存在c(Ca2+)=c(CO32-)B.上层清液中含碳微粒最主要以HCO3-形式存在C.向体系中通入CO2气体,溶液中c(Ca2+)保持不变D.通过加Na2SO4溶液可实现CaCO3向CaSO4的有效转化
2.(2023•浙江省6月选考,15)草酸(H2C2O4)是二元弱酸。某小组做如下两组实验:实验I:往20mL0.1ml·L-1NaHC2O4溶液中滴加0.1ml·L-1NaOH溶液。实验Ⅱ:往20mL0.1ml·L-1NaHC2O4溶液中滴加0.1ml·L-1 CaCl2溶液。[已知:H2C2O4的电离常数Ka1=5.4×10-2,Ka2=5.4×10-5,Ksp(CaC2O4)= 2.4×10-9,溶液混合后体积变化忽略不计],下列说法正确的是( )A.实验I可选用甲基橙作指示剂,指示反应终点B.实验I中V(NaOH)=10mL时,存在c(C2O42-)<c(HC2O4-)C.实验Ⅱ中发生反应Ca2++ HC2O4- =CaC2O4↓+H+D.实验Ⅱ中V(CaCl2)=80mL时,溶液中c(C2O42-)=4.0×10-8ml·L-1
1.把足量熟石灰加入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) ⇌Ca2+(aq)+2OH-(aq)。下列叙述正确的是( )。A.给溶液加热,溶液的pH升高B.恒温下向溶液中加入CaO,溶液的pH升高C.向溶液中加入Na2CO3溶液,Ca(OH)2固体增多D.向溶液中加入少量的NaOH固体,Ca(OH)2固体增多
题型一 沉淀溶解平衡的理解
2.饱和BaCO3溶液中存在平衡:BaCO3(s) ⇌ Ba2+(aq)+CO32-(aq)。当碳酸钡固体在水中达到溶解平衡后,为使溶液中Ba2+的物质的量浓度增大,下列操作不可行的是( )A.加入少量0.1 ml·L-1盐酸B.加入少量硝酸钡固体C.加入少量0.1 ml·L-1硫酸D.加入少量氢氧化钡固体
3.工业上向锅炉里注入Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3,而后用盐酸去除。下列叙述不正确的是( )A.温度升高,Na2CO3溶液的Kw和c(OH-)均会增大B.沉淀转化的离子方程式为CO32-(aq)+CaSO4(s) ⇌CaCO3(s)+SO42-(aq)C.盐酸溶液中,CaCO3的溶解性大于CaSO4D.Na2CO3溶液遇CO2后,阴离子浓度均减小
4.(2023·黑龙江省哈尔滨市实验中学高三期中)已知25℃时,RSO4 (s)+ CO3 2-(aq) ⇌RCO3 (s)+SO42-(aq)的平衡常数K=1.75×104,Ksp(RCO3)=2.80×10-9,下列叙述中正确的是( )A.向c(CO32-)=c(SO42-)的混合液中滴加RCl2溶液,首先析出RSO4沉淀B.将浓度均为3×10-4.5ml•L-1的RCl2、Na2CO3溶液等体积混合后可得到RCO3沉淀C.25℃时,RSO4的Ksp约为4.9×10-5D.相同温度下,RCO3在水中的Ksp大于在Na2CO3溶液中的Ksp
5.依据下表有关铁的难溶化合物的溶度积,有关说法正确的是( ) A.在c(CO32-)=0.1 ml·L-1溶液中,c(Fe2+)≥3.2×10-10 ml·L-1B.将FeCl2和FeCl3溶液分别调至pH=10,则c(Fe2+)
7.已知:①AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。②室温下,Ksp(AgCl)=2.0×10-10,Ksp(Ag2S)=2.0×10-48。向AgCl的悬浊液中加入一定量的Na2S溶液并振荡,白色固体向黑色固体转化。下列说法正确的是 ( )A.Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+2c(S2-)B.向AgCl悬浊液加入足量氨水,溶液变澄清。反应的离子方程式为:AgCl+4NH3•H2O=[Ag(NH3)4]++Cl-+4H2OC.反应2AgCl+S2-⇌Ag2S+2Cl-正向进行,需满足 <2×1028D.将转化后的体系静置,上层清液中离子存在关系:c(Ag+)= 且c(Ag+)>
8.(2024·江苏泰州高三期中)室温下,实验室用0.5ml·L-1(NH4)2CO3溶液浸取工业废渣粉末(主要含CaSO4·H2O,还含少量SiO2、Fe2O3)制取CaCO3。已知 , 。 下列说法正确的是( )A.0.5ml·L-1(NH4)2CO3溶液中存在:c(NH4+)+c(H+)= c(OH―)+c(CO32-)+c(HCO3-)B.“浸取”时,向(NH4)2CO3溶液加入适量浓氨水的主要目的是提高溶液的碱性C.“浸取”静置后的上层清液中有c(Ca2+)·c(CO32-)<Ksp(CaCO3) D.室温下,反应CaSO4(s)+CO32-(aq)⇌CaCO3(s))+SO42-(aq)达到平衡,溶液中
9.(2024·北京朝阳高三期中)某小组同学进行如下实验探究沉淀转化:①向20mL0.1ml·L-1Na2CO3溶液中滴加20mL0.1ml·L-1BaCl2溶液,得浊液Ⅰ;②向浊液Ⅰ中继续滴加20mL0.1ml·L-1Na2SO4溶液,充分振荡,得浊液Ⅱ;③将浊液Ⅱ过滤,向滤渣中加入过量盐酸产生气体,过滤、洗涤、干燥,测得剩余固体a的质量大于0.233g。下列说法不正确的是( )A.Na2CO3溶液显碱性的原因:CO32-+H2O ⇌HCO3-+OH-B.固体a的成分为BaSO4C.c(Ba2+)大小关系:浊液Ⅰ<浊液ⅡD.由该实验可以推断Ksp(BaSO4)<Ksp(BaCO3)
10.已知:25℃时,Ksp[Ni(OH)2]=2.0×10-15,Ksp[Fe(OH)3]=4.0×10-38。将含Fe2O3、Ag、Ni的某型废催化剂溶于盐酸,过滤,滤渣为Ag,所得溶液中c(Ni2+)=c(Fe3+)=0.4ml/L。向该溶液中滴加一定浓度的NaOH溶液(假设溶液体积不变)。下列说法中正确的是( )A.金属活动性:Ag>NiB.加入NaOH溶液时,先产生Ni(OH)2沉淀C.当滴定到溶液pH=5时,溶液中lg 约为10D.当滴定到溶液呈中性时,Ni2+已沉淀完全
11.(2024·江苏淮安市5校高三联考)室温下: Ka1(H2C2O4)=5×10 -2,Ka2(H2C2O4)=1×10-4 ,Ksp(CaC2O4)=2.5×10 -9。通过下列实验探究某些草酸盐的性质。实验①:用pH计测得 0.10ml/L K2C2O4溶液的 pH=8实验②:向0.10ml/LKHC2O4溶液中滴入少量酸性高锰酸钾溶液,振荡后溶液紫色褪去实验③:向0.10ml/L KHC2O4溶液加入一定体积的等浓度CaCl2溶液产生白色沉淀,测得上层清液pH=4, (Ca2+)=10-4ml/L实验④:向0.10ml/L K2C2O4溶液中滴加一定浓度的稀盐酸后,混合溶液的 pH=7,下列说法正确的是( )A.实验①溶液中: =2×10-3 B.实验②说明 KHC2O4溶液具有漂白性C.实验③所得上层清液中的c(HC2O4-)=2.5×10-5ml/LD.实验④反应所得溶液中存在:c(K+)=2c(C2O42-)+c(HC2O4-)
题型二 溶度积常数与电离平衡常数的综合分析
12.(2024·辽宁沈阳高三期中)SO2是引发酸雨的主要污染物,将工业废气中的SO2吸收能有效减少对大气的污染、并实现资源化利用。下列离子方程式正确的是( )已知常温下亚硫酸的电离平衡常数(Ka1=1.3×10-2,Ka2=6.3×10-8)碳酸的电离平衡常数(Ka1=4.3×10-7,Ka2=5.6×10-11)A.硫酸型酸雨露置于空气中一段时间后溶液酸性增强:H2SO3+O2=2H++SO42-B.用过量Ca(ClO)2溶液吸收废气中的SO2: Ca2++ClO- +SO2+H2O= CaSO4↓+ Cl-+2H+C.用过量氨水吸收废气中的SO2: NH3·H2O +SO2=NH4++HSO3-D.用过量Na2CO3 溶液吸收废气中的SO2: 2CO32- +SO2+H2O=SO32-+HCO3-
13.(2023·浙江省浙南名校联盟高三第二次联考)常温下,向20mL0.1ml/L NaHCO3溶液中再加入少量的NaHCO3固体,一段时间后,少量气体X从溶液底部固体中缓慢逸出,最终固体全部溶解,得到溶液Y,pH值为8.7。已知:Ksp(CaCO3)=4.96×10-9 Ksp(MgCO3)=6.82×10-6,Ksp[Mg(OH)2]=1.8×10-11H2CO3:pKa1=6.3、pKa2=10.3;Mg(OH)2沉淀范围:pH9.4~12.4。 下列说法正确的是( )A.X气体是CO2,饱和NaHCO3溶液的pH>8.7B.因为Ksp(MgCO3)>Ksp[Mg(OH)2],Mg(OH)2更难溶C.向溶液Y中滴加MgCl2溶液,有Mg(OH)2生成D.向0.1ml/L NaHCO3溶液中加入MgCl2溶液,无明显现象,但改为同浓度的CaCl2溶液,可生成沉淀。
14.(2023·浙江省金、丽、衢十二校高三二模)草酸钙是常见的难溶物。将过量草酸钙粉末置于水中达到溶解平衡:CaC2O4 (s) ⇌Ca2+ (aq)+ C2O42- (aq)[已知Ksp(CaC2O4)=2.3×10-9,Ka(CH3COOH)=1.75×10-5,H2C2O4的电离常数Ka1=5.6×10-2,Ka2=1.5×10-4,下列有关说法不正确的是( )A.上层清液中含碳微粒最主要以C2O42-形式存在B.上层清液中存在:c(Ca2+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4)C.H2C2O4加入CaCl2溶液时,加入适量醋酸钠粉末,有利于生成CaC2O4沉淀D.向上层清液中通入HCl至pH=1,则:2c(Ca2+)-2c(C2O42-)-c(HC2O4-)- c(OH―)= 0.1ml·L-1
15.(2023·浙江省温州市高三第三次模拟适应性考试)H2S是常见的二元弱酸(电离常数Ka1(H2S)=1.1×10-7,Ka2(H2S)=1.3×10-13)。氢氧化铁[Ksp= 2.8×10-39]、氢氧化锌[Ksp= 3.0×10-17]均为难溶多元弱碱,硫化锌[Ksp= 1.6×10-24]为难溶盐。所有数据均为25℃的值。下列有关说法不正确的是( )A.因为H2S的Ka1>>Ka2,所以c(S2-)≈Ka2=1.3×10-13ml/LB.Fe(OH)3饱和溶液中的c(Fe3+)≈1×10-10ml/L C.分别向等体积等浓度的(CH3COO)2Zn、ZnSO4溶液中通入等物质的量的H2S沉淀ZnS后,前者c(Zn2+)更小D.pH=13的Na2S溶液与相同物质的量的ZnSO4反应,只沉淀ZnS
16.(2023·浙江省浙南名校联盟高三第二次联考)常温下,向20mL0.1ml/L NaHCO3溶液中再加入少量的NaHCO3固体,一段时间后,少量气体X从溶液底部固体中缓慢逸出,最终固体全部溶解,得到溶液Y,pH值为8.7。已知:Ksp(CaCO3)=4.96×10-9 Ksp(MgCO3)=6.82×10-6,Ksp[Mg(OH)2]=1.8×10-11H2CO3:pKa1=6.3、pKa2=10.3;Mg(OH)2沉淀范围:pH9.4~12.4。 下列说法正确的是( )A.X气体是CO2,饱和NaHCO3溶液的pH>8.7B.因为Ksp(MgCO3)>Ksp[Mg(OH)2],Mg(OH)2更难溶C.向溶液Y中滴加MgCl2溶液,有Mg(OH)2生成D.向0.1ml/L NaHCO3溶液中加入MgCl2溶液,无明显现象,但改为同浓度的CaCl2溶液,可生成沉淀。
17.(2024·江苏淮安高三开学考试)室温下,用FeSO4溶液制备FeCO3的过程如图所示。已知:Kb(NH3·H2O)=1.8×10-5,Ka1(H2CO3)=4.5×10-7,Ka2(H2CO3)=4.7×10-11,Ksp[Fe(OH)2]=8.0×10-16,Ksp(FeCO3)=3.1×10-11。下列说法正确的是( ) A.0.1 ml·L-1NH4HCO3溶液中:c(NH3·H2O)>c(H2CO3)B.(NH4)2SO4溶液中:c(H+)=2 c(NH3·H2O)+ c(OH―)C.制备FeCO3的离子方程式为:Fe2++ NH3·H2O +HCO3-=FeCO3↓+NH4++H2OD.c(Fe2+)=0.08ml·L-1时,应控制pH≤8
18.牙齿表面存在如下平衡:Ca5(PO4)3OH(s ) ⇌5Ca 2+(aq)+3 PO43-(aq) +OH-(aq) Ksp=6.8×10-37,Ca5(PO4)3F 的Ksp=2.8×10-61。下列说法错误的是( )A.在牙膏中添加适量的磷酸盐,能起到保护牙齿的作用B.口腔中的食物残渣能产生有机酸,容易导致龋齿,使Ksp增大C.正常口腔的pH接近中性,有利于牙齿健康D.使用含氟牙膏,当Ca5(PO4)3OH(s)与Ca5(PO4)3F(s)共存时,
题型三 沉淀溶解平衡的运用
19.(2023·浙江省绍兴市高三二模)室温下,用过量0.5ml·L-1Na2CO3溶液浸泡CaSO4粉末,一段时间后过滤,向滤渣中加稀醋酸,产生气泡。(当溶液中剩余的离子浓度小于 时,化学上通常认为生成沉淀的反应已经完全进行了。已知:Ksp(CaSO4)=5.0×10-5,Ksp(CaCO3)=3.0×10-9),下列说法正确的是( )A.浸泡后CaSO4未完全转化为CaCO3B.0.5ml·L-1Na2CO3溶液中存在:c(OH―)=c(H+)+c(HCO3―)+c(H2CO3)C.反应CaSO4+CO32 -⇌CaCO3+SO42-正向进行,需满足D.过滤后所得清液中一定存在: 且
20.(2023·浙江省临海、新昌两地高三适应性考试5月模考)印尼苏拉威西岛特产的椰子蟹具有异常坚硬的甲壳,这归功于摄入的椰子中的月桂酸(C11H23COOH),在表面的角质层中形成难溶的月桂酸磷酸钙,存在如下平衡:Ca3PO4(OOCC11H23)3(s) ⇌3Ca2+(aq)+PO43-(aq)+3C11H23COO-(aq) Ksp=7.3×10-35,已知CaCO3的Ksp=2.8×10-9。下列说法不正确的是( )A.椰子蟹摄入月桂酸含量较高的椰肉有助于形成更加坚硬的甲壳B.弱碱性的海水可以保护椰子蟹外壳,使其不易被腐蚀C.将少量月桂酸磷酸钙投入适量1ml•L-1碳酸钠溶液中,可实现其与碳酸钙的转化D.海水中CO2浓度升高,会腐蚀椰子蟹的外壳,使Ksp增大
21.一种测定水样中溴离子浓度的实验步骤如下:①向锥形瓶中加入处理后的水样25.00mL,加入几滴NH4Fe(SO4)2溶液。②加入V1 mL c1 ml∙L−1AgNO3溶液(过量),充分摇匀。③用c2 ml∙L−1KSCN标准溶液进行滴定,至终点时消耗标准溶液V2mL 。已知:Ksp(AgBr)=7.7×10−13,Ag++SCN-= AgSCN(白色)↓,Ksp(AgSCN)=1×10−12,下列说法不正确的是( )A.滴定终点时,溶液变为红色B.该水样中溴离子浓度为:c(Br-)= ml∙L−1C.AgBr(s)+SCN-(aq) ⇌AgSCN(s)+Br-(aq)的平衡常数K=0.77D.该实验需要严格控制水样的pH,若pH过高则测定结果将偏高
22.(2023·浙江省义乌市高三高考适应性考试)在25℃时,下列几种难溶电解质的溶度积常数(Ksp)如表所示,下列说法不正确的是( ) A.重晶石的主要成分是BaSO4工业上常用饱和碳酸钠溶液反复浸泡重晶石,将难处理的BaSO4转化为更易处理的BaCO3B.在食盐除杂实验中,利用BaCl2除去溶液中的SO42-后,应先过滤,再加入Na2CO3除去溶液中的Ba2+和Ca2+,过滤的目的是防止BaSO4转化为BaCO3C.在含银工业废水的处理中,相同浓度的Na2S溶液比NaCl溶液沉淀效果好,而且Na2S溶液可以沉淀多种重金属离子D.将浓度均为0.2ml•L-1的NaCl溶液和Na2CrO4溶液等体积混合后,滴加AgNO3溶液,先析出Ag2CrO4沉淀
23.(2023·浙江省诸暨市高三适应性考试)氢氧化镁是常见难溶物,将过量氢氧化镁粉末置于水中达到溶解平衡:Mg(OH)2 (s) ⇌ Mg2+ (aq)+ 2OH-(aq)。已知Ksp[Mg(OH)2]=1.8×10-11,Ksp(MgCO3)=3.5×10-8;通常,溶液中某离子的浓度小于1.0×10-5ml·L-1时,可以认为该离子已沉淀完全。下列有关说法不正确的是( )A.滴入几滴稀硫酸,溶液的pH先下降后上升,最后保持一个稳定值B.MgCO3的饱和溶液中c(Mg2+)>c(CO32-)C.NaOH溶液可使MgCO3较彻底地转化为Mg(OH)2D.氢氧化镁可处理印染厂的酸性废水,处理后c(Mg2+)=1.8×10-3ml·L-1,此时溶液呈碱性
24.(2023·浙江省宁波市高三下学期高考模拟)向工业废水中加入硫化物可以获得CuS、FeS纳米粒子[已知Ksp(FeS)= 6.3×10-18,Ksp(CuS)= 1.3×10-36],下列说法正确的是( )A.FeS固体不能用于去除工业废水中的Cu2+B.向FeSO4和CuSO4混合溶液中加入Na2S溶液,当两种沉淀共存时,C.向CuS饱和溶液中加入CuCl2固体,CuS的溶解平衡逆向移动,滤液中一定存在D.已知H2S溶液中 ,可判断CuS易溶于稀盐酸
25.沉淀溶解平衡在生活、生产和化学学习中有着重要应用。请回答下列问题:(1)工业上湿法炼锌过程中,以ZnSO4为主要成分的浸出液中,含有Fe3+、Fe2+、Cu2+、Cl-等杂质,这些杂质对锌的电解工序有妨碍,必须提早除去.现有下列试剂可供选择:酸性KMnO4溶液、NaOH溶液、ZnO、H2O2溶液、Fe、AgNO3溶液、Ag2SO4。①为了除去Fe2+,应加入合适的氧化剂,将其氧化为Fe3+,则应选择的氧化剂是___;利用沉淀转化原理,可加入_______,除去Cl-。②为使某些金属离子转化为沉淀而除去,需加入适当的物质调节溶液的pH。则加入的物质是___。(2)工业生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s) ⇌CuS(s)+Mn2+(aq),该反应达到平衡时,c(Mn2+)________(填“>”“<”或“=”)c(Cu2+)(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。25℃时,当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5ml•L-1)时,溶液中c(Ag+)为_________ml•L-1,此时溶液中c(CrO42-)等于_________ml•L-1(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
26.(2024·河南省湘豫名校高三联考)常温下,CdCO3和Cd(OH)2的沉淀溶解平衡曲线如图所示。下列说法正确的是( ) A.向X点对应溶液中加入适量的NaOH溶液,有可能得到Z点对应溶液B.相同温度下,Ksp(CdCO3)=100Ksp[Cd(OH)2]C.Y点对应的CdCO3分散系中,v(溶解)>v(沉淀)D.常温下,CdCO3、Cd(OH)2饱和溶液,前者c(Cd2+)较大
27.(2024·湖南衡阳高三第一次联考)常温下,用HCl(g)调节SrF2浊液的pH,测得在通入HCl(g)的过程中,体系中 (X代表Sr2+或F-)与 的关系如图所示。下列说法正确的是( ) 已知:SrF2为微溶于水,溶于盐酸,不溶于氢氟酸、乙醇和丙酮的固体。A. Ksp(SrF2)= 10-10.2B.随着HCl(g)的加入,SrF2溶解度逐渐减小C.p点对应的溶液中c(Sr2+)<c(HF)D.m、n点时的溶液中均存在c(HF)+c(H+)=c(Cl-)+ c(OH―)
28.(2024·云南省部分名校高三联考)常温下,CaF2、BaF2的沉淀溶解曲线如图所示。下列叙述错误的是( ) 已知:CaF2的溶解度小于BaF2,M代表Ba或CaA.曲线Ⅰ代表 与-lgc(F-)的关系B.常温下, Ksp(BaF2)= 1.0×10-6.74C.M点对应的溶液是 BaF2的过饱和溶液D.BaF2(s)+Ca2+(aq) ⇌ CaF2 (s))+ Ba2+(aq)的平衡常数 K 为103.1
29.(2024·贵州遵义高三第一次质量监测)工业上常以SrSO4(s)为原料生产SrCO3(s)。一定温度下,现有含SrCO3(s)的0.1 ml ·L-1Na2CO3溶液和含SrSO4(s)的0.1 ml·L-1Na2SO4溶液。在一定pH范围内,两种溶液中pM随pH的变化关系如图所示(pM=-lg[c(Sr2+)/(ml·L-1)]。下列说法正确的是( ) A.曲线②代表含SrCO3(s)的0.1 ml·L-1 Na2CO3溶液的变化曲线B.该温度下SrSO4的Ksp(SrSO4)值为10-6.5C.若将Na2SO4溶液改为1 ml·L-1,m点会移向p点D.由图可知,pH越小,越有利于SrSO4转化为SrCO3
专题09+化学反应原理综合(题型突破)(课件)-2024年高考化学二轮复习讲练测(新教材新高考): 这是一份专题09+化学反应原理综合(题型突破)(课件)-2024年高考化学二轮复习讲练测(新教材新高考),共60页。PPT课件主要包含了PARTONE等内容,欢迎下载使用。
专题07+化学反应速率与化学平衡(课件)-2024年高考化学二轮复习讲练测(新教材新高考): 这是一份专题07+化学反应速率与化学平衡(课件)-2024年高考化学二轮复习讲练测(新教材新高考),共60页。PPT课件主要包含了PARTONE等内容,欢迎下载使用。
专题06+化学反应与能量(课件)-2024年高考化学二轮复习讲练测(新教材新高考): 这是一份专题06+化学反应与能量(课件)-2024年高考化学二轮复习讲练测(新教材新高考),共60页。PPT课件主要包含了PARTONE,可充电电池等内容,欢迎下载使用。












