





专题04++氧化还原反应(课件)-2024年高考化学二轮复习讲练测(新教材新高考)
展开考点要求考题统计考情分析物质的组成、性质、分类2023**卷**题,**分2022**卷**题,**分2021**卷**题,**分……传统文化中的性质与变化2023**卷**题,**分2022**卷**题,**分2021**卷**题,**分
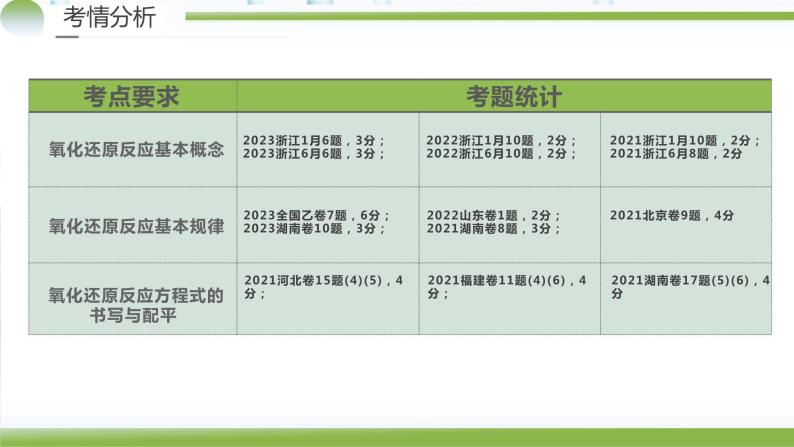
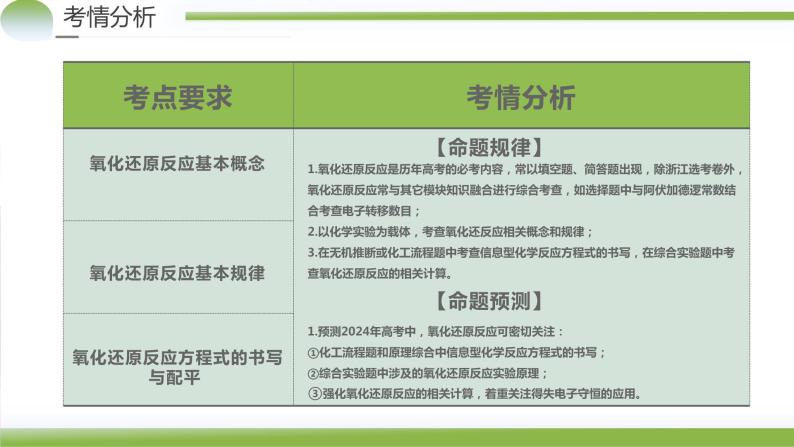
氧化还原反应基本概念
氧化还原反应基本规律
氧化还原反应方程式的书写与配平
1.氧化还原反应是历年高考的必考内容,常以填空题、简答题出现,除浙江选考卷外,氧化还原反应常与其它模块知识融合进行综合考查,如选择题中与阿伏加德逻常数结合考查电子转移数目;2.以化学实验为载体,考查氧化还反应相关概念和规律;3.在无机推断或化工流程题中考查信息型化学反应方程式的书写,在综合实验题中考查氧化还原反应的相关计算。
1.预测2024年高考中,氧化还原反应可密切关注:①化工流程题和原理综合中信息型化学反应方程式的书写;②综合实验题中涉及的氧化还原反应实验原理;③强化氧化还原反应的相关计算,着重关注得失电子守恒的应用。
选材热点如下:1.安全与健康——人体必需的营养元素;重金属对人体的危害;食品添加剂;有关化学与健康方面的材料等。2.环境保护新进展——“雾霾”的产生、危害和治理;工业“三废”和生活垃圾的处理;废电池对饮用水和土壤的污染;绿色化学在工农业生产中的导向作用等。3.新能源的使用——新型的燃料电池、高能绿色电池;新能源开发利用的新进展。4.新型无机非金属材料和有机高分子材料在社会、生活中的应用等。5.涉及碳中和、碳达峰的知识。
氧化还原反应:有电子转移(得失或偏移)的反应
氧化剂:得电子,化合价降低,发生还原反应,具有氧化性的物质
还原剂:失电子,化合价升高,发生氧化反应,具有还原性的物质
还原产物:发生还原反应后的产物
氧化产物:发生氧化反应后的产物
Cl系列:HCl、Cl2、HClO、NaClO2、ClO2、KClO3
S系列:H2S、S、S2O32-、SO2、S2O52-、SO42-
N系列:NH3、N2H4、N2、NO、HNO2、NO2、HNO3
O系列:H2O、H2O2、Na2O2、O2、O3
Mn系列:Mn、MnO2、MnO42-、MnO4-
Fe系列:Fe、Fe2+、Fe3+、FeO42-
Cr系列:Cr、Cr3+、Cr2O72- 、CrO42-
物质氧化性、还原性应用
价态规律——高降低升,中间两边跑
优先规律——优先与氧化性、还原性强的物质反应
守恒规律——化合价升高总数与降低总数相等
转化规律——归中反应元素的化合价只接近不交叉,最多达到同种价态
“条件”:反应条件难易程度
“三表”:金属性周期表、非金属性周期表、金属活动性表
“两池”:原电池、电解池
“三度”:浓度、温度、酸碱度
信息型氧化还原反应书写步骤——1.看两剂两产物;2.看环境,配电荷;3.看水,配原子守恒
电子守恒——得失电子总数相等;化合价升降总数相等
质量守恒——反应前后原子种类和个数不变
电荷守恒——方程式左右阴阳离子总数相等
1.标变价——标出变价元素化合价
2.列得失——列出化合价变化值
3.求总数——最小公倍数法求化合价升降总数相等
4.配系数——配平各物质化学计量数
5.查守恒——检查质量、原子、电子守恒
1.(2023•全国乙卷,7)下列应用中涉及到氧化还原反应的是( )A.使用明矾对水进行净化 B.雪天道路上撒盐融雪C.暖贴中的铁粉遇空气放热 D.荧光指示牌被照发光2.(2023•浙江省1月选考,6)关于反应2NH2OH+4Fe3+=N2O↑+4Fe2++H2O,下列说法正确的是( )A.生成1mlN2O,转移4ml电子B.NH2OH是还原产物C.NH2OH既是氧化剂又是还原剂D.若设计成原电池,Fe2+为负极产物
Al3+水解生成氢氧化铝胶体
3.(2022•山东卷,1)古医典富载化学知识,下述之物见其氧化性者为( )A.金(Au):“虽被火亦未熟"B.石灰(CaO):“以水沃之,即热蒸而解”C.石硫黄(S):“能化……银、铜、铁,奇物”D.石钟乳(CaCO3):“色黄,以苦酒(醋)洗刷则白”
4.(2022·浙江省1月选考,10)关于反应4CO2+SiH4 4CO+2H2O+SiO2,下列说法正确的是( )A.CO是氧化产物B.SiH4发生还原反应C.氧化剂与还原剂的物质的量之比为1∶4D.生成1mlSiO2时,转移8ml电子
5.(2022·浙江省6月选考,10)关于反应Na2S2O3+H2SO4=Na2SO4+S ↓+SO2↑ +H2O,下列说法正确的是( )A.H2SO4发生还原反应B.Na2S2O3既是氧化剂又是还原剂C.氧化产物与还原产物的物质的量之比为2∶1D.1ml Na2S2O3发生反应,转移4ml电子
6.(2021•浙江1月选考,10)关于反应8NH3+6NO2=7N2+12H2O,下列说法正确的是( )A.NH3中H元素被氧化B.NO2在反应过程中失去电子C.还原剂与氧化剂的物质的量之比为3:4D.氧化产物与还原产物的质量之比为4:3
7.(2021•浙江6月选考,8)关于反应K2H3IO6+9HI=2KI+4I2+6H2O,下列说法正确的是( )A. K2H3IO6发生氧化反应 B.KI是还原产物C.生成12.7g I2时,转移0.1ml电子D.还原剂与氧化剂的物质的量之比为7:1
HCl Cl2 HClO NaClO2 ClO2 KClO3
H2S S S2O32- SO2、S2O52- SO42-
NH3 N2H4 N2 NO HNO2 NO2 HNO3
浓:NO2 稀:NO
H2O H2O2、Na2O2 O2、O3
Mn MnO2 MnO42- MnO4-
Fe Fe2+ Fe3+ FeO42-
强:Fe3+ 弱:Fe2+
Cr Cr3+ Cr2O72- 、CrO42-
氧化剂+还原剂=还原产物+氧化产物
4.具有氧化性的物质和具有还原性的物质不一定都能发生化学反应:SO2具有还原性,浓H2SO4具有氧化性,但二者不发生氧化还原反应。
2.元素由化合态变为游离态不一定被还原:HCl→Cl2,氯元素被氧化;CuO→Cu,铜元素被还原。
3.氧化还原反应中有一种元素被氧化,不一定有另一种元素被还原:Cl2+H2O⇌ HCl+HClO中,被氧化和被还原的都是氯元素
1.有单质的反应不一定是氧化还原反应:O2与O3的转化为非氧化还原反应
5.同种元素的高价态的物质不一定比低价态物质的氧化性强:HClO的氧化性高于HClO4
1.(2024·河南省部分学校高三第二次联考)亚硝酸(HNO2)是一种弱酸,H2O2与HNO2溶液反应的主要产物是( )A.O2、HNO3 B.O2、NO2 C.H2O、HNO3 D.H2O、NO2.(2024·甘肃酒泉高三联考)关于反应2KMnO4+10HF+2KF+3H2O2=2 K2MnF6+3O2↑+8H2O,下列说法正确的是( )A.H2O2既是氧化剂又是还原剂 B.K2MnF6是氧化产物C.生成1mlO2,转移2ml电子 D.氧化剂与还原剂的物质的量之比为3:2
题型一 氧化还原反应概念辨析
3.(2024·广东广州华南师大附中高三期中)关于反应S+2KNO3+3C=K2S+N2↑+3CO2↑,下列说法正确的是( )A.C发生还原反应B.K2S是氧化产物C.氧化剂和还原剂的物质的量之比为1∶3D.生成1 ml N2时,转移12 ml电子
4.(2024·河南省部分学校高三第二次联考)氮化钛(TiN)是一种新型多功能金属陶瓷材料,以四氯化钛为原料,在氢气氛围下,与氨气在700℃时制得TiN的反应方程式为TiCl4+NH3→ TiN+N2+HCl(未配平),下列说法正确的是( )A.TiCl4作氧化剂,氯被还原B.参加反应的NH3有 被氧化C.TiN既是还原产物又是氧化产物D.反应中每转移1.2ml电子,会生成2.5ml气体
5.(2024·湖南衡阳湖湘教育三新探索协作体联考)化学镀银实验中,常使用H3PO2将Ag+转化为Ag,H3PO2具有较强的还原性,在溶液中常被氧化成PO43-,下列选项中正确的是( )A.反应中P元素化合价下降,H3PO2被氧化B.每生成一个PO43-粒子,反应中转移了3个电子C.该反应中氧化产物为AgD.还原产物与氧化产物的个数比为4:1
6.(2024·浙江省浙东北联盟期中)用硫酸渣制备铁黄(一种铁基颜料)的过程中存在如下反应:FeSO4+8 NH3·H2O +O2=4FeOOH+4(NH4)2SO4+2H2O下列说法正确的是( )A.O2发生氧化反应B.FeSO4作氧化剂C.生成1mlFeOOH时,转移电子数目为4NAD.FeOOH既是氧化产物又是还原产物
7.(2023·浙江省天域全国名校协作体高三联考)火箭推进发生反应的化学方程式为:C2N2H8+2N2O4=2CO2↑+3N2↑+4H2O (偏二甲肼中C、N元素的化合价相等)。下列说法正确的是( )A.C2N2H8是氧化剂 B.N2O4被氧化C.氧化产物与还原产物之比为3∶2D.N2O4完全反应,有8NA个电子转移
8.(2023·上海市宝山区一模)氨基钠(NaNH2)是重要的化学试剂,其与氧气的反应如下:4NaNH2+3O2= 2NaOH+2NaNO2+2NH3。下列说法正确的是( )A.n(氧化剂):n(还原剂)=3:4B.每消耗0.3mlO2,转移电子数是2.4 NAC.NH3是氧化产物D.NaNH2中N的化合价部分发生变化
9.(2024·北京东城期中)K2FeO4是优良的水处理剂,一种制备方法是将Fe2O3、KNO3、KOH混合共熔,反应方程式为Fe2O3+3KNO3+4KOH=2 K2FeO4+3KNO2+2H2O。下列关于该反应的说法错误的是( )A.铁元素被氧化,氮元素被还原 B.每生成1mlK2FeO4,转移6mle-C.K2FeO4具有氧化杀菌作用D.该实验条件下的氧化性:KNO3>K2FeO4
10.(2023·浙江省浙里卷天下高三开学测试)高氯酸铵可以用于固体火箭的推进剂,关于2NH4ClO4(s)=N2(g)+Cl2(g)+2O2(g+4H2O(g)反应,下列说法不正确的是( )A.0.5mlNH4ClO4完全分解产生气体的体积约为44.8LB.NH4ClO4既是氧化剂又是还原剂C.该反应中,还原产物与氧化产物的物质的量之比为1:3D.上述NH4ClO4的分解反应,反应物的总键能小于生成物的总键能
11.过氧化钠具有强氧化性,遇亚铁离子可将其氧化为一种常见的高效水处理剂,化学方程式为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。下列说法中不正确的是( )A.氧化性:Na2O2>Na2FeO4>FeSO4B.FeSO4只作还原剂,Na2O2既作氧化剂,又作还原剂C.由反应可知每3ml FeSO4完全反应时,反应中共转移12 ml电子D.Na2FeO4处理水时,不仅能杀菌消毒,还能起到净水的作用
题型二 电子转移的表示方法
12.(2024·重庆市名校联盟期中)下列化学方程式中,表示电子转移的方向和数目都正确的是( )A. B.C. D.
13.(2024·辽宁省县级重点中学协作体期中)下列化学方程式中电子转移不正确的是( )A. B.C. D.
14.(2024·湖北省重点高中智学联盟联考)下列化学反应中电子转移的表示方法正确的是( )A. B.C. D.
1.(2023•浙江省6月选考,6)化学烫发巧妙利用了头发中蛋白质发生化学反应实现对头发的“定型”,其变化过程示意图如下。下列说法不正确的是( )A.药剂A具有还原性B.①→②过程若有2 ml S-S键断裂,则转移4 ml电子C.②→③过程若药剂B是H2O2,其还原产物为O2D.化学烫发通过改变头发中某些蛋白质中S-S键位置来实现头发的定型
2.(2023•湖南卷,10)油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3)褪色的主要原因是发生了以下两种化学反应:确的是( )A.S2O32-和SO42-的空间结构都是正四面体形B.反应Ⅰ和Ⅱ中,元素As和S都被氧化C.反应Ⅰ和Ⅱ中,参加反应的 :Ⅰ<ⅡD.反应Ⅰ和Ⅱ中,氧化1 ml As2S3转移的电子数之比为3∶7
3.(2021•湖南选择性考试,8)KIO3常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为6I2+11KClO3+3H2O6 KH(IO3)2+5KCl+3Cl2↑。下列说法错误的是( )A.产生22.4L(标准状况)Cl2时,反应中转移10mle﹣B.反应中氧化剂和还原剂的物质的量之比为11:6C.可用石灰乳吸收反应产生的Cl2制备漂白粉D.可用酸化的淀粉碘化钾溶液检验食盐中IO3-的存在
4.(2021•北京卷,9)电石中混有CaS、Ca3P2等杂质,用电石水解制备乙炔时,乙炔中常混有H2S、PH3,可用CuSO4溶液除去这两种杂质,相应的化学方程式是( )i.CuSO4+H2S=CuS↓+H2SO4ii.11PH3+24CuSO4+12H2O=3H3PO4+24H2SO4+8Cu3P↓下列说法不正确的是A.反应i不能说明H2S的酸性强于H2SO4B.24mlCuSO4完全反应时,可氧化11mlPH3C.H2S、PH3会干扰KMnO4酸性溶液对乙炔性质的检验D.CaS的水解方程式:CaS+2H2O=Ca(OH)2+H2S↑;Ca3P2水解方程式:Ca3P2+6H2O=3Ca(OH)2+2PH3↑
同一种物质浓度越大,氧化性(或还原性)越强:氧化性:浓H2SO4>稀H2SO4,浓HNO3>稀HNO3;还原性:浓HCl>稀HCl
同一种物质,温度越高其氧化性越强:热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。
同一种物质,所处环境酸(碱)性越强其氧化性(还原性)越强。酸性条件: 2MnO4-+6H++5SO32-=2Mn2++5SO42-+3H2O中性条件: 2MnO4-+H2O+3SO32-=2MnO2+3SO42-+2OH-碱性条件: 2MnO4-+2OH-+SO32-=2MnO4-+SO42-+H2O其氧化性为KMnO4(酸性)>KMnO4(中性)>KMnO4(碱性)
定义:n(氧化剂)×变价原子个数×化合价变化值=n(还原剂)×变价原子个数×化合价变化值应用:①直接计算参与反应物质间的数量关系②配平反应方程式
定义:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物应用:①判断氧化性、还原性的相对强弱②判断反应能否正常进行
定义:氧化还原剂强者优先应用::①判断反应能否正常进行。②可判断物质发生反应先后顺序: 向NaBr和NaI的混合溶液中通入Cl2,因I-的还原性强于Br-,先:2I-+Cl2===2Cl-+I2,后:2Br-+Cl2===2Cl-+Br2
定义:最高价只有氧化性(如H2SO4中的S元素),最低价态只有还原性(如H2S中的S元素),处于中间价时既有氧化性又有还原性(如SO2中的S元素)应用:①判断能不能发生②判断同元素不同物质间发生反应时的化合价变化情况
定义:同种元素不同价态间发生归中反应时,元素的化合价只接近而不交叉,最多达到同种价态应用:H2S+H2SO4(浓)=S↓+SO2↑+2H2O、5Cl-+ClO3-+6H+=3Cl2↑+3H2O
反应条件越苛刻,说明反应越难发生Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2OCu+2H2SO4(浓) CuSO4+SO2↑+2H2O
氧化性:浓硝酸>浓硫酸
原电池:负极:电子流出;正极:电子流入;还原性:正极<负极。 ②电解池: 阴极:阳离子的氧化性较强,阳极阴离子的还原性较强。
浓度:越大,氧化剂的氧化性(或还原剂的还原性)越强;温度:越高,氧化剂的氧化性(或还原剂的还原性)越强;酸碱度:①KMnO4在酸性条件下具有较强的氧化性,常温下即可和浓盐酸反应制取氯气;②HNO3(浓)的氧化强于稀的。
性强于HNO3(稀)的氧化性;③HNO3(热)的氧化性强于HNO3(冷)的氧化性。
1.根据下列反应的化学方程式:①I2+SO2+2H2O=H2SO4+2HI;②2FeCl2+Cl2=2FeCl3;③2FeCl3+2HI=2FeCl2+2HCl+I2判断有关物质的还原性强弱顺序是( ) A. I->Fe2+>Cl->SO2 B. Cl->Fe2+>SO2 >I-C. Fe2+>I->Cl->SO2 D. SO2 >I->Fe2+>Cl-
题型一 氧化性还原性强弱判断
2.已知C2O3在酸性溶液中易被还原成C2+,C2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )A.3Cl2+6FeI2 = 2FeCl3+4FeI3 B.Cl2+FeI2 = FeCl2+I2C.C2O3+6HCl(浓) = 2CCl2+Cl2↑+3H2O D.2Fe3++2I-= 2Fe2++I2
3.常温下,在溶液中可发生以下反应:
①16H++10Z-+2XO4-=2X2++5Z2+8H2O②2M2++R2=2M3++2R-③2R-+Z2=R2+2Z-由此判断下列说法错误的是( )A.氧化性强弱顺序为XO4-
5.现有下列几个离子反应:①Cr2O72-+14H++6Cl-=2Cr3++3Cl2↑+7H2O②2Fe2++Br2=2Fe3++2Br-③2Fe3++SO2+2H2O=2Fe2++SO42-+4H+下列有关性质的比较中正确的是( )A.氧化性:Cr2O72->Cl2>Fe3+ B.氧化性:Cl2>Br2>Cr2O72-C.还原性:SO2
6.已知H2SO3+I2+H2O=H2SO4+2HI,将0.1 ml Cl2通入100 mL含等物质的量的HI与H2SO3的混合溶液中,有一半的HI被氧化,则下列说法正确的是( )A.物质的还原性:HI>H2SO3>HClB.H2SO3的物质的量浓度为0.6 ml·L-1C.若再通入0.05 mlCl2,则恰好能将HI和H2SO3完全氧化D.通入0.1 mlCl2发生反应的离子方程式为5Cl2+4H2SO3+2I-+4H2SO3=4SO42-+I2+10Cl-+16H+
7.有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是( )A.氧化剂和还原剂的物质的量之比为1∶8B.该反应说明Fe(NO3)2溶液不宜加酸酸化C.每1 ml NO3-发生氧化反应,转移8 ml e-D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+
题型二 氧化还原反应规律的应用
8.(2023·四川省德阳市高三质检)四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛, 是临床诊断、生物技术和环境化学领域多 和潜在应用的有力工具。水热法制备(Fe3O4)纳米颗粒的反应是:3Fe2++2S2O32-+O2+xOH-= Fe3O4↓+ S4O62-+2H2O。下列问题叙述不正确的是( )A.水热法制备Fe3O4纳米颗粒的反应中,还原剂不只是S2O32-B.反应的离子方程式中x=4C.每生成 1ml Fe3O4, 反应转移的电子为4mlD.被Fe2+还原的O2的物质的量为0.5ml
9.2022年我国空间站的建设举世瞩目,神州十四飞船整装待发。飞船的天线用钛镍记忆合金制造,工业上用钛酸亚铁(FeTiO3)冶炼钛(Ti)的过程是( )反应①:2FeTiO3+6C+7Cl2 2TiCl4+2FeCl3+6CO反应②:在氩气环境中,2Mg+TiCl4 Ti+2MgCl2下列有关说法不正确的是A.反应①中Cl2是氧化剂,C、FeTiO3是还原剂B.反应①中每生成标准状况下6.72LCO气体,转移0.7NA个电子C.反应②中Mg被氧化,TiCl4被还原D.反应①、②中钛元素的化合价都发生了变化
10.(2023·山西省吕梁市高三阶段性测试)(双选)钒元素在酸性溶液中有多种存在形式,其中VO2+为蓝色,VO2+为淡黄色,VO2+具有较强的氧化性,Fe2+、SO32- 等能把VO2+还原为VO2+,向VOSO4溶液中滴加酸性KMnO4溶液,溶液颜色由蓝色变为淡黄色。下列说法正确的是( )A.在酸性溶液中氧化性:MnO4->VO2+>SO42-B.亚硫酸钠溶液与酸性(VO2)2SO4溶液发生反应:2VO2++2H++SO32- =2VO2++ SO42- +H2OC.向VOSO4溶液中滴加FeCl3,溶液由蓝色变为淡黄色D.向含1mlVO2+的溶液中滴加含1mlKMnO4的酸性溶液完全反应,转移电子为5ml
11.(2024·江苏苏州高三期中)硼单质及其化合物有重要的应用。硼晶体熔点为2076℃,可形成多种卤化物。BF3可与NH3反应生成NH3BF3。BCl3可与H2反应生成乙硼烷B2H6 (标准燃烧热为2165KJ·ml-1 ),其分子中一个硼与周围的四个氢形成正四面体,结构式为 ,具有还原性。乙硼烷易水解生成H3BO3与H2,H3BO3是一种一元弱酸,可作吸水剂。乙硼烷可与NH3反应生成氨硼烷(NH3BF3),其在一定条件下可以脱氢,最终得到BN。乙硼烷也可与NaH反应生成NaBH4,是一种常用的还原剂。下列物质的结构、性质、用途之间不具有对应关系的是( )A.B电负性小于H,NaBH4可用作还原剂B.H3BO3有弱酸性,可用作吸水剂C.BF3中B有空轨道,易与NH3形成NH3BF3D.NH3BF3可以脱氢,可用作储氢材料
12.(2024·宁夏银川高三第三次月考)向1LFeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-和Fe2+、Fe3+的物质的量随 的值的变化分别如图1、图2所示已知:5Cl2+I2+6H2O=2IO3-+10Cl-+12H+。下列说法正确的是( )A.图1中b表示IO3-,图2中e表示Fe3+B.由图可知,FeI2的物质的量浓度为1 ml·L-1C. =4时,溶液中的I2与Fe3+的物质的量相等D.还原性:I->Fe2+>I2>Cl-
1.(2021•河北选择性考试)绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了Cr—Fe—Al—Mg的深度利用和Na+内循环。工艺流程如图:
1.回答下列问题:(1)高温连续氧化工序中被氧化的元素是____________(填元素符号)。(2)工序①的名称为____________________。(3)滤渣的主要成分是___________(填化学式)。(4)工序③中发生反应的离子方程式为______________________________。
MgO、Fe2O3
2Na2CrO4+2CO2+H2O= Na2Cr2O7+2NaHCO3↓
1.回答下列问题:(5)物质V可代替高温连续氧化工序中的NaOH,此时发生的主要反应的化学方程式为____________________________,可代替NaOH的化学试剂还有_______(填化学式)。(6)热解工序产生的混合气体最适宜返回工序_____(填“①”或“②”或“③”或“④”)参与内循环。(7)工序④溶液中的铝元素恰好完全转化为沉淀的pH为____________________。(通常认为溶液中离子浓度小于10-5ml•L-1为沉淀完全;A1(OH)3+OH- Al(OH)4-:K=100.63,Kw=10-14,Ksp[Al(OH)3]=10-33)
2.(2021·福建卷,11)四钼酸铵是钼深加工的重要中间产品具有广泛的用途。一种以钼精矿(主要含MS2,还有Cu、Fe的化合物及SiO2等)为原料制备四钼酸铵的工艺流程如下图所示。回答下列问题:(1)“净化”后,溶液中若有低价钼(MO32-表示),可加入适量H2O2将其氧化为MO42-,反应的离子方程式为_________________________________________。(2)高温下用H2还原(NH4)2M4O13可制得金属钼,反应的化学方程式为_______。【已知:(NH4)2M4O13受热分解生成MO3】
H2O2+MO32-= MO42-+H2O
3.(2021•湖南卷,17)Ce2(CO3)3可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以CePO4形式存在,还含有SiO2、Al2O3、Fe2O3、CaF2等物质。以独居石为原料制备Ce2(CO3)3•nH2O的工艺流程如图:回答下列问题:(1)“沉铈”过程中,生成Ce2(CO3)3•nH2O的离子方程式为 ;(2)滤渣Ⅱ的主要成分为FePO4,在高温条件下,Li2CO3、葡萄糖(C6H12O6)和FePO4可制备电极材料LiFePO4,同时生成CO和H2O,该反应的化学方程式为:
2Ce3++6HCO3-+(n﹣3)H2O=Ce2(CO3)3•nH2O+3CO2↑
陌生化学方程式书写的思路
写:出部分反应物和生成物的化学式
判断:元素化合价无变化则为非氧化还原反应,遵循原子守恒定律
检查:元素化合价有变化则为氧化还原反应,除遵循原子守恒定律外,还要遵循得失电子守恒规律
解答:化学方程式或离子方程式
看环境,配H+、OH-
1.(2024·黑龙江龙东五地市联考期中)将Cl2通入70℃的氢氧化钠水溶液中,能同时发生以下两个反应(均未配平):NaOH+Cl2→NaCl+NaClO+H2O,NaOH+Cl2→NaCl+NaClO3+H2O,反应完成后测得溶液中NaClO与NaClO3的物质的量浓度之比为5:2,则该溶液中NaClO与NaCl的物质的量之比为( )A.5:2 B.2:5 C.5:16 D.1:3
2.高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,反应方程式如下:KMnO4+FeSO4+H2SO4 K2SO4+MnSO4+Fe2(SO4)3+H2O(未配平)。下列说法正确的是( )。A.Fe2+的还原性强于Mn2+ B.MnO4-是氧化剂,Fe3+是还原产物C.氧化剂和还原剂物质的量之比为5∶1 D.生成1 ml水时,转移2.5 ml电子
3.NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的化学方程式是:MnO4-+NO2-+H+→Mn2++NO3-+H2O。下列叙述中正确的是( )A.该反应中NO2-被还原 B.反应过程中溶液的pH减小C.生成1 ml NaNO3需消耗0.4 mlKMnO4 D.中的粒子是OH-
4.(2023·河南省洛阳创新发展联盟高三调研)二氧化氯(ClO2)是一种优良的消毒剂,可用氯酸钠和双氧水在酸性条件下反应制备:NaClO3+H2O2+H2SO4→ClO2↑+O2↑+Na2SO4+H2O (未配平)。下列说法正确的是( )A.每转移1ml电子,生成标准状况下11.2LO2 B.H2O2是氧化剂,发生氧化反应C.H2O是还原产物 D.产物中ClO2与O2的物质的量之比为1∶2
5.已知二氧化硒是一种氧化剂,它可由Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O制取。又知离子方程式aSeO2+bSO2+cH2O===aSe+b X +d Y ;则关于下列叙述正确的是( )A.a∶b=1∶1 B.Y为OH-C.氧化性为SeO2>H2SO4(浓) D.若每生成0.2 ml X则该反应转移0.4NA个电子
6.FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+Fe2O3+CO2+NaNO2上述反应配平后FeO·Cr2O3与NaNO3的系数比为________。该步骤不能使用陶瓷容器,原因是______________________________________________。7.MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平),其化学计量数依次为_____________________。
陶瓷在高温下会与Na2CO3反应
1,2,4,1,1,3
8.高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂作剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe2+离子.配平制取铁酸钠的化学方程式:______Fe(NO3)3+______NaOH+______Cl2═_______Na2FeO4+_____NaCl+6NaNO3+8H2O.反应中,________元素被氧化,每生成8ml H2O转移电子总数为________。
9.高锰酸钾(KMnO4)和过氧化氢(H2O2)是两种常见的氧化剂。(1)下列物质中能使酸性KMnO4溶液褪色的是________(填字母)。a.臭碱(Na2S) b.小苏打(NaHCO3)c.水玻璃(Na2SiO3溶液) d.酒精(C2H5OH)(2)某强酸性反应体系中,参与反应的共有六种微粒:O2、MnO4-、H2O、Mn2+、H2O2、H+。①该反应中应选择的酸是________(填字母)。a.盐酸 b.浓硫酸 c.稀硫酸 d.稀硝酸②该反应中发生还原反应的过程是________→________。③写出该反应的离子方程式:____________________________________。④若上述反应中有6.72 L(标准状况)气体生成,则转移的电子为________ml。
2MnO4-+5H2O2+6H+===2Mn2++8H2O+5O2↑
10.常温下,二氧化氯(ClO2)是一种黄绿色气体,具有强氧化性,已被联合国世界卫生组织(WHO)列为AI级高效安全消毒剂。常温下,它可用氯酸钠固体与浓盐酸反应制备得到,该反应体系中的物质有NaCl 、H2O、ClO2、NaClO3、Cl2、HCl。(1)写出并配平该反应的化学方程式 _____________________________________。(2)该反应的还原产物是_____________。(3)在标准状况下,如果反应中生成11.2L氯气,则被氧化的HCl的物质的量为______,转移电子数目为 ___________。(4)二氧化氯可迅速氧化硫化物(其中还原产物中氯元素为负一价),以除去水中硫化物产生的臭味。取适量ClO2通入到含有H2S(二元弱酸)的水中,再向其中加入少量氯化钡溶液,发现有白色沉淀生成。写出ClO2与H2S水溶液反应的离子方程式_________________________________。
2NaClO3 + 4HCl(浓)= 2ClO2↑ + Cl2↑ + 2H2O + 2NaCl
6.02×1023或NA
5H2S + 8ClO2 + 4H2O = 5SO42- + 8Cl- + 18H+
专题04 氧化还原反应(课件)-2024年高考化学二轮复习讲与练(新教材新高考): 这是一份专题04 氧化还原反应(课件)-2024年高考化学二轮复习讲与练(新教材新高考),共60页。PPT课件主要包含了PARTONE,Cl系列,S系列,N系列,O系列,Mn系列,Fe系列,Cr系列,电子转移,电子守恒等内容,欢迎下载使用。
专题09+化学反应原理综合(题型突破)(课件)-2024年高考化学二轮复习讲练测(新教材新高考): 这是一份专题09+化学反应原理综合(题型突破)(课件)-2024年高考化学二轮复习讲练测(新教材新高考),共60页。PPT课件主要包含了PARTONE等内容,欢迎下载使用。
专题07+化学反应速率与化学平衡(课件)-2024年高考化学二轮复习讲练测(新教材新高考): 这是一份专题07+化学反应速率与化学平衡(课件)-2024年高考化学二轮复习讲练测(新教材新高考),共60页。PPT课件主要包含了PARTONE等内容,欢迎下载使用。












