
第29讲 物质的转化(二)-备考2024年中考科学一轮复习专题练习(浙江专用)
展开命题趋势
1.物质的检验与鉴别的命题点有:①利用复分解反应原理根据物质的反应现象等进行检验物质;②利用物质的一些特殊化学性质和特殊现象检验物质,多在表格型的选择题中结合常见的分离方法出现。
2.物质的分离提纯的命题点有:①过滤、结晶、蒸馏等实验操作及其注意事项;②物理方法和化学方法分离的选择及主要事项;③以粗盐提纯为蓝本的混合盐类的溶液配制、除杂、分离综合等。
3.物质的推断与识别的命题点有:①复分解反应的实质及复分解反应的条件;②利用复分解反应原理判断离子或物质是否共存;③利用复分解反应原理进行物质的分离提纯;④利用复分解反应原理进行物质的检验和识别等,考察形式多样、在选择、填空、探究中均可以出现,常常是以一包白色固体中判断其中成分为背景。
知识重构
考点一 混合物的分离
混合物的分离:混合物的分离是将混合物中的几种成分各自分开,得到较纯净的物质。用化学方法分离混合物时,选择试剂要考虑是否能再恢复到原样。例如分、时,应在混合物中加入稀,得到,将生成的二氧化碳气体通入氢氧化钠溶液,得到,但不能加入溶液或溶液,否则得不到原物质。
考点二、 混合物的提纯
混合物的提纯:混合物的提纯就是除去物质中混有的杂质。提纯不要求将杂质恢复到原样,但要求样品量不减少,且不带入新的杂质。例如除去中混有的少量。应加入溶液而不能加入溶液。如果用,就会使中又混进。
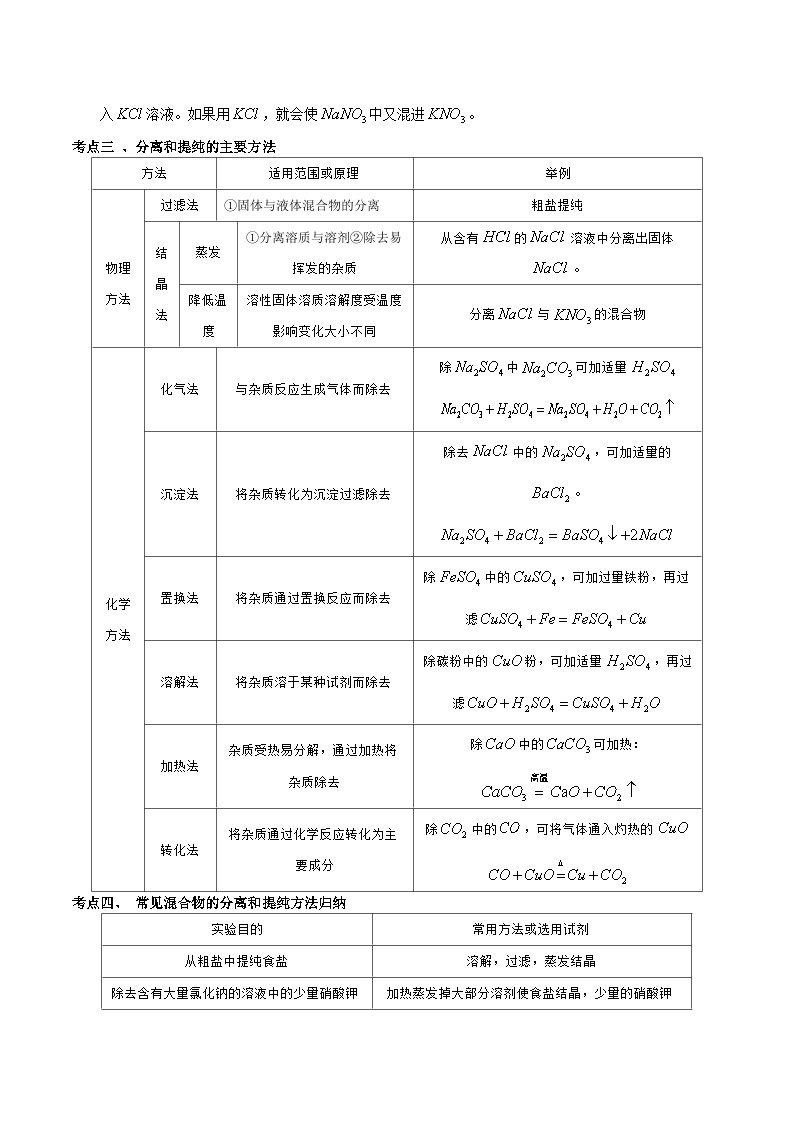
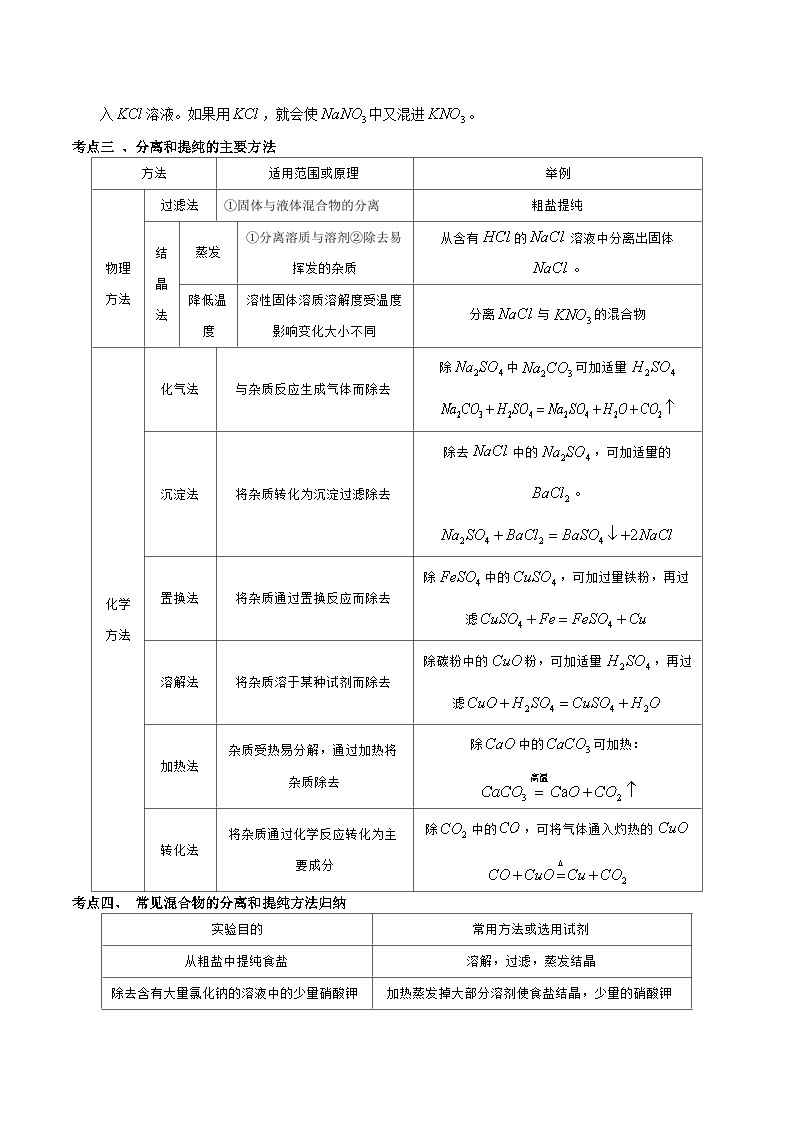
考点三 、分离和提纯的主要方法
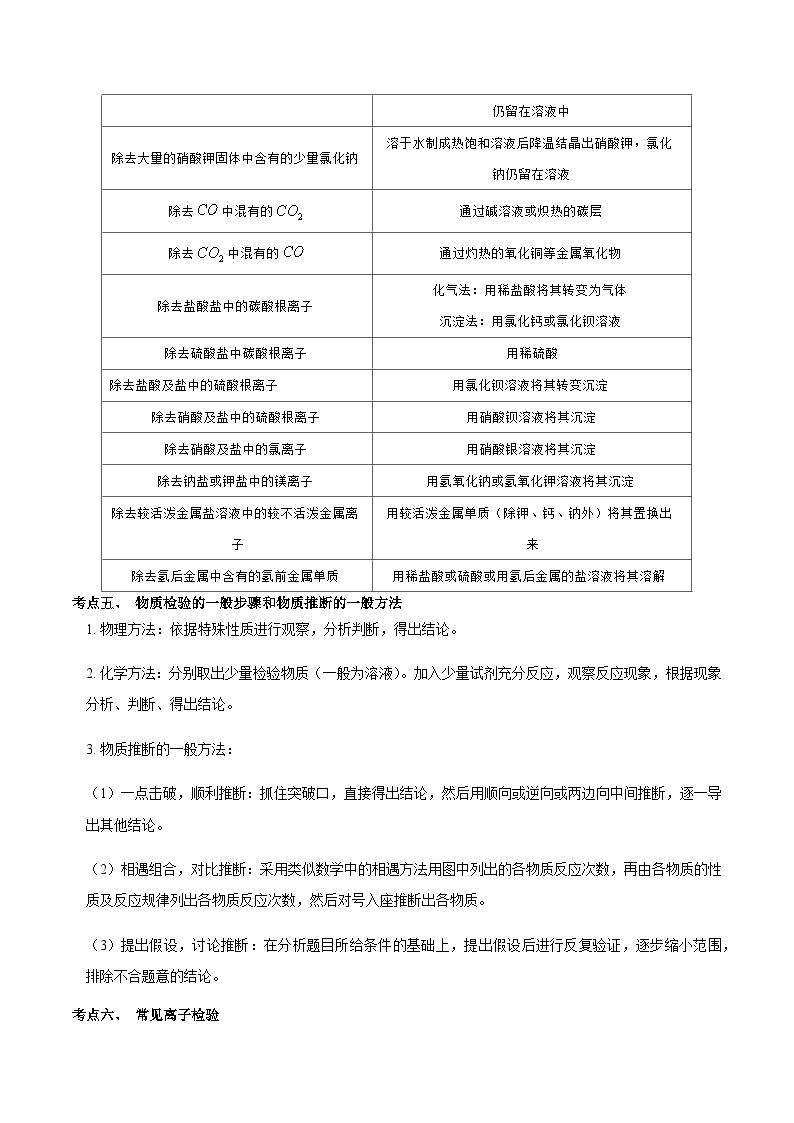
考点四、 常见混合物的分离和提纯方法归纳
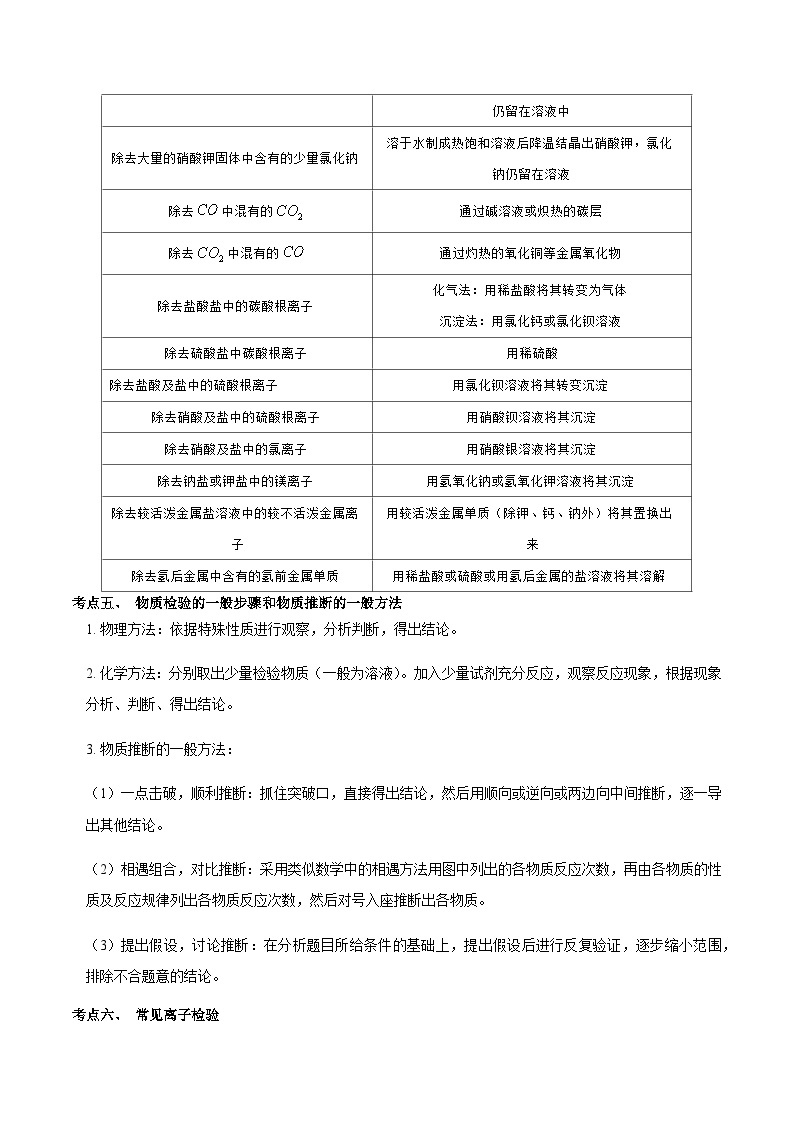
考点五、 物质检验的一般步骤和物质推断的一般方法
物理方法:依据特殊性质进行观察,分析判断,得出结论。
化学方法:分别取出少量检验物质(一般为溶液)。加入少量试剂充分反应,观察反应现象,根据现象分析、判断、得出结论。
物质推断的一般方法:
一点击破,顺利推断:抓住突破口,直接得出结论,然后用顺向或逆向或两边向中间推断,逐一导出其他结论。
相遇组合,对比推断:采用类似数学中的相遇方法用图中列出的各物质反应次数,再由各物质的性质及反应规律列出各物质反应次数,然后对号入座推断出各物质。
提出假设,讨论推断:在分析题目所给条件的基础上,提出假设后进行反复验证,逐步缩小范围,排除不合题意的结论。
考点六、 常见离子检验
考点七、 常见物质鉴别
考点八、 物质的特征颜色和反应
物质的特征颜色
特征反应
知识点精炼
一、物质的检验与鉴别
1.下列各组物质的溶液,不另加试剂就能鉴别出来的一组是( )
A. Na2CO3、HCl、H2SO4 B. KCl、NaCl、Na2SO4
C. FeCl3、NaOH、KNO3 D. HCl、NaOH、Ca(OH)2
【答案】 C
【解析】、A、所给物质没有特殊颜色的溶液,两两反应时只能鉴别出硫酸,而碳酸钠与盐酸无法鉴别,不符合题意;
B、所给物质没有特殊颜色且两两间都不发生反应,无法鉴别,不符合题意;
C、先利用溶液颜色找出黄色溶液氯化铁,再将氯化铁滴入到另两种溶液中,产生红褐色沉淀的为氢氧化钠,无明显现象的为硝酸钾,符合题意;
D、所给物质没有特殊颜色且两两反应都没有明显现象,无法鉴别,不符合题意; 故选C。
2.(2021九上·龙湾期中)有甲、乙、丙、丁四种无色溶液,它们分别是Na2CO3、BaCl2、HCl、H2SO4溶液中的一种。为区别这四种溶液,现将它们两两混合并得到下面现象:
根据对上述现象的分析,可推知甲、乙、丙、丁四种溶液的顺序依次是( )
A. HCl、BaCl2、Na2CO3、H2SO4 B. Na2CO3、BaCl2、H2SO4、HCl
C. H2SO4、HCl、Na2CO3、BaCl2 D. HCl、H2SO4、BaCl2、Na2CO3
【答案】 D
【解析】①甲+乙,没有明显现象,那么它们应该为稀盐酸和稀硫酸,而丙+丁应该为碳酸钠和氯化钡,二者正好生成碳酸钡白色沉淀;
②乙+丙,生成白色沉淀。根据①中分析,只有稀硫酸和氯化钡反应,生成硫酸钡白色沉淀,则乙为稀硫酸,丙为氯化钡,而甲为稀盐酸,丁为碳酸钠。
故D正确,而A、B、C错误。 故选D。
3.(2021九上·绍兴期中)下列各组稀溶液中,利用组内物质相互反应就能加以鉴别的是 ( )
A. Na2CO3、H2SO4、HCl、KNO3 B. Na2SO4、Na2CO3、BaCl2、HNO3
C. CuSO4、KOH、NaCl、NaOH D. NaNO3、MgCl2、KCl、Ba(OH)2
【答案】 B
【解析】A、两两反应,能产生两种气体的为碳酸钠,都无明显现象的为硝酸钾,但硫酸和盐酸无法鉴别,不符合题意;
B、两两反应,能产生两种沉淀的为氯化钡,既有沉淀又有气体的为碳酸钠,只一种气体现象的为硝酸,只一种沉淀现象的为硫酸钠,可以鉴别,符合题意;
C、先观察颜色鉴别出蓝色溶液硫酸铜,再将硫酸铜加入另三种溶液中,不产生蓝色沉淀的为氯化钠,氢氧化钠和氢氧化钾都与硫酸铜反应产生蓝色沉淀,无法鉴别,不符合题意;
D、两两反应,产生沉淀的为氯化镁和氢氧化钡的一种,无明显现象的为硝酸钠和氯化钾中的一种,无法继续鉴别,不符合题意; 故选B。
4.(2021九上·义乌期中)有三瓶失去标签的无色溶液,它们分别是Ba(OH)2、Na2CO3、NaNO3溶液中的一种,若只用一种试剂将它们一次性鉴别出来,应选用下列试剂中的( )
A. BaCl2 B. H2SO4 C. NaOH D. Ba(OH)2
【答案】 B
【解析】A、氯化钡只能鉴别出与其反应产生沉淀的碳酸钠,氢氧化钡和硝酸钠无法鉴别,不符合题意;
B、加入硫酸,产生沉淀的为氢氧化钡,产生气体的为碳酸钠,无明显现象的为硝酸钠,符合题意;
C、氢氧化钠与三种物质都不反应,无法鉴别,不符合题意;
D、氢氧化钡只能鉴别出与其反应生成沉淀的碳酸钠,不符合题意; 故选B。
5.(2021九上·义乌期中)现有甲、乙、丙、丁四瓶失去标签的无色溶液,只知道它们是稀盐酸、CaCl2溶液、Na2CO3溶液、AgNO3溶液,按下表中实验顺序两两混合进行实验,现象如表所述.第5次实验是把乙和丁混合,将出现的现象是(提示:反应中生成的Ag2CO3难溶于水)( )
A. 有气体产生 B. 有沉淀生成 C. 无明显现象 D. 不能确定
【答案】 B
【解析】丙和甲、丁都能反应产生沉淀,甲和乙反应产生气体,由此可知,甲为碳酸钠,乙为稀盐酸,乙和丙无明显现象,则丙为氯化钙,丁为硝酸银,盐酸与硝酸银反应会产生氯化银沉淀; 故选B。
6.(2021九上·余姚期中)某溶液的溶质未知,可能为FeCl3、Cu(NO3)2、NaCl、CuCl2 , 现在将该溶液分别滴加到NaOH溶液、稀盐酸、AgNO3溶液中,产生的现象如表所述。则该溶液是( )
A. FeCl3溶液 B. Cu(NO3)2溶液 C. NaCl溶液 D. CuCl2溶液
【答案】 D
【解析】A、将氯化铁溶液滴加道氢氧化钠溶液中不会生成蓝色沉淀,A不符合题意;
B、硝酸铜溶液本就是蓝色的,滴加到硝酸银溶液中,并不反应,B不符合题意;
C、氯化钠和氢氧化钠并不反应,所以不会生成蓝色沉淀,C不符合题意;
D、氯化铜溶液与氢氧化钠溶液反应生成氢氧化铜沉淀,为蓝色,而滴加到稀盐酸并无明显现象,氯化铜和硝酸银反应生成白色沉淀,D符合题意。 故答案为:D
7.(2021九上·台州期中)有一物质 X,分成等量的三份,分别加入到足量的 NaOH 溶液、氯化钡溶液、HCl 溶液中,产生的现象如表。则该物质X 是下列各项中的( )
A. CuO 固体 B. (NH4)2CO3 粉末 C. 稀硫酸 D. CuSO4 溶液
【答案】 D
【解析】A.氧化铜不能与氢氧化钠反应,故A不合题意;
B.碳酸氢铵与氢氧化钠反应,生成碳酸钠、水和氨气,没有蓝色沉淀生成,故B不合题意;
C.稀硫酸与氢氧化钠反应,生成硫酸钠和水,没有蓝色沉淀,故C不合题意;
D.硫酸铜溶液与氢氧化钠反应,生成氢氧化铜蓝色沉淀与硫酸钠;硫酸铜与氯化钡反应,生成硫酸钡白色沉淀和氯化铜;硫酸铜与稀盐酸不反应,故D符合题意。 故选D。
8.(2021九上·兰溪月考)下列各组的溶液,不用其它试剂就可以鉴别的是( )
A. KCl NaCl NH4Cl NH3H2O B. CuSO4 NaCl KOH ZnCl2
C. Na2SO4 HCl NaCl AgNO3 D. FeCl3 NaNO3 K2SO4 NaCl
【答案】 B
【解析】A.组内四种物质的溶液两两混合时,均不反应而无明显现象,不加其他试剂无法鉴别,故A不合题意;
B.CuSO4溶液是蓝色的,能与CuSO4溶液反应产生蓝色沉淀的是的是KOH溶液,能与KOH溶液反应产生白色沉淀的是ZnCl2溶液,无明显变化的是氯化钠溶液,不加其他试剂可以鉴别,故B符合题意;
C.组内四种物质的溶液两两混合时,AgNO3与Na2SO4、HCl、NaCl混合时产生白色沉淀,但其余两两混合均没有明显现象,不加其他试剂无法鉴别,故C不合题意;
D.FeCl3溶液呈黄色,首先鉴别出黄色的FeCl3溶液,但其余两两混合均没有明显现象,不加其他试剂无法鉴别,故D不合题意。故选B。
9.(2021九上·萧山月考)某 NaCl样品中可能混有CuCl2、MgCl2、BaCl2中的一种或几种物质。取该样品11.7g溶于适量水中,得到无色溶液,然后向其中加入足量的硝酸银溶液,得到30.7g白色沉淀,则该样品组成的下列推断中,正确的是( )
A. 一定有MgCl2 , 可能有CuCl2 B. 一定有MgCl2 , 没有BaCl2
C. 一定有MgCl2 , 可能有BaCl2 D. 一定有 MgCl2、BaCl2
【答案】 C
【解析】取该样品11.7克溶于适量水中,得到澄清的无色溶液,说明一定不含有蓝色的氯化铜溶液,故A错误;然后向其中加入足量AgNO3溶液,得到30.7克白色沉淀,假设11.7g是纯的氯化钠,产生氯化银的质量为x,
NaCl~AgCl
58.5 143.5
11.7g x
=143.5x;
解得:x=28.7g。
设纯净的氯化镁反应产生氯化银沉淀的质量为y,
MgCl2~2AgCl
95 287
11.7g y
9511.7g=287y;
解得:y≈35.3g
设纯净的氯化钡反应产生氯化银沉淀的质量为z
BaCl2~2AgCl
208 287
11.7g z
20811.7g=287z解得:z=16.1g。
综上所述,氯化镁会使沉淀质量增大,而氯化钡会使沉淀质量减小。
因此一定有MgCl2 , 可能有BaCl2。
故C正确,而B、D错误。故选C。
10.(2021九上·杭州期中)小兰同学设计了一个验证某NaCl溶液中是否混有Na2CO3、Na2SO4和NaOH的实验流程,如图所示。(已知BaCl2溶液呈中性)
(1)试管A中的溶液呈红色,则不一定有氢氧化钠,因为 。
(2)滴加过量BaCl2溶液,充分反应后试管B中有白色沉淀产生,溶液仍显红色,则可判断原溶液中一定含有 。(填化学式)
(3)再向C中加入适量X溶液,即可确定溶液成分,则X溶液可能是 (填字母)。
A. 稀HCl B. 稀H2SO4 C. CaCl2
【答案】 (1)碳酸钠的水溶液也呈碱性,也能使无色酚酞试液变红色(2)NaOH(3)A
【解析】(1)试管A中的溶液呈红色,则不一定有氢氧化钠,因为:碳酸钠的水溶液也呈碱性,也能使无色酚酞试液变红色。
(2)滴加过量BaCl2溶液,充分反应后试管B中有白色沉淀产生,溶液仍显红色,则可判断原溶液中一定含有NaOH。
(3)滴加稀盐酸后,如果沉淀全部溶解,那么溶液中含有氢氧化钠和碳酸钠;如果溶液中沉淀部分溶解,那么含有氢氧化钠,硫酸钠和碳酸钠;如果沉淀不溶解,那么含有氢氧化钠和硫酸钠,故选A。
11.(2021九上·余姚期中)为鉴别CuSO4、KOH、BaCl2、NaCl四种失去标签的溶液,做如下实验。
(1)通过观察就可以鉴别出CuSO4溶液,依据是 。
(2)将剩余三种溶液分别取样,滴加酚酞溶液,变红的是 。
(3)取鉴别出的CuSO4溶液,依次加入到使酚酞溶液不变色的剩余二种溶液中。依据出现的现象: , 鉴别出BaCl2溶液,至此溶液鉴定完毕。
【答案】 (1)蓝色(2)KOH(3)白色沉淀
【解析】(1)硫酸铜溶液是蓝色的,这是判断该物质的依据。
(2)KOH是碱性溶液,因此滴加酚酞溶液会变红。
(3)硫酸铜与氯化钡反应化学式为CuSO4+BaCl2=BaSO4↓+CuCl2 , 经过复分解反应,生成不溶于硝酸的白色沉淀,溶液还是蓝色。
12.(2021·宁波模拟)某兴趣小组用NaCl溶液、NaOH溶液和稀H2SO4三种试剂,将含有Cu2+、Ba2+、Ag+和NO3﹣的混合溶液中的三种阳离子逐一除去。步骤如下(所加试剂均过量):
步骤一:混合物中加入试剂A,过滤得到沉淀1和滤液1;
步骤二:滤液1中加入试剂B,过滤得到沉淀2和滤液2;
步骤三:滤液2中加入试剂C,过滤得到沉淀3和滤液3.
(1)按要求,A试剂应选择的是________。
(2)三种沉淀中,能溶于稀盐酸的是________(填物质名称)。
(3)滤液3中,除NaNO3外还含有的盐是________。
【答案】 (1)NaCl溶液(2)氢氧化铜(3)NaCl和Na2SO4
【解析】(1)按要求,A试剂应选择的是NaCl溶液;
(2)三种沉淀中,只有沉淀Cu(OH)2能够与稀盐酸反应,生成氯化铜和水,则能溶于稀盐酸的是氢氧化铜。 (3)在步骤一中,加入的NaCl是过量的,则滤液3中肯定含有盐NaCl;步骤二中,稀硫酸过量,而步骤三中氢氧化钠过量,二者反应生成硫酸钠和水,则滤液3中,除NaNO3外,还含有的盐为NaCl和Na2SO4。
13. 现有A、B、C、D、E五种溶液,它们分别是氢氧化钠溶液、硫酸铜溶液、碳酸钠溶液、氯化钠溶液和稀硫酸中的一种.鉴别它们可按如图所示的步骤进行,回答下列问题:
(1)B中的溶质是________ (填化学式).
(2)用X鉴别D、E时,X可以选用不同的物质.
①若X为稀盐酸,写出有气体生成的反应的化学方程式 ;________
②若X为澄清石灰水,写出有沉淀生成的反应的化学方程式 ________ .
【答案】 (1)CuSO4(2)Na2CO3+2HCl=2NaCl+H2O+CO2↑;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
【解析】硫酸铜在溶液中显蓝色,氢氧化钠、碳酸钠溶液显碱性,能使紫色石蕊试液显蓝色,稀硫酸显酸性,能使紫色石蕊试液显红色,氯化钠溶液显中性,不能使紫色石蕊试液变色,碳酸钠会与酸反应生成二氧化碳气体,会与钙离子、钡离子反应生成白色沉淀.
(1)取五种溶液观察颜色,B溶液显蓝色,所以B是硫酸铜,剩余的四种溶液加入紫色石蕊试液,A溶液显红色,所以A是稀硫酸,B溶液显紫色,所以B是氯化钠溶液,D、E溶液显蓝色,所以D、E是氢氧化钠溶液、碳酸钠溶液,经过验证,推导正确,所以B中的溶质是CuSO4;
(2)①若X为稀盐酸,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
②若X为澄清石灰水,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
二、物质的分离提纯
14.(2019·吴兴模拟)通过海水晒得的粗盐,除NaCl外,还含有MgCl2、CaCl2等杂质,将粗盐按如图流程,可获得较纯净的氯化钠,以备工业生产所需。在此过程中,a、b物质分别为()
A. NaOH、K2CO3 B. Ca(OH)2、Na2CO3 C. KOH、K2CO3 D. KOH、Na2CO3
【答案】 B
【解析】(1)将粗盐加水溶解,这时溶液中含有NaCl、MgCl2、CaCl2;
(2)因为Ca(OH)2与MgCl2反应生成Mg(OH)2沉淀和CaCl2,所以a溶液可能是Ca(OH)2;
(3)溶液A中含有CaCl2 , 因为CaCl2与Na2(CO)3反应生成碳酸钙沉淀和NaCl,所以b物质是Na2(CO)3;
(4)最后如果有剩余的Na2(CO)3 , 可以与稀盐酸反应生成NaCl,到此除杂结束。
因此a物质是Ca(OH)2 , b物质是Na2(CO)3。 故选B。
15.(2017九上·杭州月考)实验室有一瓶标签脱落的固体试剂,小金同学分别取少量的该固体进行下列实验。根据实验现象判断,该固体最可能是( )
A. 金属单质 B. 金属氧化物 C. 碱 D. 盐
【答案】 B
【解析】由表格中实验一:取该固体于试管中,加水、振荡,固体不溶解,说明固体不溶于水。由实验二:取该固体于试管中,加盐酸、振荡,固体溶解,无气体放出,说明固体不是金属,不溶性的盐与酸能反应的一般是碳酸盐,无气体放出说明不可能是盐,C错误;由实验三:固体灼热状态下,通入纯净CO,固体质量减轻,尾气中只检测到CO与CO2 , 由尾气中只检测到CO和CO2可推知固体质量减轻是由于CO夺取了固体中的氧元素,综上现象可确定此固体物质是金属氧化物,B选项正确。故选B
16.(2021九上·浙江期中)如下除杂、制备、鉴别实验能够达到目的是( )
A. 除去KNO3溶液中混有的K2SO4 , 加入适量的BaCl2溶液,过滤
B. 制备Cu(OH)2 , 可将Ba(OH)2溶液和适量CuSO4溶液混合,过滤
C. 鉴别NaOH、NaCl、CuSO4和稀HCl四种溶液,不需添加任何试剂就可完成
D. 除去氢氧化钠溶液中的碳酸钠,加入过量的氢氧化钡溶液,过滤
【答案】 C
【解析】A、 除去KNO3溶液中混有的K2SO4 , 加入适量的BaCl2溶液,会引入新杂质氯化钾,不符合题意;
B、将Ba(OH)2溶液和适量CuSO4溶液混合, 制备Cu(OH)2中会混有硫酸钡沉淀,不能分离 ,不符合题意;
C、先观察颜色,溶液呈蓝色的为硫酸铜,再将硫酸铜滴入另三种溶液中,产生蓝色沉淀的为氢氧化钠,然后将另两种溶液分虽滴入蓝色沉淀中,沉淀消失的为盐酸,不消失的为氯化钠,符合题意;
D、 加入过量的氢氧化钡溶液除氢氧化钠溶液中的碳酸钠,会引入氢氧化钡新杂质 ,不符合题意; 故选C。
17.(2021九上·绍兴期中)为了达到实验目的,下列方案或结论正确的是( )
A. A B. B C. C D. D
【答案】 C
【解析】A、 通入装有足量NaOH溶液的洗气瓶 ,二氧化碳和氯化氢都会与氢氧化钠反应,不符合题意;
B、加入足量稀硫酸,硫酸与碳酸钾反应会和成硫酸钾,引入新杂质,不符合题意;
C、分别加入稀盐酸,产生气泡的为铁粉,固体溶解,溶液呈蓝色的为氧化铜,不反应的为碳粉,可以鉴别,符合题意; D、取少量溶液于试管中,滴加BaCl2溶液,有白色沉淀生成,该溶液中可能有硫酸根离子,可能有银离子或碳酸根离子 ,不符合题意; 故选C。
18.(2021九上·浙江月考)下列除杂质的方法错误的是( )
A. A B. B C. C D. D
【答案】 D
【解析】A:NaCl易溶于水,泥沙难溶于水,可采用溶解、过滤、蒸发得到NaCl,A正确,不符合题意;
B:CuCl2+Fe=FeCl2+Cu,置换出的铜和过量的铁粉可过滤除去,B正确,不符合题意;
C:2HCl+CaCO3=CaCl2+H2O+CO2↑,过量CaCO3可过滤除去,C正确,不符合题意;
D:CO2+Ca(OH)2=CaCO3↓+H2O,被提纯物减少,D错误,符合题意。 故答案为:D
19.(2021九上·浙江月考)北宋沈括在《梦溪笔谈》中记载了用“苦泉水”制取铜的方法,其主要生产流程如图所示。下列解释合理的是( )
A. ①通过蒸发溶剂可获得晶体 B. ②是通过复分解反应获得铜
C. ③所得硫酸铜溶液一定是饱和的 D. ④说明铁元素变成了铜元素
【答案】 A
【解析】A、“苦泉水”加热后能获得硫酸铜晶体,①通过蒸发溶剂可获得晶体,故选项说法正确。
B、②是用炭火烧的方法获得铜,生成物中铜是单质,不属于复分解反应,故选项说法错误。
C、硫酸铜晶体加水溶解形成硫酸铜溶液,③所得硫酸铜溶液不一定是饱和的,故选项说法错误。
D、④是铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜,而不是说明铁元素变成了铜元素,故选项说法错误。 故选:A。
20.下列实验 ,不能达到实验目的的是( )。
A.用酚酞试液鉴别稀硫酸和氯化钠溶液
B.用燃着的木条置于集气瓶口检验CO2是否集满
C.检验未知溶液是否含有Cl- , 先加AgNO3溶液,再加稀硝酸
D.用锌粒和稀硫酸反应制取氢气
【答案】 A
【解析】A、稀硫酸呈酸性,氯化钠溶液呈中性,都不能使酚酞变色,不能鉴别 ,符合题意;
B、用燃着的木条置于集气瓶口观察木条是否熄灭来检验CO2是否集满 ,不符合题意;
C、检验未知溶液是否含有Cl- , 先加AgNO3溶液,再加稀硝酸 ,若产生不溶于硝酸的白色沉淀则含氯离子 ,不符合题意; D、用锌粒和稀硫酸反应制取氢气 ,不符合题意; 故选A。
21.(2021九上·义乌期中)为了确定某含杂质的硝酸钠溶液中所含杂质的成分,某同学设计了如下实验:
请回答下列问题:
(1)I,Ⅱ为 操作。
(2)经分析,原溶液中的杂质可能由一种或几种物质组成。杂质的成分可能是:
①若原溶液中的杂质由一种物质组成,则该杂质是 ;(填物质的名称)
②若原溶液中的杂质由两种物质组成,则该杂质的成分组成可能有 种情况;
【答案】 (1)过滤(2)氯化钙;3
【解析】(1)操作I和II都用于分离溶液和白色沉淀,因此都是过滤。
(2)加入硝酸银溶液后,生成了不溶于稀硝酸的白色沉淀,那么沉淀就是氯化银,即溶液中存在氯离子。在无色溶液B中加入碳酸钠溶液后,生成了白色沉淀碳酸钙,那么溶液中肯定存在钙离子。
①若原溶液中的杂质由一种物质组成,则该杂质是氯化钙;
②溶液中的离子分别为硝酸根离子、氯离子、钙离子和钠离子,那么杂质还可能为硝酸钙、氯化钙和氯化钠。两两组合为:硝酸钙和氯化钙;硝酸钙和氯化钠;氯化钙和氯化钠,因此两种杂质的可能有3种。
22.(2020九上·镇海期中)某粗盐提纯后得到的“精盐”中还含有少量可溶性杂质CaCl2、MgCl2。小青同学设计了以下实验方案来除去可溶性杂质。
(1)步骤①的化学方程式为________ 。
(2)步骤②中得到的白色沉淀是________ (填化学式)。
(3)步骤③中加稀盐酸是为了除去溶液中的 ( )
【答案】 (1)MgCl2+2NaOH= Mg(OH)2↓+2NaCl(2)CaCO3(3)C,D
【解析】(1) 步骤①为氢氧化钠与氯化镁反应,化学方程式为 MgCl2+2NaOH= Mg(OH)2↓+2NaCl ;
(2) 步骤②为氯化钙与碳酸钠的反应,得到的白色沉淀是 CaCO3 ;
(3)因所加碳酸钠和氢氧化钠均过量,所以 步骤③中加稀盐酸是为了除去溶液中的氢氧化钠和碳酸钠;
23.(2021九上·淳安期中)我们在做“物质的鉴别”实验时,曾对硫酸铜、氯化钠、硝酸钾、氢氧化钠四种白色粉末进行鉴别以下是某同学设计的鉴别方案,请你沿着该同学的思路回答相关问题。
①是 (填化学式)②是 。
【答案】 AgNO3;蓝
【解析】A试管发热,则A是氢氧化钠。D是硫酸铜,则试管中看到蓝色,则B、C应该是氯化钠和硝酸钾。分别加入硝酸银后,氯化钠和硝酸银反应,生成氯化银沉淀和硝酸钠,则C为氯化钠;硝酸钾和硝酸银不反应,没有明显现象,则B是硝酸钾。 ①是AgNO3;②是蓝色。
24.(2021九上·乐清月考)“绿水青山就是金山银山”。废旧干电池中有锌皮、铜帽(含金属Cu和Zn)、石墨、MnO2、NH4Cl等,若将生活中废旧干电池随意丢弃会造成水和土壤污染,因此将废旧干电池进行回收利用尤为重要。如图是回收废旧干电池成分的主要流程图(部分物质已略去)。
已知:2Cu+O2+2H2SO4=2CuSO4+2H2O.回答下列问题:
(1)从设备1中回收得到的非金属单质是 (填物质名称)。
(2)流程中B溶液的溶质有H2SO4、 。
(3)写出设备Ⅲ中发生反应的化学方程式 。
【答案】 (1)石墨(2)CuSO4 ZnSO4(3)Zn+H2SO4=ZnSO4+H2↑、 Zn+CuSO4=ZnSO4+Cu
【解析】(1)从设备I中得到的氯化铵、二氧化锰等都是由两种元素组成的,为化合物,只有石墨只由一种碳元素组成,为单质。
(2)在设备II中,锌和稀硫酸反应,生成硫酸锌和氢气;铜与氧气和硫酸反应,生成硫酸铜和水,则B溶液中溶质为产物CuSO4 , ZnSO4和剩余的H2SO4;
(3)在设备III中,锌和稀硫酸反应,生成硫酸锌和氢气,方程式为: Zn+H2SO4=ZnSO4+H2↑ ;
锌和硫酸铜反应,生成硫酸锌和铜单质,方程式为: Zn+CuSO4=ZnSO4+Cu 。
25.(2020九上·拱墅期中)某废液可能含有硫酸钠、碳酸钠、氢氧化钠、氯化钠中的一种或几种,小乐为了确定其成分设计并进行了如下实验。
(1)生成①中白色沉淀的化学方程式 。
(2)②中试剂A的名称 。
(3)为了达成确定废液成分的目的,写出对“无色溶液II”的后续实验操作 。
(4)样品中一定不存在的物质是 。
【答案】 (1)Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3
(2)无色酚酞试液(3)取少量无色溶液II于试管中,滴入适量的硝酸银溶液,观察是否有白色沉淀生成。(4)碳酸钠(或Na2CO3)。
【解析】(1)加入足量硝酸钡产生白色沉淀,且白色沉淀不溶于硝酸,说明为硫酸钡沉淀,即样品中含有硫酸钠,反应方程式为 Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3 ;
(2) 无色溶液中加入试剂A溶液变红,说明试剂A为酚酞试液;
(3)由无色溶液I中加酚酞变红,可证明含有氢氧化钠,还需证明是否含氯化钠,所以先加入足量稀硝酸,得到无色溶液 II ,再 取少量无色溶液II于试管中,滴入适量的硝酸银溶液,观察是否有白色沉淀生成 ,从而证明是否含有氯化钠;
(4)碳酸钠与硝酸钡反应会产生溶于硝酸的碳酸钡沉淀,所以样品中一定不含碳酸钠;
26.(2017九上·鄞州月考)为了将氯化钠和氯化钙的混合物分离,并测定其中氯化钠的质量分数,兴趣小组最初设计了如下方案并进行实验:
根据流程图回答:
(1)沉淀B化学式是________ , 试剂甲是________ , 滤液C中溶质成分有________。
(2)根据以上方案得到NaCl固体测定含有杂质,同学们通过分析后对上述方案作出改进:在步骤Ⅴ滤液C蒸发结晶之前,先滴加足量的________ , 既能除去所含杂质,又能有效防止新杂质的引入,上述反应的化学方程式为________。
(3)为测定原混合物中氯化钠的质量分数,同学们提出了如下两个数据测定方案。
方案1:称量混合物A的总质量和干燥的沉淀B或CaCl2固体的质量,并进行计算;
方案2:称量混合物A的总质量和实验改进后所得纯净氯化钠固体的质量,并进行计算。
请你判断:上述所选称量数据不合理的是________(填:“方案1”或“方案2”)。
理由是________。
【答案】 (1)CaCO3;盐酸;氯化钠和碳酸钠(2)盐酸;2HCl+Na2CO3=2NaCl+H2O+CO2↑
(3)方案二;盐酸与过量的碳酸钠反应也生成了氯化钠
【解析】(1)由混合溶液(NaCl、CaCl2)中加过量Na2CO3反应得到沉淀,发生的反应是CaCl2和过量Na2CO3反应,生成了NaCl和CaCO3 , 所以是CaCO3沉淀。试剂甲能与沉淀B反应,蒸发后只留下CaCl2可确定试剂甲是盐酸。滤液C是混合溶液(NaCl、CaCl2)与过量Na2CO3反应后的可溶液性物质所以有NaCl、过量的Na2CO3。(2)因为滤液C中含有NaCl、过量的Na2CO3所以有杂质,除去NaCl中含有的Na2CO3可使用盐酸,化学方程式为2HCl+Na2CO3=2NaCl+H2O+CO2↑。(3)比较方案1和方案2发现方案2在分离过程中引入的Na+最后也转化成了NaCl,氯化钠固体的质量是偏大的,所以不合理,方案1在分离过程中没有引入Ca2+离子,所以得到的CaCl2就是原来有的,利用CaCl2质量得到的NaCl也是正确的,方案1合理。所以不合理的是方案2,理由是:1、盐酸与过量的碳酸钠反应也生成了氯化钠;2、CaCl2与Na2CO3反应时也产生了NaCl。
三、物质的推断与识别
27.(2019·宁波模拟)一包混有杂质的Na2CO3 , 其杂质可能是Ba(NO3)2、KCl、NaHCO3 , 今取10.6克样品,溶于水得澄清溶液,另取10.6克样品,加入足量的盐酸,收集到4.4克CO2 , 则下列判断正确的是( )
A. 样品中只有NaHCO3 B. 样品中只混有NaHCO3 , 无KCl
C. 样品中有NaHCO3 , 也有Ba(NO3)2 D. 样品中混有KCl,也有NaHCO3
【答案】 D
【解析】(1) Na2CO3与 Ba(NO3)2 反应会生成BaCO3沉淀;因为溶于水后得到澄清溶液,因此说米碳酸钠中不含硝酸钡;
(2)由下面的化学方程式:
Na2CO3+2HCl=2NaCl+H2O+CO2↑;
NaHCO3+HCl=NaCl+H2O+CO2↑;
可知,1分子碳酸钠与1分子碳酸氢钠分别与稀盐酸反应,都生成1分子二氧化碳。
碳酸钠的相对分子质量为:23×2+12+16×3=106;
碳酸氢钠的相对分子质量为:23+1+12+16×3=84<106;
因为碳酸氢钠的相对分子质量比碳酸钠的小。
所以相同质量的碳酸钠与碳酸氢钠分别与足量的稀盐酸反应,碳酸氢钠比碳酸钠反应生成的二氧化碳多。
由此可知:如果混有KCl,那么产生的二氧化碳质量会减小;如果混有氢氧化钠,产生的二氧化碳质量会增大。
由于10.6g碳酸钠与足量的稀盐酸反应生成二氧化碳的质量为4.4g,等于10.6g含杂质的碳酸钠与足量的稀盐酸反应生成二氧化碳的质量。
说明所含杂质中既有氯化钾,也有碳酸氢钠。 故选:D。
28.(2021九上·义乌期中)一包不纯的Na2CO3固体,杂质可能是CaCl2、NaCl、NaHCO3中的一种或几种。现取该样品溶于水得到澄清溶液;另取样品10.6g,加入100g稀盐酸恰好完全反应,产生气体4g,则下列判断不正确的是( )
A. 加水得澄清溶液,样品中一定没有CaCl2 B. 样品中一定含有NaCl,可能含有NaHCO3
C. 样品中杂质可能只含有NaCl D. 所加的稀盐酸溶质质量分数大于7.3%
【答案】 D
【解析】A.由于碳酸钠和氯化钙能够生成白色的碳酸钙沉淀,而取该样品,溶于水得到澄清溶液,所以固体中一定不会含有氯化钙,故A正确不合题意;
B.由于杂质是碳酸氢钠也能生成二氧化碳,且碳酸氢钠的相对分子质量比碳酸钠小,所以同质量的碳酸氢钠比碳酸钠生成的二氧化碳要多,故杂质中不能全部是碳酸氢钠,一定含有氯化钠,故B正确不合题意;
C.由于杂质是碳酸氢钠也能生成二氧化碳,且碳酸氢钠的相对分子质量比碳酸钠小,所以同质量的碳酸氢钠比碳酸钠生成的二氧化碳要多,故杂质中不能全部是碳酸氢钠,故还一定含有氯化钠,且杂质可以全部是氯化钠,也可以是氯化钠和碳酸氢钠两者都有,故C正确不合题意;
D.假设该固体都是碳酸钠,则设生成的二氧化碳的质量是x,反应的氯化氢的质量是y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
10.6g y x
10610.6g=44x=73y ,
解得:x=4.4g,y=7.3g;
如果该固体全部是碳酸钠,此时盐酸的溶质质量分数7.3g100g×100%=7.3% , 而反应中的二氧化碳小于4.4g,所以消耗的氯化氢应该比此时要少,所以所加的稀盐酸溶质质量分数小于7.3%,故D错误符合题意。 故选D。
29.(2021九上·慈溪期中)某溶液中的溶质有NaOH、HCl、H2SO4和MgCl2中的一种或几种,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的关系如图14所示,下列说法正确的是( )
A. HCl和H2SO4一定存在 B. NaOH、H2SO4和MgCl2一定不存在
C. HCl和MgCl2一定存在 D. HCl一定存在NaOH、H2SO4一定不存在,MgCl2可能存在
【答案】 C
【解析】由图中可知,加入氢氧化钡溶液时,开始不产生沉淀,说明溶液中不含有硫酸,含有盐酸,故A错误;
溶液中含有盐酸时,一定不含有氢氧化钠,因为盐酸和氢氧化钠不能共存,故D错误;
当盐酸和氢氧化钡完全反应后,再加入氢氧化钡溶液时,产生沉淀,是因为氢氧化钡和氯化镁反应生成了氢氧化镁沉淀,因此溶液中含有氯化镁,故B错误、C正确。 故选C。
30.(2021九上·绍兴期中)有一包不纯的碳酸钾粉末,所含杂质可能是硝酸钾、硝酸钙、氯化钾、氯化亚铁、碳酸钠中的一种或几种。为确定其成分,进行如下实验:
①取少量该粉末于试管中,加足量的水充分溶解,得到无色澄清溶液。向该溶液中加入适量的硝酸银溶液,有白色沉淀产生,再加入足量的稀硝酸,充分反应后,部分白色沉淀消失。
②另取13.8g该粉末于烧杯中,加水使其完全溶解,再加入200g一定溶质质量分数的氯化钡溶液,恰好完全反应,生成19.7g白色沉淀。
下列说法正确的是( )
A. 杂质中可能含有氯化亚铁 B. 杂质中一定含有氯化钾,可能含有硝酸钾、碳酸钠
C. 该包粉末的组成只有两种情况 D. 所用氯化钡溶液中溶质的质量分数为20.8%
【答案】 C
【解析】①取少量该粉末于试管中,加足量的水充分溶解,得到无色澄清溶液,说明该溶液中一定不含溶液呈浅绿色的氯化亚铁和能与碳酸钾反应产生沉淀的硝酸钙,向该溶液中加入适量的硝酸银溶液,有白色沉淀产生,再加入足量的稀硝酸,充分反应后,部分白色沉淀消失,因碳酸钾与硝酸银反应可产生溶于硝酸的碳酸银沉淀,所以不能确定碳酸钠的存在,氯化钾与硝酸银反应可以产生不溶于硝酸的氯化银沉淀,则一定含有氯化钾。
②另取13.8g该粉末于烧杯中,加水使其完全溶解,再加入200g一定溶质质量分数的氯化钡溶液,恰好完全反应,生成19.7g白色沉淀,设产生19.7g碳酸钡需碳酸钾质量为x,所用氯化钡质量分数为y
K2CO3+BaCl2=BaCO3+2KCl Na2CO3+BaCl2=BaCO3+2NaCl
138 208 197 106 197
x 200gy 19.7g
138:197=x:19.7g 208:197=200gy:19.7g
x=13.8g,y=10.4%,而等质量碳酸钠比碳酸钾产生碳酸钡质量多,13.8g粉末与氯化钡反应产生沉淀为19.7克,说明一定不含碳酸钠。
A、 杂质中一定不含有氯化亚铁 ,不符合题意;
B、 杂质中一定含有氯化钾,一定不含碳酸钠,可能含有硝酸钾 ,不符合题意;
C、 该粉末可能是碳酸钾和氯化钾,可能是碳酸钾、氯化钾和硝酸钾,符合题意;
D、 所用氯化钡溶液中溶质的质量分数为10.4%,不符合题意; 故选C。
31.(2021九上·萧山月考)某固体混合物由K2CO3、K2SO4、CaCl2和KCl中的一种或几种组成,实验记录如下:
①取该样品溶于水,得到无色溶液;
②取适量上述溶液加过量的BaCl2溶液,出现白色沉淀,过滤;
③向步骤②所得沉淀中加入过量的稀HNO3 , 沉淀部分消失并产生气泡;
④取步骤②的溶液加入AgNO3溶液生成白色沉淀,再加入稀HNO3振荡,沉淀不消失。下列说法正确的是( )
A. 原固体混合物中一定不含有CaCl2 , KCl
B. 原固体混合物中一定含有K2CO3 , K2SO4 , KCl
C. 只通过步骤①②就可以确定原固体混合物中一定含有K2SO4
D. 若步骤②改为滴加过量的Ba(NO3)2溶液,其余操作及现象均不变,则原固体混合物中一定含有KCl
【答案】 D
【解析】①取该样品溶于水,得到无色溶液,说明碳酸钾、硫酸钾与氯化钙不能同时存在;
②取适量上述溶液加过量的BaCl2溶液,出现白色沉淀,说明含有碳酸钾或硫酸钾,故原固体中一定不含有氯化钙;
③向步骤②所得沉淀中加入过量的稀HNO3 , 沉淀部分消失并产生气泡,说明产生的沉淀一定有碳酸钡和硫酸钡,说明原固体中一定含有碳酸钾和硫酸钾;
④取步骤②的溶液加入AgNO3溶液生成白色沉淀,再加入稀HNO3 , 振荡,沉淀不消失,说明溶液中含有氯离子,但是步骤②中加入了氯化钡,引入了氯离子,不能确定是否含有氯化钾。
A.原固体中不能确认是否含有氯化钾,故A错误;
B.原固体混合物中一定含有K2CO3 , K2SO4 , 不一定含有KCl,故B错误;
C.通过实验①②不能说明一定含有硫酸钾,故C错误;
D.若步骤②改为滴加过量的Ba(NO3)2溶液,其余操作及现象均不变,则原固体混合物中一定含有KCl,故D正确。故选D。
32.(2022九上·慈溪竞赛)有一包白色固体可能含Na₂CO3、Na₂SO4、KCl、Ba(NO3)2、NaOH中的一种或几种。某科学兴趣小组为探究其成分做了以下实验:
I.取少量固体于烧杯中,逐渐加水并不断搅拌,烧杯内固体的质量随加入水的质量的变化如图甲所示:
Ⅱ.取少量B点时的清液于试管中,滴加酚酞溶液,酚酞溶液不变色;
III.继续向烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如图乙所示。
试回答下列问题:
(1)BC段可观察到的现象 。
(2)原白色固体中一定含有 。
(3)D点时溶液中一定含有的溶质是(填化学式) 。
【答案】 (1)沉淀部分溶解,有气泡产生(2)Na2CO3 Na2SO4、Ba(NO3)2(3)NaNO3、HNO3、Ba(NO3)2
【解析】(1)BC段可观察到的现象是白色沉淀部分溶解,有气泡冒出;
(2)原白色固体中一定含有Na2CO3、Na2SO4、Ba(NO3)2;
(3)碳酸钠、硫酸钠与硝酸钡反应生成碳酸钡、硫酸钡和硝酸钠、继续向烧杯中滴加稀硝酸,硝酸与碳酸钡反应生成硝酸钡、水和二氧化碳,D点溶液中一定含有的溶质为NaNO3、Ba(NO3)2 和过量HNO3。
33.(2021九上·舟山月考)现有一包不纯的K2CO3固体,可能含有Fe(NO3)3、CaCO3、KCl、BaCl2、Na2SO4、Na2CO3中的一种或几种。某科学小组做了如下实验:
( 1)取固体试样溶于足量水,得无色溶液A,则原固体一定不含 。
(2)向溶液A中加入足量Ba(NO3)2溶液,过滤得白色固体B和无色滤液C.加入Ba(NO3)2溶液时一定发生反应的化学方程式是 。
(3)向固体B中加入足量稀HNO3 , 固体完全溶解,取少量滤液C,先滴加过量稀HNO3 , 再滴加AgNO3溶液,出现白色沉淀,通过以上实验可知,原固体中仍无法确定的物质是 。
【答案】 (1)Fe(NO3)3、CaCO3、BaCl2(2)Ba(NO3)2+K2CO3=BaCO3↓+KNO3(3)Na2CO3
【解析】(1)取固体试样溶于足量水,得无色溶液A,则原固体一定不含 Fe(NO3)3、CaCO3、BaCl2 ;
(2)加入硝酸钡溶液后,与其中的碳酸钾反应,生成碳酸钡沉淀和硝酸钾,反应的方程式为: Ba(NO3)2+K2CO3=BaCO3↓+KNO3 。
(3)向固体B中加入足量稀HNO3 , 固体完全溶解,取少量滤液C,先滴加过量稀HNO3 , 再滴加AgNO3溶液,出现白色沉淀,通过以上实验可知,原固体中仍无法确定的物质是 Na2CO3 。
34.(2021九上·乐清期中)有一包白色固体可能含有碳酸钙、氢氧化钙、碳酸钠中的一种或几种。小明同学为探究其成分设计并完成了如下实验:
(1)操作1是 。
(2)步骤②的现象中出现了气泡,请判断原白色固体一定含有的成分是 。
【答案】 (1)过滤(2)Na2CO3
【解析】1)操作1是固体和液体的分离操作,属于过滤;
(2) 步骤②为向无色溶液中加入足量稀盐酸,现象中出现了气泡, 说明溶液中含有碳酸根离子,则原白色固体中一定含有碳酸钠。
35.(2021九上·温州期中)现有一包白色固体混合物,可能由硫酸铜、碳酸钙、碳酸钾、硫酸钠、氯化钡中的一种或几种混合而成,为确定其组成进行如图所示的实验。试推断:
(1)气体B是 。(填化学式,下同)
(2)混合物中一定没有的物质是 , 一定含有的物质是 。
【答案】 (1)CO2(2)CuSO4;BaCl2和Na2SO4
【解析】(1)白色沉淀A与盐酸反应产生无色气体B,则A中含有碳酸盐沉淀,B为二氧化碳;
(2)白色固体加水得无色滤液和沉淀A,则一定不含溶液呈蓝色的硫酸铜,A加盐酸,部分溶解,则含有碳酸盐沉淀和硫酸钡沉淀,由此可知固体中一定含硫酸钠和氯化钡,碳酸钙和碳酸钾中至少含一种。
36.(2021九上·义乌期中)某固体混合物中可能含有氢氧化钠、硝酸钠、氯化钠、硫酸钠、碳酸钠。为了研究该混合物的成分,某同学按下列流程进行了实验(各步均恰好完全反应):
根据流程图回答问题:
(1)反应④的化学方程式为 。
(2)根据实验现象推断该混合物中一定含有的物质是 ( 填化学式)。
(3)该同学为了进一步确定固体混合物的组成,取样品20.9g (其中含钠元素质量为6.9g),按上述流程图进行实验,产生11.65g白色沉淀A,产生2.2g气体W。通过计算,确定该混合物中还含有的物质是 (填化学式),其质量为 g。
【答案】 (1)AgNO3+NaCl=AgCl↓+NaNO3(2)Na2CO3 Na2SO4(3)NaNO3;8.5
【解析】固体混合物加入足量的水溶解,溶液中加入稀盐酸,生成的气体W能使澄清石灰水变浑浊,所以W是二氧化碳,样品中一定含有碳酸钠。溶液中加入硝酸和氯化钡,生成的白色沉淀,所以样品中一定含有硫酸钠。溶液中加入硝酸银会生成白色沉淀,加入的氯化钡会引入氯离子,所以样品中可能含有氯化钠。 (1)反应④是氯化钠和硝酸银反应生成氯化银沉淀和硝酸钠,化学方程式为:NaCl+AgNO3=AgCl↓+NaNO3;
(2)根据实验现象推断该混合物中一定含有的物质是:Na2SO4、Na2CO3;
(3)该同学为了进一步确定固体混合物的组成,取样品20.9g(其中含钠元素质量为6.9g),按上述流程图进行实验,产生11.65g白色沉淀A,产生2.2g气体W。
设碳酸钠的质量为x,硫酸钠的质量为y,
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 2.2g
10644=x2.2g;
解得:x=5.3g。
Na2SO4+BaCl2=BaSO4↓+2NaCl
142 233
y 11.65g
142233=y11.65g;
解得: y=7.1g。
硫酸钠中钠元素的质量:7.1g×4646+96=2.3g;
碳酸钠中钠元素的质量:5.3g×46106=2.3g;
则属于物质中钠元素的质量为:6.9g-2.3g-2.3g=2.3g;
则混合物中剩余的物质质量为:20.9g-5.3g-7.1g=8.5g;
设剩余物质的平均相对分子质量为:23÷。
由于氢氧化钠的相对分子质量为40,氯化钠的相对分子质量为58.5,氢氧化钠和氯化钠的相对分子质量都小于85,且硝酸钠的相对分子质量刚好为85,所以混合物中还含有的物质只可能且仅有硝酸钠。
通过计算,确定该混合物中还含有的物质是NaNO3。
37.(2021·金华模拟)某溶液中可能含有碳酸钠、硫酸钠、盐酸中的一种或几种,为测定其成分,同学们按小组合作形式进行了如下实验。
(1)小科同学马上看出该溶液中不可能同时含有上述3种溶质,作出这个判断的依据是________。
(2)各小组同学做了以下实验:
小组1:往溶液中滴加稀硝酸,直到气泡不再产生为止;再滴入几滴氯化钡溶液,出现白色浑浊物。
小组2:往溶液中滴入氯化钡溶液,直到白色浑浊物不再产生为止;后滴入几滴稀硝酸,发现有气泡产生。
两小组同学都得出该溶液中肯定有碳酸钠和硫酸钠。小军同学认为小组2的实验得不出这个结论,其理由是________。
(3)小红同学认为只要小组2在实验操作中增加稀硝酸的量,也能得出上述的结论,实验中当看到________现象时,便可确认该溶液中一定含有碳酸钠和硫酸钠。
【答案】 (1)碳酸钠与盐酸在溶液中不能共存(2)碳酸钡也是白色不溶物,不能确定是否含有硫酸钠
(3)白色浑浊物部分消失(或还有白色沉淀不溶解)
【解析】(1) 碳酸钠与盐酸在溶液中不能共存,所以不可能同时含有;
(2) 加入硝酸产生气泡,说明一定有碳酸钠,碳酸钠与氯化钡反应产生的碳酸钡也是白色不溶物,不能通过加入氯化钡产生沉淀确定是否含有硫酸钠;
(3)碳酸钠与氯化钡反应生成的碳酸钡能溶于硝酸,而硫酸钠与氯化钡反应产生的硫酸钡不能溶于硝酸,所以通过加入硝酸白色浑浊物部分消失 ,可证明溶液中一定含有碳酸钠和硫酸钠。
方法
适用范围或原理
举例
物理方法
过滤法
①固体与液体混合物的分离
粗盐提纯
结晶法
蒸发
①分离溶质与溶剂②除去易挥发的杂质
从含有的溶液中分离出固体。
降低温度
溶性固体溶质溶解度受温度影响变化大小不同
分离与的混合物
化学方法
化气法
与杂质反应生成气体而除去
除中可加适量
沉淀法
将杂质转化为沉淀过滤除去
除去中的,可加适量的。
置换法
将杂质通过置换反应而除去
除中的,可加过量铁粉,再过滤
溶解法
将杂质溶于某种试剂而除去
除碳粉中的粉,可加适量,再过滤
加热法
杂质受热易分解,通过加热将杂质除去
除中的可加热:
转化法
将杂质通过化学反应转化为主要成分
除中的,可将气体通入灼热的
实验目的
常用方法或选用试剂
从粗盐中提纯食盐
溶解,过滤,蒸发结晶
除去含有大量氯化钠的溶液中的少量硝酸钾
加热蒸发掉大部分溶剂使食盐结晶,少量的硝酸钾仍留在溶液中
除去大量的硝酸钾固体中含有的少量氯化钠
溶于水制成热饱和溶液后降温结晶出硝酸钾,氯化钠仍留在溶液
除去中混有的
通过碱溶液或炽热的碳层
除去中混有的
通过灼热的氧化铜等金属氧化物
除去盐酸盐中的碳酸根离子
化气法:用稀盐酸将其转变为气体
沉淀法:用氯化钙或氯化钡溶液
除去硫酸盐中碳酸根离子
用稀硫酸
除去盐酸及盐中的硫酸根离子
用氯化钡溶液将其转变沉淀
除去硝酸及盐中的硫酸根离子
用硝酸钡溶液将其沉淀
除去硝酸及盐中的氯离子
用硝酸银溶液将其沉淀
除去钠盐或钾盐中的镁离子
用氢氧化钠或氢氧化钾溶液将其沉淀
除去较活泼金属盐溶液中的较不活泼金属离子
用较活泼金属单质(除钾、钙、钠外)将其置换出来
除去氢后金属中含有的氢前金属单质
用稀盐酸或硫酸或用氢后金属的盐溶液将其溶解
离子
检验方法
实验现象
结论或化学方程式
滴加紫色石蕊溶液
石蕊溶液变红
紫色石蕊溶液遇酸变红
用pH试纸测量其pH
pH<7
加入少量锌粒
有气泡产生
滴加紫色石蕊溶液
石蕊溶液变蓝
紫色石蕊溶液遇碱变蓝
滴加无色酚酞溶液
无色酚酞溶液变红
无色酚酞溶液遇碱变红
用pH试纸测量其pH
pH>7
溶液
生成蓝色沉淀
溶液
生成红褐色沉淀
滴加盐酸,将产生的气体通入澄清石灰水。
有无色无味气体产生石灰水变浑浊。
滴入硝酸银溶液和稀硝酸
产生白色沉淀且不溶于稀硝酸
滴入稀盐酸酸化再滴入氯化钡
酸化无现象产生白色沉淀
滴入硝酸钡溶液和稀硝酸
产生白色沉淀
加入强碱溶液加热,用湿润的红色石蕊试纸检验产生的气体
有刺激性气味气体产生,试剂变蓝
溶于水显碱性
滴加强碱溶液(氢氧化钠)
产生红褐色沉淀
插入铁丝
表面覆有红色固体
滴入强碱溶液
产生蓝色沉淀
物质
鉴别方法
化学方程式
特征
将带火星的木条伸入集气瓶内木条复燃
无色无味,能支持燃烧
①将纯净的氢气点燃发出淡蓝色火焰②在火焰上方罩一干燥的冷烧杯内壁有水珠出现③再向该烧杯倒入少量澄清石灰水,石灰水不变浑浊。
无色无味可燃,燃烧产物只有水
①将燃着的木条伸入集气瓶内,木条熄灭②通入澄清石灰水中或向集气瓶中倒入澄清石灰水石灰水变浑浊
无色无刺激性气味,不支持燃烧是澄清石灰水变浑浊
碳酸盐溶液或固体
取少量溶液滴加稀盐酸产生气泡产生无色无刺激性气味气体
可溶性硫酸盐溶液
取少量溶液滴加氯化钡溶液,产生白色沉淀,加入足量稀硝酸,沉淀不溶解
可溶性氯化物溶液
取少量溶液滴加硝酸银溶液,产生白色沉淀,加入足量稀硝酸沉淀不溶解
特征颜色
初中常见的物质
红色固体
铜、红磷、氧化铁等
红褐色沉淀
氢氧化铁
蓝色固体或沉淀
胆矾、氢氧化铜
蓝色溶液
硫酸铜等可溶性铜盐溶液
黄色或淡黄色固体
硫
黄色液体
氯化铁等可溶性铁盐溶液
绿色固体
碱式碳酸铜
浅绿色溶液
硫酸亚铁等可溶性亚铁盐溶液
黑色固体
木碳粉、氧化铜、二氧化锰、四氧化三铁、铁粉
不溶于硝酸的白色沉淀
氯化银、硫酸钡
能溶于酸的白色沉淀
氢氧化镁等不溶性碱,碳酸钙等不溶性碳酸盐
特征反应
初中常见反应
通电发生的反应
电解水
产生大量白烟的燃烧
红磷燃烧
发出耀眼白光的燃烧
镁燃烧
产生明亮蓝紫色火焰,并生成刺激性气味气体的燃烧
硫在氧气中燃烧
火星四射的燃烧
铁在氧气中燃烧
生成蓝色沉淀的反应
可溶性碱+可溶性铜盐
生成红褐色沉淀的反应
可溶性碱+可溶性铁盐
溶液加酸放出二氧化碳气体
碳酸盐+酸
固体加酸放出气体
氢前金属或碳酸盐+酸
溶液
甲+乙
乙+丙
丙+丁
甲+丁
现象
无明显现象
白色沉淀
白色沉淀
无色气体
实验顺序
1
2
3
4
5
溶液编号
甲+乙
甲+丙
丙+丁
乙+丙
乙+丁
实验现象
有气体产生
有沉淀生成
有沉淀生成
无明显现象
加入的物质
NaOH溶液
稀盐酸
AgNO3溶液
实验现象
蓝色沉淀
无明显现象
白色沉淀
加入物质
NaOH 溶液
氯化钡
HCl 溶液
现象
产生蓝色沉淀
产生白色沉淀
无明显现象
实验操作
实验现象
取该固体于试管中,加水、振荡
固体不溶解
取该固体于试管中,加盐酸、振荡
固体溶解,无气泡产生
一氧化碳通过炽热的该固体, 称固体质量、检测尾气
固体质量减轻,尾气中只检测到
CO 与 CO2
选项
实验目的
实验方案或结论
A
除去CO2中混有少量HCl气体
通入装有足量NaOH溶液的洗气瓶
B
除去KCl固体中的K2CO3
取样、溶解、加入足量的稀硫酸,蒸发
C
鉴别碳粉、铁粉和氧化铜粉末
取样后,分别加入稀盐酸
D
鉴别某溶液中是否含有SO42-
取少量溶液于试管中,滴加BaCl2溶液,有白色沉淀生成,则该溶液中一定有SO42-
物质(括号内为杂质)
除杂方法
A
NaCl(泥沙)
溶解、过滤、蒸发
B
FeCl2溶液(CuCl2溶液)
加入过量铁粉、过滤
C
CaCl2溶液(盐酸)
加入过量CaCO3、过滤
D
CO2(CO)
通入澄清石灰水
第36讲 人的生命活动(二)-备考2024年中考科学一轮复习专题练习(浙江专用): 这是一份第36讲 人的生命活动(二)-备考2024年中考科学一轮复习专题练习(浙江专用),文件包含第36讲人的生命活动二原卷板docx、第36讲人的生命活动二解析版docx等2份试卷配套教学资源,其中试卷共46页, 欢迎下载使用。
第13讲 电能-备考2024年中考科学一轮复习专题练习(浙江专用): 这是一份第13讲 电能-备考2024年中考科学一轮复习专题练习(浙江专用),文件包含第13讲电能原卷版docx、第13讲电能解析版docx等2份试卷配套教学资源,其中试卷共49页, 欢迎下载使用。
第12讲 电与磁-备考2024年中考科学一轮复习专题练习(浙江专用): 这是一份第12讲 电与磁-备考2024年中考科学一轮复习专题练习(浙江专用),文件包含第12讲电与磁原卷版docx、第12讲电与磁解析版docx等2份试卷配套教学资源,其中试卷共60页, 欢迎下载使用。