





鲁科版 (2019)必修 第二册微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用优秀ppt课件
展开1.以海带提碘和海水提溴的生产实际,体会元素周期律、元素周期表在分析、解决实际问题中的应用价值。2.以海带提碘和海水提溴为例,形成物质分离、富集、提取的基本思路。3.以海带提碘为例了解萃取与分液,知道萃取与分液的原理,同时学会分液漏斗的使用方法。培养动手操作能力和学习兴趣,同时培养科学态度与社会责任的学科核心素养。
【知识铺垫】卤族元素化学性质的递变规律(F→I)(1)相似性。卤素原子最外层电子数都为 7 ,都能形成气态氢化物(通式为HX),最高价氧化物对应水化物的化学式为HXO4 (F除外),单质具有氧化性。(2)递变性。①单质氧化性逐渐减弱。②卤素离子还原性逐渐增强。③气态氢化物稳定性逐渐减弱。④单质与氢气反应的能力逐渐减弱。
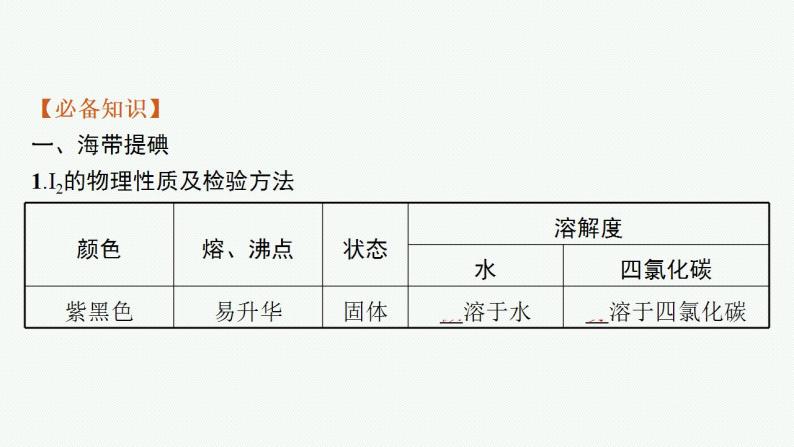
【必备知识】一、海带提碘1.I2的物理性质及检验方法
2.检验方法可以用淀粉溶液检验,淀粉遇碘单质变蓝色;也可以用四氯化碳溶液检验,碘单质溶于四氯化碳溶液,溶液呈紫红色。3.海带提碘的步骤从海带灰中提取碘单质包括浸取、过滤、氧化、萃取四个步骤。
4.萃取与分液(1)萃取原理。利用某溶质在两种互不相溶的溶剂里溶解能力的不同,用一种溶剂(萃取剂)将其从原溶剂中提取出来的方法叫作萃取。将萃取后两种互不相溶的液体分开的操作,叫作分液。
(2)实验步骤。加萃取剂(如图Ⅰ)—振荡萃取(如图Ⅱ)—静置分层(如图Ⅲ)—分液(如图Ⅳ):
二、海水提溴1.溴单质的物理性质常温常压下,溴是有挥发性的深红棕色液体,有刺激性气味;可溶于水,易溶于乙醇、四氯化碳等有机溶剂。2.从海水中提取溴(1)步骤:浓缩、氧化和提取。(2)反应原理:离子方程式为Cl2+2Br- === 2Cl-+Br2。(3)空气吹出法:利用Br2的挥发性,通入空气和水蒸气,就可将Br2吹出。
【微思考1】可否用酒精萃取溴水中的溴?提示 不能。酒精与水混溶。选择萃取剂需要遵循三个原则:①与原溶剂不互溶;②与原溶剂、原溶质不发生反应;③溶解溶质的能力有明显差异(远远大于原溶剂的溶解能力)。【微思考2】灼烧海带时用到哪些仪器?提示 坩埚、坩埚钳、三脚架、泥三角、酒精灯。
【问题探究】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
(1)步骤③的实验操作名称是什么?该过程中需要哪些玻璃仪器?提示 分离难溶性固体和溶液采用过滤方法,所以步骤③的实验操作名称是过滤。过滤时需要的玻璃仪器有烧杯、玻璃棒和漏斗。(2)步骤⑥的目的是从含碘苯溶液中分离出单质碘并回收苯,该步骤的实验操作名称是什么?提示 分离互溶且沸点不同的液体可采用蒸馏方法。碘易溶于苯,但碘和苯的熔、沸点不同,所以可以采用蒸馏的方法分离。
(3)步骤⑤中,为什么选择用苯从碘的水溶液中提取碘?提示 苯和水不互溶,碘在苯中的溶解度大于在水中的溶解度,且碘与苯不反应,所以苯可以作萃取剂从碘的水溶液中提取碘。(4)请设计一个简单实验,检验提取碘后的水溶液中是否还含有单质碘。提示 淀粉溶液遇碘变蓝色,所以可以用淀粉溶液检验是否含有碘。其检验方法是向溶液中滴加淀粉溶液,如果溶液变蓝色,则证明含有碘,否则不含碘。
【深化拓展】1.海带提碘
2.物质的分离与提纯(1)分离和提纯的原则。①“不增”——不能引入新的杂质;②“不减”——不能减少被提纯物质;③“易分”——杂质或反应后的杂质易与被提纯物质分离;④“易复原”——被提纯的物质要容易复原。(2)注意事项。①为除尽杂质,除杂试剂需过量。②加入试剂的原则:后面的试剂要把前面过量的试剂除尽。③沉淀完全的判断方法是在上层清液中(或取少量上层清液置于小试管中)滴加沉淀剂,如果不再产生沉淀,说明沉淀已经完全。
【素能应用】例1某同学取海带灰加蒸馏水煮沸2~3 min,冷却、过滤后获得含I-的溶液,并设计以下实验方案,从溶液中提取I2。
(1)反应1中硫酸的作用是提供酸性环境,则试剂a的作用是 。 (2)试剂b应选择 (填序号)。 A.CCl4 B.苯 C.酒精 D.醋酸(3)操作1的名称是 。实验室里进行操作1需要的玻璃仪器除烧杯外,还需要 。 (4)反应2的化学方程式为3I2+6NaOH === 5NaI+NaIO3+3H2O,此反应中的氧化剂是 ,氧化产物是 。 (5)反应3的离子方程式是 。
答案 (1)将I-氧化成I2(或作氧化剂)(2)A(3)萃取、分液 分液漏斗(4)I2 NaIO3(5)5I-+ +6H+ === 3I2+3H2O
解析 (1)反应1中硫酸的作用是提供酸性环境,试剂a用来氧化碘离子,则其作用是将I-氧化成I2(或作氧化剂)。(2)结合后续实验操作可知向含I2的有机溶液中加入氢氧化钠溶液发生反应生成碘化钠、碘酸钠。分液后碘单质最终在上层溶液中生成,则b为萃取剂且密度大于水,所以试剂b应选择四氯化碳。(3)操作1是萃取分液得到含碘单质的有机溶液,操作的名称是萃取、分液,实验室里进行操作1需要的玻璃仪器除烧杯外,还需要分液漏斗。(4)反应2的化学方程式为3I2+6NaOH === 5NaI+NaIO3+3H2O,此反应的氧化剂是I2,氧化产物是NaIO3。(5)反应3是碘离子与碘酸根离子在酸性溶液中发生归中反应生成碘单质,该反应的离子方程式为5I-+ +6H+ === 3I2+3H2O。
变式训练1(双选)为了从海带浸取液中提取碘,某同学设计了如下实验方案:下列说法正确的是( )A.①中反应的离子方程式:2I-+H2O2 === I2+2OH-B.②中分液时含I2的CCl4溶液从分液漏斗下口放出C.③操作使用的是反萃取法,得到的上层溶液中含有I-和D.操作Z的名称是加热
答案 BC解析 A项中加入稀硫酸,溶液为酸性,不能生成OH-,故A错误;四氯化碳的密度比水大,②中分液时含I2的CCl4溶液从分液漏斗下口放出,故B正确;I2和浓NaOH溶液反应生成NaI、NaIO3及水,NaI和NaIO3的水溶液的密度比四氯化碳小,③操作是反萃取法,得到的上层溶液中含有I-和 ,故C正确;从含I2的悬浊液中得到I2固体,应该采用过滤的方法,故D错误。
【问题探究】空气吹出法是目前海水提溴的主要方法之一。海水提溴的流程如图所示:
(1)步骤①中用硫酸酸化可提高Cl2的利用率,原因是什么?提示 步骤①中用硫酸酸化可提高Cl2的利用率,是因为在酸性溶液中Cl2、Br2与水的反应受到抑制。(2)步骤⑥的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因。提示 步骤⑥的蒸馏过程中,温度过高会产生大量水蒸气,使溴蒸气中水蒸气含量增加;温度过低溴又不能完全被蒸出。
(3)步骤⑦蒸气冷凝后得到液溴与水的混合物。步骤⑧可利用它们的相对密度相差较大的特点进行分离,所用的最关键的仪器是什么?提示 根据信息,步骤⑦得到液溴和水的混合物,且它们的相对密度相差较大,因此步骤⑧采用分液的方法进行分离,所用的最关键的仪器是分液漏斗。(4)步骤①②之后并未直接用含Br2的海水进行蒸馏得到液溴,而是经过步骤③④⑤之后再蒸馏,这样操作的原因是什么?提示 步骤③④⑤的过程实际上是Br2的浓缩富集过程,与直接蒸馏含Br2的海水相比,富集后再蒸馏含溴的溶液效率更高,消耗能量更少,成本降低。
【素能应用】例2目前海水提溴的主要方法是空气吹出法工艺,其流程图如下。以下推断不合理的是( )A.热空气能吹出溴是利用溴易挥发的性质B.SO2吸收溴的化学方程式为SO2+2H2O+Br2 === H2SO4+2HBrC.流程中只涉及溴元素被氧化的过程D.没有采用直接蒸馏含溴海水得到单质溴的主要原因是为了节能
答案 C解析 用热空气从含Br2的海水中将Br2吹出得到含Br2的空气,用二氧化硫吸收,得到吸收液,发生反应的化学方程式为SO2+2H2O+Br2 === H2SO4+2HBr,然后将吸收液氯化,发生反应的化学方程式为2HBr+Cl2 === Br2+2HCl,得到溴水混合物,然后采用蒸馏的方法得到液溴。溴易挥发,所以热空气能吹出溴是利用溴易挥发的性质,故A正确;二氧化硫具有还原性,溴具有强氧化性,二者能发生氧化还原反应,反应的化学方程式为SO2+2H2O+Br2 === H2SO4+2HBr,故B正确;流程中SO2吸收溴的过程是溴元素被还原的过程,故C错误;海水中溴的含量很低,如果直接采用蒸馏法从含溴海水得到溴单质会消耗更多能量,将海水中的溴还原的目的是富集溴,减少能源消耗,故D正确。
变式训练2从海水中提取的溴约占世界上溴年产量的 ,从海水中提取溴的主要步骤可表示为( )A.氧化→吸收→吹出B.氧化→吹出→吸收C.吹出→氧化→吸收D.吹出→吸收→氧化答案 B解析 从海水中提取溴时,先用氧化剂将溴离子氧化为溴单质,再通入空气和水蒸气吹出溴单质,然后用溶有二氧化硫的溶液吸收将溴蒸气转化成氢溴酸,最后用氯气将其氧化得到溴单质。所以主要步骤是氧化→吹出→吸收,B项正确。
1.海带中含碘元素,有人设计如下步骤来提取碘:①通足量氯气 ②将海带烧成灰,向海带灰中加水搅拌 ③加入CCl4振荡 ④过滤 ⑤用分液漏斗分液。合理的操作顺序是( )A.②—④—①—③—⑤B.②—①—③—④—⑤C.①—③—⑤—②—④D.③—①—②—⑤—④答案 A解析 根据海带提取碘的一般过程,先将海带烧成灰,然后向海带灰中加水并搅拌,再过滤,向滤液通入足量氯气进行氧化,然后加入CCl4振荡,最后用分液漏斗分液。即合理的操作顺序为②—④—①—③—⑤。
2.实验室从海带中提取碘的实验中包括以下步骤,其中仪器选用不合理的是( )
答案 B解析 A项称量药品质量可以使用托盘天平;B项灼烧海带需在坩埚中进行,而蒸发皿是用来蒸发液体的仪器;C项过滤需使用漏斗、玻璃棒和滤纸等;D项萃取过程是在分液漏斗中实现的。
3.下列说法不正确的是( )A.图Ⅰ振荡后静置,上层溶液颜色变浅或消失B.图Ⅱ所示装置为用酒精提取溴水中的溴C.可用CCl4提取溴水中的Br2D.检验Br-时,在溶液中先加入氯水再加入CCl4,振荡、静置,观察下层溶液是否显橙色
答案 B解析 Br2能与NaOH反应:Br2+2NaOH === NaBr+NaBrO+H2O,上层溶液颜色变浅或消失,A正确;酒精易溶于水,不能用酒精萃取溴水中的溴,B不正确;可以用CCl4萃取溴水中的溴,C正确;Cl2能与Br-发生反应:2Br-+Cl2 === Br2+2Cl-,CCl4密度比水大,Br2溶于CCl4,所以下层显橙红色,D正确。
4.(双选)下列叙述不正确的是( )A.仅用试管、胶头滴管、溴水、KI淀粉溶液可比较Br2与I2的氧化性的强弱B.利用烧杯、玻璃棒、胶头滴管、分液漏斗及溴水和CCl4能除去NaBr溶液中的少量NaClC.在KI淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应D.向FeI2溶液中通入少量Cl2,再滴加少量CCl4,振荡、静置,下层液体为紫色答案 BC解析 Br2能与KI发生反应:Br2+2KI === 2KBr+I2,淀粉溶液遇I2呈蓝色,可证明氧化性Br2强于I2,A正确;溴水与氯化钠不反应,B不正确;Cl2不能与淀粉发生显色反应,C项错误;将少量Cl2通入FeI2溶液中,Cl2与I-反应生成I2,I2溶于CCl4而显紫色,D正确。
5.海水是自然赐给人类的宝藏,海水的综合利用是全世界研究的重点。完成下列问题:(1)粗盐中除了含有泥沙之外还含有Ca2+、Mg2+、 等杂质,由粗盐获得精盐的一般步骤如下:加入的试剂①②分别是: 、 (写化学式)。
(2)某学生在实验室中模拟海水提取溴的步骤为:
取25 L除去悬浮杂质后的海水,浓缩至2 L,向其中通入足量氯气。①氧化步骤中生成Br2的离子方程式为 。 ②将吹出的Br2(g)用纯碱溶液全部吸收,发生反应3Br2+3Na2CO3 === 5NaBr+NaBrO3+3CO2↑,产生的CO2通入足量澄清石灰水中,得到1 g白色沉淀。计算海水中Br-的浓度为 g·L-1。 ③实验室中若用CCl4提取少量的溴,向溴水中加入CCl4振荡、静置……得溴的四氯化碳溶液,该分离提纯溴的方法叫 ;用到的玻璃仪器为 。 (3)实验证明金属制品在海水中更容易生锈,铜锈的化学式为 。
答案 (1)BaCl2 Na2CO3(2)①Cl2+2Br- === 2Cl-+Br2 ②0.064 ③萃取、分液 分液漏斗、烧杯(3)Cu2(OH)2CO3解析 (1)粗盐提纯实验中先加入氯化钡,后加纯碱,可分别生成硫酸钡、碳酸钙、碳酸钡等沉淀,以达到除去杂质离子的目的。(2)①氯气可氧化溴离子:Cl2+2Br-2Cl-+Br2;②根据各步反应,可确定如下关系:2Br-~Br2~CO2~CaCO3,根据CaCO3的质量可求出原25 L海水中Br-的质量为2×80 g·ml-1× =1.6 g,则海水中Br-的浓度为1.6 g÷25 L=0.064 g·L-1;③溴易溶于四氯化碳,溶液分层,该过程为萃取、分液操作,可用分液漏斗进行分离。(3)铜锈的主要成分为碱式碳酸铜,其化学式为Cu2(OH)2CO3。
高中化学鲁科版 (2019)必修 第二册微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用说课课件ppt: 这是一份高中化学鲁科版 (2019)必修 第二册微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用说课课件ppt,共40页。PPT课件主要包含了深红棕,易挥发,易升华,互不相溶等内容,欢迎下载使用。
海带提碘与海水提溴——体验元素性质递变规律的实际应用PPT课件免费下载2023: 鲁科版 (2019)高中化学必修 第二册课文《海带提碘与海水提溴——体验元素性质递变规律的实际应用》,完整版PPT课件免费下载,优秀PPT背景图搭配,精美的免费ppt模板。轻松备课,欢迎免费下载使用。
鲁科版 (2019)必修 第二册微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用备课课件ppt: 这是一份鲁科版 (2019)必修 第二册微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用备课课件ppt,共43页。PPT课件主要包含了知识铺垫,新知预习,任务一,任务二,随堂检测等内容,欢迎下载使用。













