



- 鲁科版高中化学选择性必修第一册第2章化学反应的方向限度与速率第2节化学反应的限度课时2反应条件对化学平衡的影响课件 课件 1 次下载
- 鲁科版高中化学选择性必修第一册第2章化学反应的方向限度与速率第3节化学反应的速率课时1化学反应是有历程的化学反应速率课件 课件 1 次下载
- 鲁科版高中化学选择性必修第一册第2章化学反应的方向限度与速率第4节化学反应条件的优化__工业合成氨课件 课件 1 次下载
- 鲁科版高中化学选择性必修第一册第2章化学反应的方向限度与速率微项目探讨如何利用工业废气中的二氧化碳合成甲醇__化学反应选择与反应条件优化课件 课件 1 次下载
- 鲁科版高中化学选择性必修第一册第2章化学反应的方向限度与速率微专题2速率与平衡图像问题课件 课件 1 次下载
高中化学鲁科版 (2019)选择性必修1第3节 化学反应的速率教课内容ppt课件
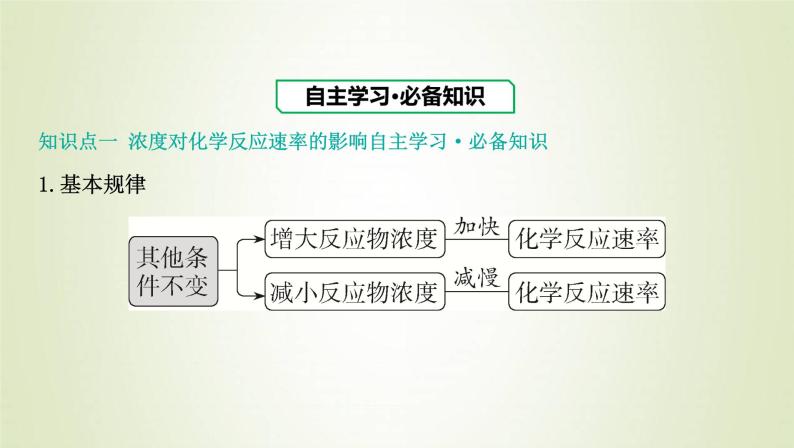
展开知识点一 浓度对化学反应速率的影响自主学习·必备知识
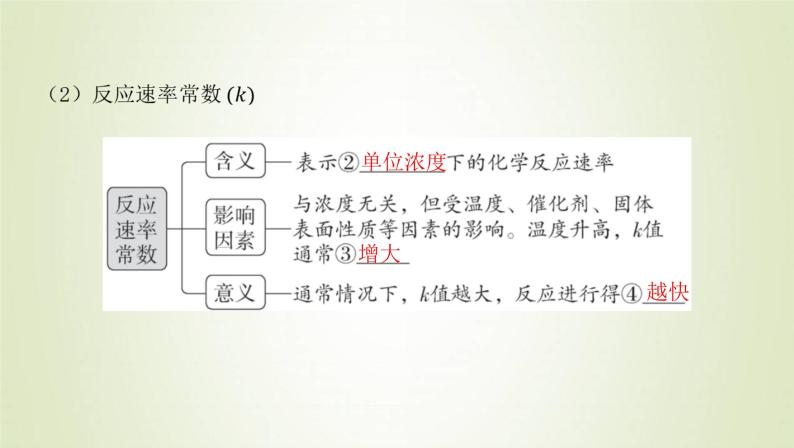
2.化学反应速率与反应物浓度的定量关系
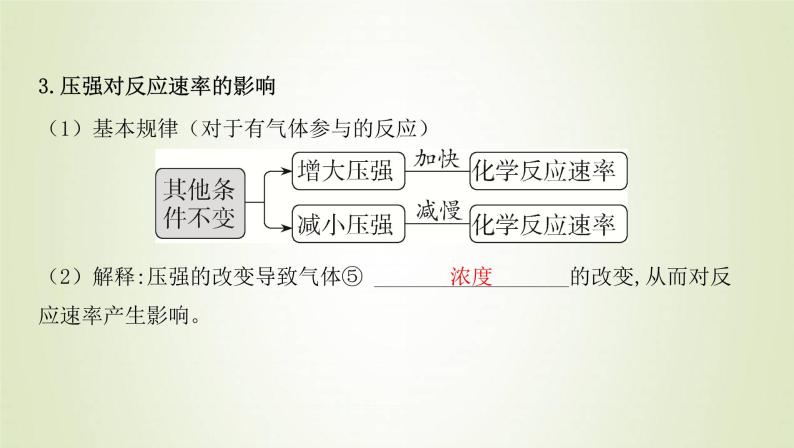
(1)基本规律(对于有气体参与的反应)
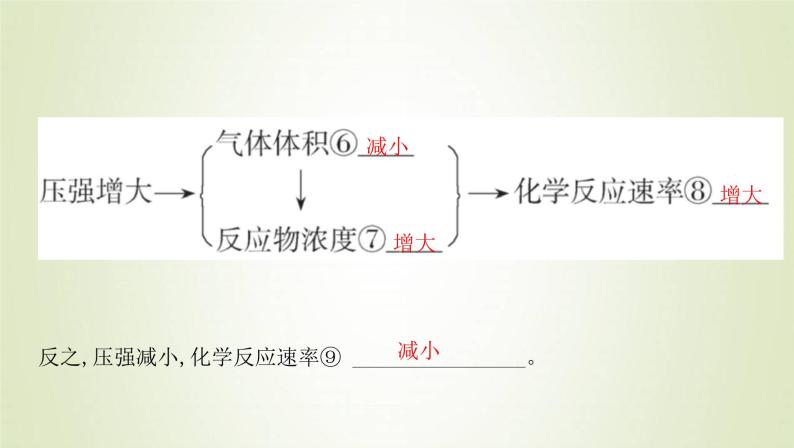
(2)解释:压强的改变导致气体⑤ __________________的改变,从而对反应速率产生影响。
3.压强对反应速率的影响
反之,压强减小,化学反应速率⑨ ________________。
想一想. 改变压强,化学反应速率一定会改变吗?
[答案] 不一定。对于没有气体参与的化学反应,由于改变压强物质的浓度变化很小,可忽略改变压强对化学反应速率的影响。
1. 决定化学反应速率的主要因素是反应物的性质( )
知识点二 温度对化学反应速率的影响
2.经验规律——范托夫规律
3.过渡态及活化能(1)过渡态:一种① ___________ _ 没有完全断裂、②__________ 没有完全形成的高能量的中间状态。(2)活化能
(1)升高温度可以提高反应物分子的能量,增大反应物之间的⑤ ____________________,增大反应物分子形成⑥ _________________的比例,故升高温度可以⑦ ________________ 化学反应的速率。(2)由于反应的⑧ __________________ 不同,所以温度对不同反应的反应速率的影响不同。活化能越高,反应越难发生。
[答案] 升高温度,正、逆反应速率均增大,但逆反应速率增大程度大于正反应速率,所以平衡向逆反应方向移动。
知识点三 催化剂对化学反应速率的影响
(1)概念:能改变化学反应速率而在反应前后本身的① __________________________ 不变的物质。(2)影响因素:催化剂的活性除了与② ____________________ 有关外,还受到③ __________________________ 等因素以及反应④ ______________________ 等条件的影响。(3)催化剂中毒:有些物质使催化剂明显⑤ ________________ 的现象。
2.催化原理:通过参与反应改变⑥ ____________________、改变反应的⑦ __________________ 来改变化学反应速率。3.催化剂的特点
想一想. 汽车尾气中的一氧化碳和一氧化氮在常温下就能反应,为什么还要在处理器中加上催化剂?
[答案] 加上催化剂主要作用是加快反应速率,加快有害气体的转化。
探究点一 外界条件对化学反应速率的影响
以下是投篮球的三种情况:第一种,能量不够;第二种,方向不合适;第三种,足够的能量和合适的方向。化学反应也有类似的情况,碰撞理论认为改变外界条件可使单位体积内的活化分子数改变,从而使化学反应速率改变。
问题1: 为什么增大反应物的浓度会影响化学反应速率?
提示 其他条件不变,当增大反应物的浓度时,单位体积中活化分子的数量增加,有效碰撞的频率增大,导致化学反应速率增大。
问题2: 增大压强一定能增大化学反应速率,减小压强一定能减小化学反应速率吗?为什么?如何理解“改变体系压强可改变化学反应速率”?
提示 其他条件不变时,增大压强不一定增大反应物的浓度,单位体积中活化分子的数量不一定增加,有效碰撞的频率不一定增大,反应速率不一定增大。其他条件不变时,减小压强不一定减小反应物的浓度,单位体积中活化分子的数量不一定减少,有效碰撞的频率不一定减小,反应速率不一定减小。所以,只有改变了压强,导致反应物浓度改变时,才能改变化学反应速率。
问题3: 为什么改变温度会影响化学反应速率?
提示 在其他条件不变时,升高温度,可以使反应物分子能量增大,一部分原来能量较低的普通分子变成活化分子,使活化分子百分数增大,有效碰撞次数增多,化学反应速率增大。
问题4: 催化剂改变化学反应速率时是否改变化学反应的焓变和化学平衡常数?
提示 催化剂通过改变化学反应的活化能改变化学反应的反应速率,但不能改变化学反应的焓变和化学平衡常数。
1.纯液体和固体的反应速率的影响因素分析 纯液体和固体的浓度视为常数,它们的量的改变不会影响化学反应速率,但固体颗粒的大小影响接触面积的大小,故影响反应速率。
3.温度对化学反应速率影响的分析升高温度,可以增加分子能量,增大活化分子百分数,且加快分子运动,增大分子的碰撞频率,因此升高温度可以加快化学反应的速率。反之,降低温度可以减小化学反应速率。
4.催化剂对化学反应速率影响的分析(1)催化剂能同等程度地改变正、逆反应速率,故能改变反应达到平衡的时间,但催化剂不能改变反应物的浓度和反应的平衡常数,所以催化剂不能使化学平衡发生移动,不能改变反应物的转化率。(2)理论解释:使用催化剂→降低反应所需的能量→更多的反应物分子成为活化分子→大大增加单位体积内的活化分子百分数→成千成万倍地增大化学反应速率。(3)催化剂只有在适宜的温度下活性才能达到最大,反应速率才能达到最大,故在许多工业生产中温度的选择还需考虑催化剂的活性温度范围。
解题感悟外界条件对化学反应速率影响的理论解释影响化学反应速率的外界条件主要有温度、浓度、压强和催化剂,它们的影响归纳如下:
[解析] 应标明物质的聚集状态,故A项错误;加入催化剂,降低活化能,但不改变反应热,故B项、C项错误。
探究点二 化学反应速率图像问题
1.可逆反应的速率—时间图像
(1)“一看”——看图像
①看面:弄清纵、横坐标的含义。②看线:弄清线的走向、变化趋势及线的陡与平。③看点:弄清曲线上点的含义,特别是一些特殊点,如与坐标轴的交点、曲线的交点、折点、最高点与最低点等。④看量的变化:弄清是浓度变化、温度变化还是转化率的变化。⑤看要不要作辅助线:如等温线、等压线等。
2.解图像题“三部曲”:“一看”“二想”“三判断”
(2)“二想”——想规律看完线后联想外界条件对化学反应速率和化学平衡的影响规律。(3)“三判断”通过对比分析,作出正确判断。
1. 下列说法正确的是( )A. 医药用品应该一直在高温下保存B. 向一堆篝火中“鼓风”,有利于它燃烧下去C. 压强越大反应速率越大D. 二氧化锰在过氧化氢的分解前后质量减少
[解析] 医药用品应该在低温、干燥的环境下密封保存,故A不正确;向篝火中鼓风,主要是增加了氧气的浓度,所以有利于它燃烧下去,故B正确;压强的变化只有引起浓度的变化才会对反应速率产生影响,故C不正确;二氧化锰在过氧化氢的分解中只是起催化剂的作用,反应前后质量不会发生变化,故D不正确。
4. 盐酸与碳酸钙反应时,下列措施能使最初的反应速率明显加快的是( )A. 增加碳酸钙的量B. 盐酸的用量增加一倍C. 盐酸用量减半,浓度加倍D. 增大体系压强
[解析] 增加固体的量不能改变化学反应速率,盐酸用量的多少与反应速率无关,盐酸浓度加倍能加快反应速率。
(1) 催化剂能加快化学反应速率的原因是_______________________。
[解析] 加入催化剂能使化学反应速率加快,其原因是催化剂降低了反应的活化能,使更多的普通分子变为活化分子,增大了活化分子的碰撞频率,使活化分子的有效碰撞增多。
探究浓度对反应速率的影响
向反应物中加入等量同种催化剂(或将盛有反应物的试管同时放入同一热水浴中)
(3) 实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。
分析上图能够得出什么实验结论?
易错提醒 解答有关速率大小的问题,不要被平衡移动的方向迷惑,要只看反应条件,条件越高,反应速率就越大。对于可逆反应,正反应速率和逆反应速率同时增大或同时减小,只是增大或减小的程度不一样。
(1) 该实验的目的是______________________________________________。
(4) 通过分析比较上述数据,得到的结论是___________________________________________________________________________________。
化学反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)
10. 某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。已知,反应后锌呈灰黑色,请回答下列问题:
(1) 上述实验中发生反应的化学方程式有_________________________________________________________。
(2) 硫酸铜溶液可以加快氢气生成速率的原因是_____________________________________________________________________________。
(4) 要加快上述实验中气体产生的速率,还可采取的措施有___________________________________________________________________(答两种)。
升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等(答两种)
[解析] 升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等均可以加快反应速率。
高中化学鲁科版 (2019)选择性必修1第1节 化学反应的方向评课课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1第1节 化学反应的方向评课课件ppt,共42页。PPT课件主要包含了目录索引,必备知识,自我检测等内容,欢迎下载使用。
化学选择性必修1第1节 化学反应的方向示范课ppt课件: 这是一份化学选择性必修1第1节 化学反应的方向示范课ppt课件,共48页。PPT课件主要包含了目录索引,必备知识,自我检测等内容,欢迎下载使用。
鲁科版 (2019)选择性必修1第1节 化学反应的方向作业ppt课件: 这是一份鲁科版 (2019)选择性必修1第1节 化学反应的方向作业ppt课件,共34页。













