




人教版 (五四制)八年级全册课题2 原子的构成教课ppt课件
展开原子还可以再分吗? 原子究竟是什么样子呢? 今天,咱们就来畅游原子的世界!
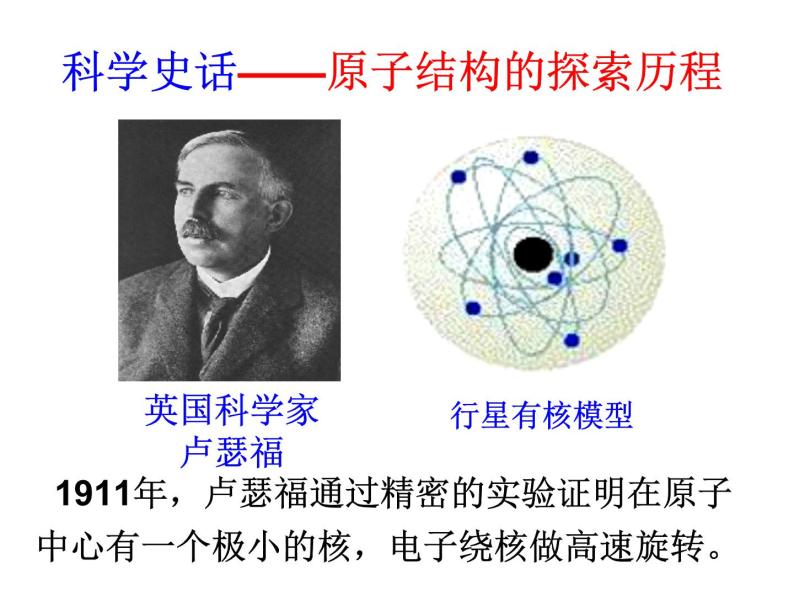
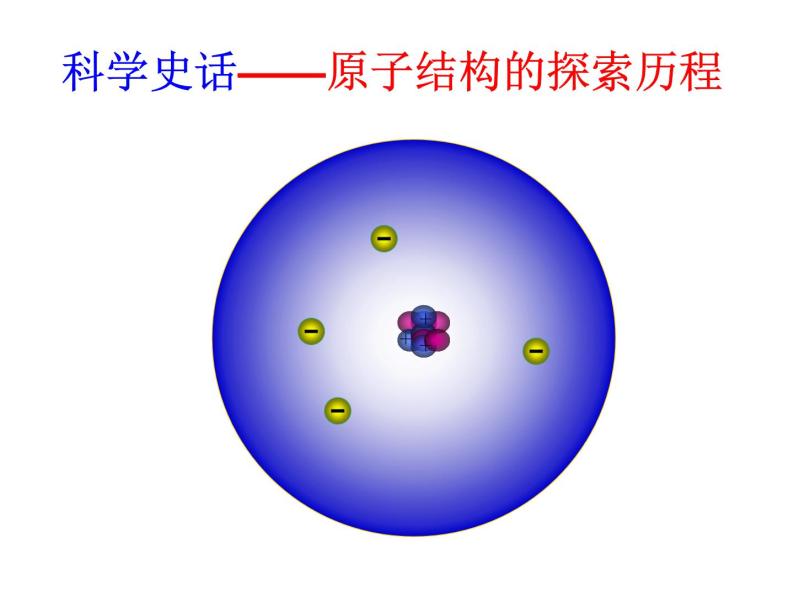
科学史话——原子结构的探索历程
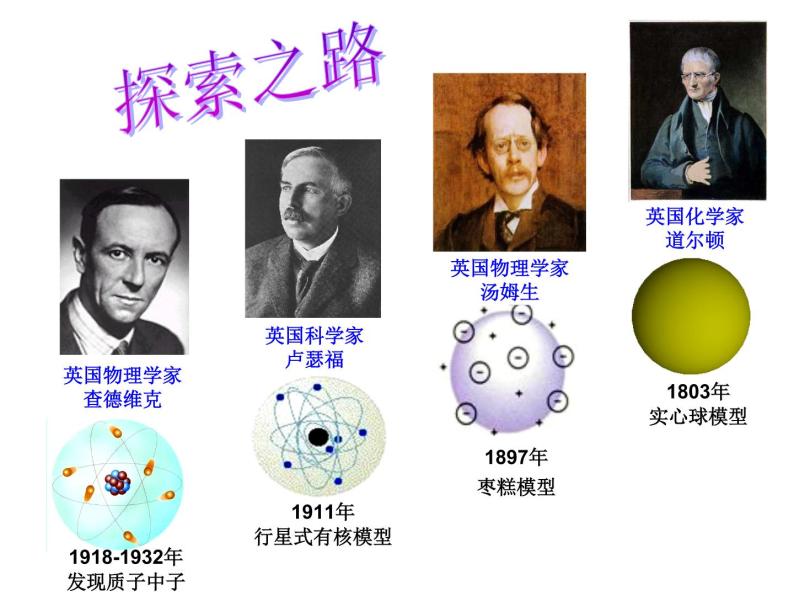
1803年,道尔顿提出:构成物质的最小粒子是原子,原子是不可再分的实心球体。
1897年,汤姆生在原子内部发现了电子,人们终于抛弃了原子不可分割的陈旧观念。
1911年,卢瑟福通过精密的实验证明在原子中心有一个极小的核,电子绕核做高速旋转。
金原子不为实心球体,中间有个核。
一、卢瑟福α粒子散射实验
极少数α粒子被反弹回来
大多数α粒子顺利穿透金箔
一小部分α粒子改变原来的方向
原子核外有较大的空间
原子核带正电、α粒子经过原子核附近受到了斥力
每个质子带一个单位的正电荷
每个电子带一个单位的负电荷
观察表3-1中不同原子中各微粒的数目,你能找出哪些规律?
原子中:核电荷数==质子数==核外电子数
不是所有的原子都有中子(氢原子没有中子)
不同原子,质子数不同。
质子数不一定等于中子数。
资料:原子的质量测定值
一个碳原子的质量是:0.00000000000000000000000001993千克即1.993×10-26千克一个氧原子的质量是: 0.00000000000000000000000002657千克即2.657×10-26千克一个铁原子的质量是:0.00000000000000000000000009288千克即9.288×10-26千克
原子的质量很小,书写、使用都很不方便,怎么办?
相对原子质量就是以一种碳原子质量的1/12(1.66×10-27Kg)为标准,其他原子的质量跟它相比较所得到的比值。
(1)相对原子质量的单位是: ___________ 。(2)原子实际质量的单位是: ___________ 。
我国科学院院士张青莲教授
我国科学院院士张青莲教授为相对原子质量的测定做出了卓越的贡献,他主持测定了铟 、铱 、锑、铈、铕、铒、锗、锌、镝几种元素的相对原子质量新值,被国际原子量委员会采用为相对原子质量数据标准。
查表填写相对原子质量的近似值
找规律:阅读上表,你能得到什么信息?
(数值上)相对原子质量≈质子数+中子数
2、氧原子的相对原子质量为( )A、16g B、16 C、2.657×10-26kg D、16kg3、最近,俄罗斯科学家宣布他们通过核反应合成了核电荷数为114、相对原子质量为289的超重元素原子,该原子内质子数为 ,中子数为 ,核外电子数为 。
4、已知碳12原子的质量为m千克某原子的相对原子质量为p,求该原子的实际质量?
在分子、原子、质子、中子、电子、原子核这些粒子中,选择合适的答案,填在空格上。(1)能保持物质化学性质的最小粒子有:(2)在化学变化中最小的粒子是:(3)不显电性的粒子有:(4)带正电的粒子有:(5)带负电的粒子有:(6)质量最小的粒子有:(7)构成原子的微粒有:(8)原子的质量主要集中在:
分子 原子 中子
原子核(质子 中子)、电子
电子在原子核外一定区域内出现,这些区域叫作叫做“电子层”,核外电子是在不同的电子层内运动的,此现象叫做核外电子的分层排布。
核外电子是怎样运动的?
核外电子的运动有自己的特点,没有固定的轨道,但却有经常出现的区域
四、原子核外电子的排布
1. 核外电子的分层排布
1 2 3 4 5 6 7
能量低的在离核近的区域运动,能量高的在离核远的区域运动。
钠原子的结构(11个电子)
2. 原子结构示意图:
某原子的原子结构示意图为 ,该原子的核电荷数为 ,核外有 个电子层,第二层上有 个电子,最外电子层上有 个电子。
第二层(6个)(最外层)
【亲手尝试】根据氧原子的结构图画出结构示意图
原子核外电子的排布有什么规律?
⑴第一层最多容纳___个电子,第二层最多容纳___个电子。
(2)最外层不超过 个电子,只有1层的不超过___个电子。
⑶电子先排满第___层,再排第___层,排满第___层,再排第___层。(按照能量由低到高的顺序分层排布)
3. 核外电子的排布规律:
最外层电子数等于8个(He为2个),这样的结构被认为是相对稳定结构,即化学性质不活泼。
1、金属原子与非金属原子最外层电子数的特点是什么?2、化学反应中,它们怎样才能达到相对稳定结构?3、归纳其化学性质主要取决于原子结构中哪一部分?
4、原子化学性质与核外电子排布的关系:
阳离子:带正电荷的原子(或原子团)
阴离子:带负电荷的原子(或原子团)
带电荷的原子(或原子团)叫做离子
Na+ Mg2+ NH4+(铵根离子)
Cl- S2- SO42- (硫酸根离子)
(1)书写:在元素符号的右上角标出离子所带的电荷数及正负。
② 电荷数为1时,1省略不写。
① 数字在前,正负号在后。
负电荷数=得到的电子数
正电荷数=失去的电子数
表示一个镁离子带2个单位的正电荷
练习:说出下列符号中数值“2”的含义。2H _____________________________ Ca2+ _____________________________2H+ _____________________________
表示一个钙离子带2个单位的正电荷
(3)数字的意义:
“前”:表示几个某离子
“右上角”:表示一个某离子带几个单位的正(负)电荷
原子中,质子数=电子数
阳离子中,质子数>电子数
阴离子中,质子数<电子数
钠原子与氯原子在化学变化中怎样达到相对稳定结构?
质子数= 电子数=
不带电的化合物NaCl
质子数 电子数
[模拟训练]点燃条件下,镁带可以在空气中燃烧生成氧化镁。这个反应在微观世界里是怎样发生的?
7、离子也是构成物质的一种粒子
用元素符号表示 Na,S
用离子符号表示 Na+
用离子符号表示 S2-
下列关于原子、离子的说法正确的是( )A、原子是不可分割的最小微粒,离子是带电的原子或原子团。B、原子都是不稳定结构,而离子都是稳定结构。C、分子、原子、离子都总在不断运动。D、原子和离子之间不可以相互转化。
人教版九年级上册课题2 原子的结构教学课件ppt: 这是一份人教版九年级上册课题2 原子的结构教学课件ppt,文件包含第2课时原子核外电子的排布离子的形成pptx、32-2氯化钠的形成swf等2份课件配套教学资源,其中PPT共19页, 欢迎下载使用。
初中化学人教版九年级上册课题1 分子和原子示范课课件ppt: 这是一份初中化学人教版九年级上册课题1 分子和原子示范课课件ppt,共15页。PPT课件主要包含了观察与思考,原子结构示意图,原子核,核电核数,电子层,该电子层上电子数,个He为2个,比较稳定,一般少于4个,一般多于4个等内容,欢迎下载使用。
初中化学人教版九年级上册课题2 原子的结构习题课件ppt: 这是一份初中化学人教版九年级上册课题2 原子的结构习题课件ppt,共23页。PPT课件主要包含了答案显示,见习题,阳离子,阴离子,带2个单位负电荷,不带电,带1个单位正电荷,离子所带电荷数,Ca2+,S2-等内容,欢迎下载使用。













