






化学九年级下册第二节 溶液组成的定量表示说课ppt课件
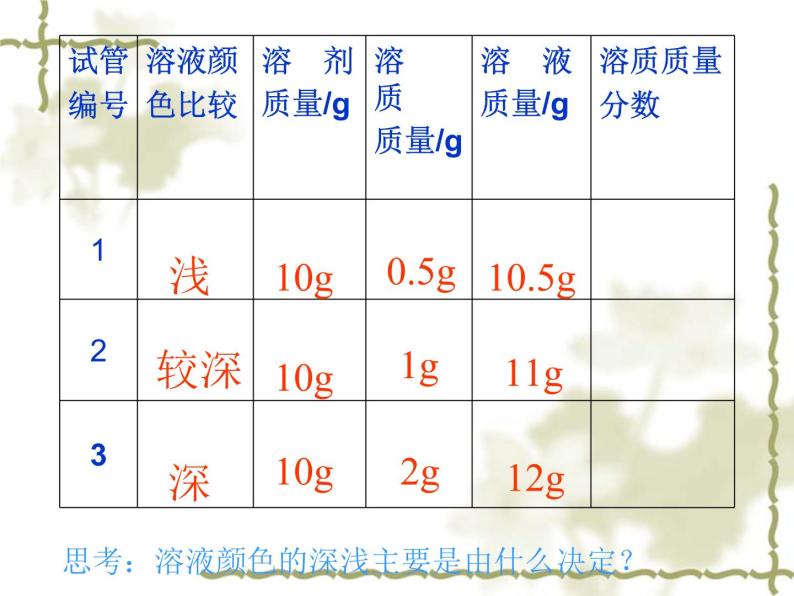
展开溶液组成的定量表示学习目标: 1.掌握一种溶液组成的表示方法——溶质的质量分数,能进行溶质质量分数的简单计算。 2. 掌握溶液的稀释原理,能进行简单的计算。 3.初步学会配制一定溶质质量分数的溶液。 教学重点: 溶液的溶质质量分数的概念和简单的计算, 溶液的稀释原理以及配制一定溶质质量分数的溶液。教学难点: 溶液的质量分数的概念的引入。温故而知新1. 什么叫 溶液? 是指 一种或几种物质分散到另一种物质里,形成均一、稳定的混合物叫溶液2. 溶液的组成3. 溶液质量= 溶质质量 +溶剂质量 在实际应用中,常要求准确知道一定量的溶液里含有溶质的质量。如在施用农药时,过浓会毒害农作物,过稀则不能有效地杀虫灭菌。因此,我们需要知道溶液的浓稀程度,也就是溶液的组成。在三支试管中各加入10mL水,然后分别加入约0.5g、1g、2g固体硫酸铜。比较三种溶液的颜色。在这三支试管中溶液的组成是否相同?判断溶液浓稀的根据是什么?实验9-5实验9-5颜色:想一想:这三支试管中溶液的组成是否相同? 判断溶液浓稀的根据是什么? 浅蓝蓝色深蓝 浅10g0.5g10g10.5g1g11g较深深10g 2g12g思考:溶液颜色的深浅主要是由什么决定?从硫酸铜溶液的颜色我们可以判别除这3个试管中,溶液的浓稀程度是不一样的,即溶液的组成不同。颜色越深,说明这个溶液越浓。但是如果这个溶液是无色透明的,我们要怎样辨别一种溶液的浓稀程度呢?或者说需要知道确切的某一溶液中含有多少溶质的质量的时候,要怎么办? 接下来我们就来了解表示溶液组成的一种方法:溶质的质量分数。 回顾: 在第八单元中 纯度的概念 某物质在混合物中的纯度是指纯净物质量与混合物质量之比。(纯度又叫质量分数)公式: 纯度=纯净物质量/混合物质量 一、溶质的质量分数1、概念: 2 计算公式:溶质质量与溶液质量之比。溶质质量分数、溶质质量、溶液质量之间的转换关系即(转换公式)溶质质量=溶液质量×溶质质量分数溶液质量=溶质质量/溶质质量分数溶液质量=溶质质量 +溶剂质量在三支试管中各加入10mL水,然后分别加入约0.5g、1g、1.5g固体硫酸铜。比较三种溶液的颜色。浅较深深10g10g10g0.5g1g2g10.5g11g12g4.8%9.1%16.7%[实验9-6]10g20g90g80g10%20% 例1在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150Kg这种溶液,需要氯化钠和水的质量各是多少?解:有没有其他的方法 想一想:有关溶质质量分数的计算所涉的量都是溶质或溶液的质量。若告诉你的是溶液的体积,还需考虑到哪个物理量?若已知的是溶液的体积,则需考虑到溶液的密度。必须将体积转化为质量 其转化公式:m =ρv 练习 配制500mL质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),需要氢氧化钠和水各多少克?氢氧化钠溶液质量=500ml×1.1g/cm3 =550gm(NaOH)=550g×10%=55gm(H2O)=550g-55g=495g 答:略解:讨论: 在温度不变的条件下,如何使原有溶液的溶质质量分数减小? 稀释原理: 溶液稀释前后,溶质的质量不变 公式:m浓×c浓%= m稀×c稀%一般通过加水稀释二、稀释问题: 例2 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?分析:解决这道题的关键是什么?解:溶液稀释前后溶质的质量不变如果把50g换成50mL,还需要什么条件?若设水的质量为x该如何列方式?设稀释后溶液的质量为x。50g× 98%=X × 20% X=245g 需要水的质量=245g-50g=195g答:需要水的质量为195g。 练习 把100g质量分数为98﹪的硫酸稀释成10﹪的稀硫酸,需加水的质量为多少?解:设加水的质量为x 100g×98%=(100g+x) ×10% x=880g 答:略计算公式:在溶液中溶质的质量分数就是溶质质量与溶液质量之比,可根据这个关系进行简单的计算。 溶液的稀释,稀释原理: :溶液稀释前后,溶质的质量不变小结:公式:m浓×c浓%= m稀×c稀% 同学们下去后,请思考:(1). 溶液的浓稀 和 溶液的饱和与否的关系。(2).化学方程式与溶质质量分数相结合的简单计算的注意要点。本课题的内容还需一个课时,本节课到此结束。溶 液 的 配 置配置步骤:1、计算 2、称量 3、溶解例1: (溶质为固体)配制150g16%的食盐水 计算:需食盐:150 g× 16% = 24 g 需水: 150 g– 24 g= 126 g称量:用天平称量 24 g食盐 用量筒量取126mL水溶解:烧杯、玻璃棒 实验仪器:天平(砝码)、药匙、量筒、 胶头滴管、烧杯、玻璃棒练习:下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。浓溶液和稀溶液判断依据:一定量溶液里,所含溶质的多少思考:溶液的浓稀 和 溶液的饱和与否的关系区分依据不同☆同一温度时,同一溶质的饱和溶液肯定比不饱和溶液浓 饱和溶液的溶质质量分数= 溶解度100g+溶解度 溶质的质量分数36% 是指: 100g溶液中含有36g溶质。 溶质T0C时溶解度36g是指: 在T0C 时,100g水最多溶解该溶质36g。溶质质量分数与溶解度的比较更多资源xiti123.taobao.com 例1、已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。 解:20℃时食盐饱和溶液的溶质质量分数为=26.5%36g100g+36g答:略 2、200C时,NaCl的溶解度是36克。现有50克水放入20克NaCl,求:所得溶液的溶质质量分数 分析:溶解度即为“溶解的限度”,50克水若溶不下20克NaCl,则溶液中NaCl的质量分数即为饱和溶液的质量分数36 /(100+36)。解:x = 18g < 20g则:溶质在溶液中的质量分数为:×100% ≈ 26.5% 100g36g=50gx18g50g+18g或36g100g+36g 2、某硫酸溶液100g,与13g锌完全反应,(1)这种硫酸的溶质质量分数是多少?(2)求反应后溶质的质量分数。溶质质量分数在化学方程式中应用1、 50g盐酸与锌完全反应,得到0.2g氢气,求盐酸溶质的质量分数1. 在溶液中进行的反应,实际反应的是溶质!带入计算的量应为溶质的质量!求反应后所得溶液的溶质质量分数时,计算反应后的溶液质量时,一般根据质量守恒定律进行计算比较简单。应注意的是:当生成物中有气体或沉淀生成时,气体或沉淀的质量不可算在溶液中,应减去!化学方程式与溶质质量分数相结合的简单计算注意要点:本课题小结: 溶质的质量分数1、概念:溶质质量与溶液质量之比。2、计算公式:t℃时,某物质的溶解度为Sg,则t℃,该物质饱和溶液中3、配制溶质质量分数一定的溶液实验步骤:实验仪器:⑴计算 ⑵称量 ⑶溶解 ⑷装瓶贴标签药匙 天平 烧杯 量筒 滴管 玻璃棒
化学第二节 溶液组成的定量表示课堂教学免费课件ppt: 这是一份化学第二节 溶液组成的定量表示课堂教学免费课件ppt,共28页。
北京课改版九年级下册第二节 溶液组成的定量表示图片课件ppt: 这是一份北京课改版九年级下册第二节 溶液组成的定量表示图片课件ppt,共20页。PPT课件主要包含了实验9-7,新知探究,实验9-8,溶质质量溶剂质量等内容,欢迎下载使用。
化学九年级下册第二节 溶液组成的定量表示教课内容ppt课件: 这是一份化学九年级下册第二节 溶液组成的定量表示教课内容ppt课件,共23页。PPT课件主要包含了确定所需营养物质,确定营养液浓度,确定配制方法,营养液标签及配方表,溶质质量溶剂体积,溶质质量溶液质量,μgg,展示标签及配方表,溶液组成的定量表示,溶质体积溶液体积等内容,欢迎下载使用。













