

讲义第六讲:化学方程式学案
展开定义:用化学式来表示化学反应的式子
化学方程式的书写原则:
一是以客观事实为依据;二是要遵守质量守恒定律
书写化学方程式的方法和步骤。
化学方程式表示的意义
①表示反应物和生成物的种类 ②表示反应的条件
③表示反应物、生成物间原子、分子个数比
④表示反应物、生成物间的质量比
根据化学方程式的计算
(1)、根据化学方程式计算的依据:化学方程式能表示反应物、生成物各物质间的质量比。
(2)计算步骤。
设未知量写出化学方程式 写出有关物质的相对分子质量和已知量
列出方程求解 写出简明答案
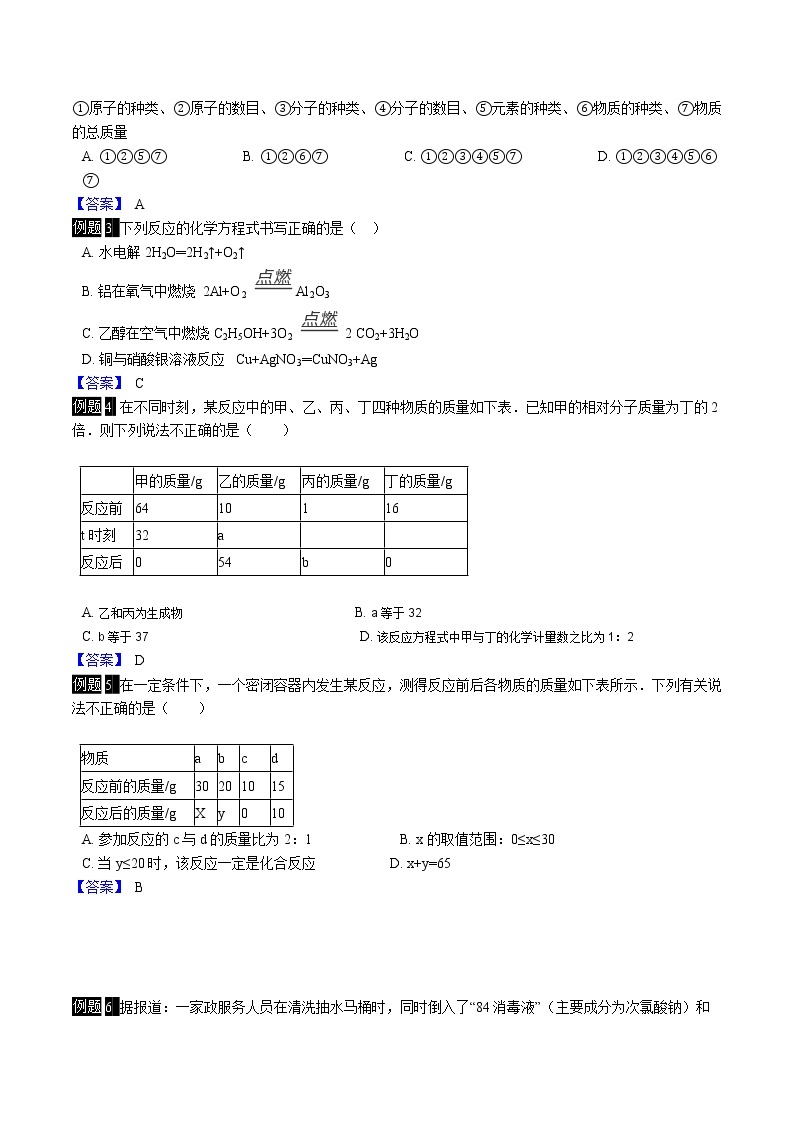
例题1 下列叙述、对应的化学方程式、所属基本反应类型都正确的是( )
A. 用磁铁矿炼铁的反应:Fe2O3+3CO 3CO2+2Fe 置换反应
B. 实验室用高锰酸钾制氧气:2KMnO4 K2MnO2+MnO2+O2↑ 分解反应
C. 拉瓦锡测定空气中氧气的含量:4P+5O2 2P2O5 化合反应
D. 探究铜和银的活动性:Cu+2AgNO3═2Ag+Cu(NO3)2 置换反应
【答案】 D
例题2 化学反应前后,肯定没有变化的是( )
①原子的种类、②原子的数目、③分子的种类、④分子的数目、⑤元素的种类、⑥物质的种类、⑦物质的总质量
A. ①②⑤⑦ B. ①②⑥⑦ C. ①②③④⑤⑦ D. ①②③④⑤⑥⑦
【答案】 A
例题3 下列反应的化学方程式书写正确的是( )
A. 水电解2H2O═2H2↑+O2↑
B. 铝在氧气中燃烧 2Al+O2 Al2O3
C. 乙醇在空气中燃烧C2H5OH+3O2 2 CO2+3H2O
D. 铜与硝酸银溶液反应 Cu+AgNO3═CuNO3+Ag
【答案】 C
例题4 在不同时刻,某反应中的甲、乙、丙、丁四种物质的质量如下表.已知甲的相对分子质量为丁的2倍.则下列说法不正确的是( )
A. 乙和丙为生成物 B. a等于32
C. b等于37 D. 该反应方程式中甲与丁的化学计量数之比为1:2
【答案】 D
例题5 在一定条件下,一个密闭容器内发生某反应,测得反应前后各物质的质量如下表所示.下列有关说法不正确的是( )
A. 参加反应的c与d的质量比为2:1 B. x的取值范围:0≤x≤30
C. 当y≤20时,该反应一定是化合反应 D. x+y=65
【答案】 B
例题6 据报道:一家政服务人员在清洗抽水马桶时,同时倒入了“84消毒液”(主要成分为次氯酸钠)和洁厕剂(主要成分为稀盐酸),结果被两者反应产生的有毒气体熏倒在地。
(1)“84消毒液”的主要成分是次氯酸钠(NaClO),其中Cl的化合价为________;
(2)“84消毒液”中的次氯酸钠与洁厕剂混合后,会生成氯化钠、水及有毒的氯气,请写出此反应的化学方程式________。
【答案】 (1)+1价
(2)NaClO+2HCl=NaCl+H2O+Cl2↑
例题7甲酸(HCOOH)通常是一种无色易挥发的液体,它在浓硫酸作用下易分解,化学反应方程式为:HCOOH浓硫酸CO↑+H2O ,某课外活动小组的同学欲用该反应来制取CO,并还原红棕色的氧化铁粉末。现有下列仪器或装置供选择:
(1)用甲酸滴入浓硫酸的方法制取CO,应选________(填序号)装置;
(2)在对氧化铁粉末加热前,为安全起见,应进行的一项重要操作是________。
(3)从开始加热到实验结束,氧化铁粉末的颜色变化及反应方程式分别为________。
(4)上述实验的尾气不能直接排放到空气中,请你说出一种处理尾气的方法:________。
(5)在该制取CO的反应中,浓硫酸所起的是________作用。
【答案】 (1)②
(2)加热前先通一氧化碳排尽空气
(3)红变黑;Fe2O3+3CO 2Fe+3CO2
(4)点燃尾气
(5)催化
【考点】常用气体的发生装置和收集装置与选取方法
变式训练 复印机用的墨粉中常添加磁性氧化铁(Fe3O4)粉末。Fe3O4是由Fe2+、Fe3+和O2-按1:2:4的个数比构成的。下图是生产复印用Fe3O4粉末的流程简图。已知第④步反应中各元素化合价保持不变。
(1)操作Y所需要的仪器和用品:铁架台、玻璃仪器、试剂、________(填一种实验用品名称)。
(2)反应③涉及到的化学反应基本类型是________。
(3)请书写反应④的化学方程式:________。
【答案】 (1)滤纸
(2)化合反应
(3)Fe(OH)2+2Fe(OH)3 Fe3O4+4H2O
例题8 如图所示中的几种物质是常见的盐,请回答下列问题。
(1)碳酸钙、碳酸钠均能与稀盐酸反应生成CO2 , 是因为碳酸钙、碳酸钠中均含有________(写离子符号)。
(2)硫酸铜溶液与氢氧化钠溶液能发生反应,该反应的化学方程式为________。
【答案】 (1)CO32-
(2)CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
浙江新中考本市有一家化工厂处理含铜垃圾的生产流程如下:
为了分析滤液A的成分,取100g滤液A,逐滴加入4%的氢氧化钠溶液直至过量,根据实验事实绘制了如图所示曲线。请分析并计算:
(1)写出处理含铜垃圾的生产流程中黑色固体物质与稀硫酸反应的化学方程式:________
(2)b→c段反应的现象为________
(3)滤液A中硫酸铜的质量分数为________
(4)c→d段溶液中的溶质有________(填化学式)
【答案】 (1)H2SO4+CuO=CuSO4+H2O
(2)有蓝色絮状沉淀生成
(3)3.2%
(4)NaOH、Na2SO4
例题9 某实验需要200g 8%硫酸铜溶液.
(1)硫酸铜溶液中存在的微观粒子有________
(2)从200g 8%硫酸铜溶液中取20g溶液,此溶液中溶质的质量分数是________.
(3)实验室用硫酸铜晶体(化学式为:CuSO4•5H2O)配制200g 8%的硫酸铜溶液,需称取硫酸铜晶体________ g.
(4)若取20g该硫酸铜溶液与足量氯化钡溶液反应,能生成白色沉淀________ g.
【答案】 (1)Cu2+ 、SO42﹣、H2O
(2)8%
(3)25
(4)2.33
例题10 在制取CO2的实验中,小科发现质量相同而粗细不同的大理石与盐酸反应,CO2的产生速度细的比粗的快得多。经思考后,小科设计了如下实验(每次实验均用1g大理石,20mL盐酸)
(1)为了比较反应速度,设计如图一所示装置,其中量筒的作用是________;
(2)两次实验中产生CO2体积随时间的变化关系如图二所示,请结合所学的知识对两次实验的曲线作出合理的解释。________.
(3)已知20℃该气压下C02气体密度约1.98 g/L,求大理石中CaCO3的质量。
【答案】 (1)测二氧化碳的体积
(2)较细的大理石由于其接触面积较大,反应的速度也较快,所以完全反应所需的时间较短;由于两者碳酸钙的质量相同,产生的CO2体积也相同
(3)设碳酸钙质量为x
x=0.9g
甲的质量/g
乙的质量/g
丙的质量/g
丁的质量/g
反应前
64
10
1
16
t时刻
32
a
反应后
0
54
b
0
物质
a
b
c
d
反应前的质量/g
30
20
10
15
反应后的质量/g
X
y
0
10
实验序号
温度(℃)
大理石颗粒
盐酸质量分数(%)
实验目的
1
20
粗
5
探究大理石和盐酸的反应速度与石灰石颗粒大小的关系
2
20
细
5
CaCO3+2HCl=CaCl2+H2O+
CO2↑
100
44
x
0.2×1.98g/L
初中科学浙教版八年级下册第3节 化学方程式学案: 这是一份初中科学浙教版八年级下册第3节 化学方程式学案,文件包含33化学方程式原卷版docx、33化学方程式解析版docx等2份学案配套教学资源,其中学案共32页, 欢迎下载使用。
讲义第九讲:常见的碱docx学案: 这是一份讲义第九讲:常见的碱docx学案,共10页。学案主要包含了碱的通性等内容,欢迎下载使用。
第六讲:物质的物理特性学案: 这是一份第六讲:物质的物理特性学案,共10页。学案主要包含了质量和质量的测量工具,温度的测量等内容,欢迎下载使用。












