




高中化学第一章物质及其变化本章整合课件新人教版必修1
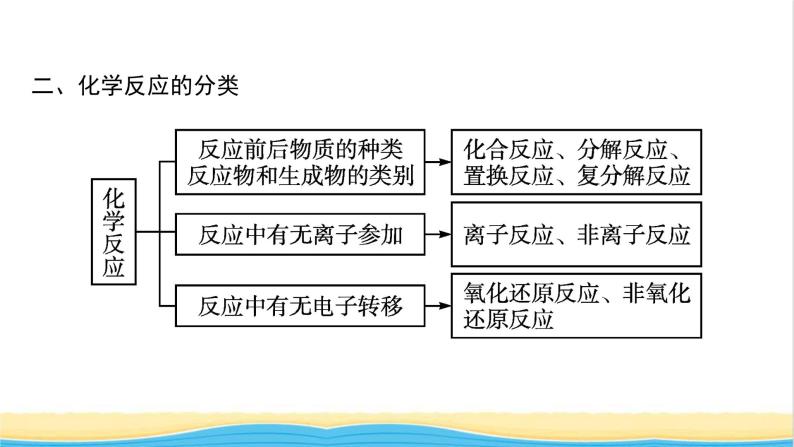
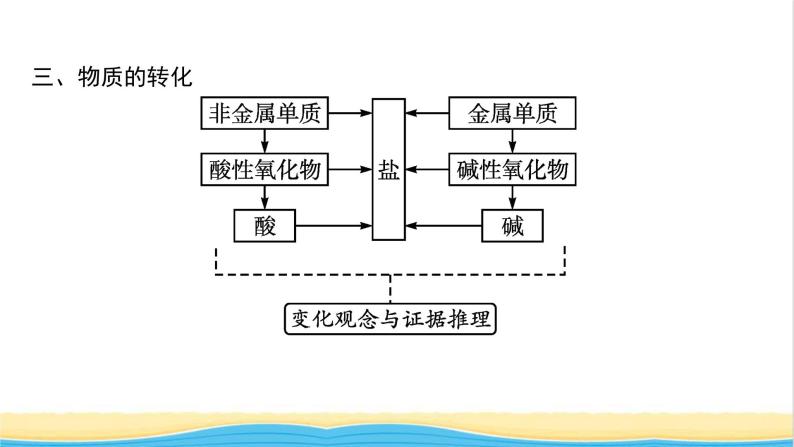
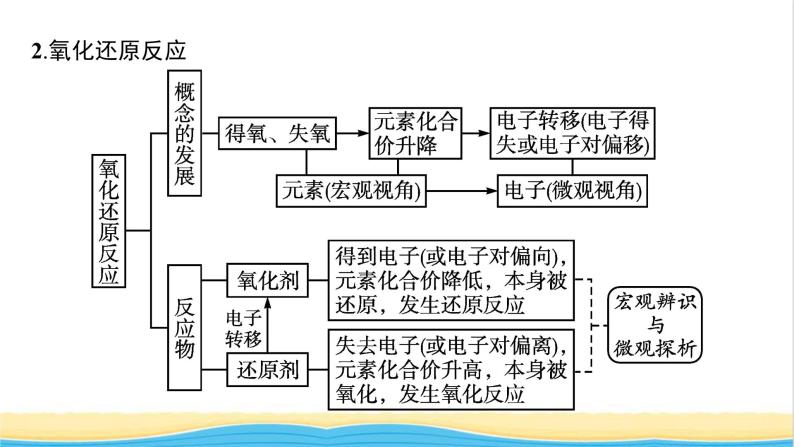
展开第一章2021内容索引知识网络重难突破知识网络一、物质的分类根据物质的组成对物质进行分类,培养证据推理的能力,强化模型认知的意识。二、化学反应的分类 三、物质的转化 四、两种重要反应类型1.离子反应2.氧化还原反应 重难突破典例1下列化学反应的离子方程式正确的是( ) 答案 A 离子方程式正误判断审题要点 对点训练1-1下列离子方程式正确的是( ) 答案 D 对点训练1-2写出下列反应的离子方程式:(1)Ba(OH)2溶液和H2SO4溶液反应 ; (2)KOH溶液和CH3COOH溶液反应 ; (3)Na2CO3溶液和HNO3溶液反应 ; (4)碳酸钙和HCl溶液反应 ; (5)氧化镁和H2SO4溶液反应 。 解析 初学离子方程式的书写,要严格按照“写、拆、删、查”四个步骤进行,在熟练之后,提倡直接写出离子方程式。在书写过程中,要特别注意:易溶、易电离的物质,如:HCl、H2SO4、HNO3、KOH、Ba(OH)2、NaOH、钠盐、钾盐、硝酸盐等,要用离子符号表示,而CH3COOH、H2O、BaSO4、CaCO3、CO2、MgO等要用化学式表示。典例2下列离子能大量共存的是( )答案 A 1.判断离子在溶液中能否大量共存的关键就是看离子间是否发生离子反应,若反应,则一般不能大量共存。(1)看离子间能否反应生成难溶物、微溶物。要熟练记忆常见酸、碱、盐的溶解性,特别是难溶性的盐类。(2)看离子间能否反应生成气体。气体又分酸性气体和碱性气体,具体表现为易挥发弱酸的酸根与H+不能大量共存, 与OH-不能大量共存。(3)看离子间能否反应生成难电离的物质(弱酸、弱碱、水等)。酸中的盐酸、硫酸和硝酸易电离,其他的酸一般难电离;碱中的氢氧化钠、氢氧化钾、氢氧化钙、氢氧化钡易电离,其他的碱一般认为是难电离。(4)看离子间能否发生氧化还原反应等。2.注意题目中附加的限定条件(1)无色透明的溶液中,不能存在有色离子,如Cu2+(蓝色)、Fe3+(棕黄色)、Fe2+(浅绿色)、 (紫红色)等。(2)在强酸性溶液中,与H+发生反应的离子不能大量存在。(3)在强碱性溶液中,与OH-发生反应的离子不能大量存在。对点训练2-1对四组无色透明溶液进行离子检验,四位同学各鉴定一组,他们的实验结论如下,其中可能正确的是( )答案 D解析 无色透明溶液中 不能大量存在,排除A;Mg2+和OH-会形成Mg(OH)2白色沉淀,排除B;H+和 反应会生成CO2气体,排除C;只有D项正确。对点训练2-2某种溶液可能含有下列阴离子中的一种或几种:(1)当溶液中有大量H+存在时,则 不可能大量存在。 (2)当溶液中有大量Ba2+存在时,溶液中 不可能大量存在。 (3)当溶液中有大量 和 等阳离子存在时,上述所有阴离子都不可能大量存在。 解析 溶液中离子不能大量共存,即离子之间会发生反应。氢离子可与碳酸根反应,二者不能大量共存;硫酸根、碳酸根可与钡离子反应,所以它们在含有大量钡离子的溶液中不能大量存在;银离子可与氯离子反应产生沉淀,所以有大量钡离子和银离子的溶液中,题干中所有阴离子都不能大量存在。典例3NaClO2可用作造纸的漂白剂,它可由反应H2O2+2ClO2+2NaOH === 2NaClO2+2H2O+O2制得,关于该反应的下列说法正确的是( )A.H2O2是氧化剂,H2O2中的氧元素被还原B.ClO2中氧元素化合价升高,被氧化C.ClO2中的氯元素被氧化D.ClO2是氧化剂,H2O2是还原剂答案 D解析 A项,反应中H2O2中氧元素的化合价从-1价升高到0价,H2O2做还原剂,错误;B项,ClO2中氧元素的化合价没有变化,错误;C项,ClO2中的氯元素化合价从+4价降低到+3价,氯元素被还原,错误。 氧化还原反应是有电子转移(电子得失或电子对偏移)的反应,其特征是元素的化合价发生变化,实质是有电子转移。相关氧化还原反应的概念较多,极易混淆。运用下列方法,可以快速准确地掌握氧化还原反应的有关概念。1.联想记忆关键词(1)记忆口诀:“升失氧还还、降得还氧氧。”其含义:化合价升高→失去电子(电子对偏离)→被氧化→还原剂→具有还原性(失电子能力);化合价降低→得到电子(电子对偏向)→被还原→氧化剂→具有氧化性(得电子能力)。(2)记忆口诀:“剂性一致,其他相反。”其含义:“剂性一致”即氧化剂具有氧化性,还原剂具有还原性。“其他相反”即氧化剂被还原,发生还原反应,得还原产物;还原剂被氧化,发生氧化反应,得氧化产物。2.学会正确的分析方法分析元素化合价变化是解决氧化还原反应相关问题的前提和基础,正确标出各元素的化合价是分析氧化还原反应的关键和突破口。具体方法是找变价,判类型(是否为氧化还原反应);分升降,定其他(化合价升高,失去电子,发生氧化反应;化合价降低,得到电子,发生还原反应)。对点训练3-1国产航母001A等舰艇的船底都涂有含Cu2O的防污涂料,制备Cu2O的一种方法为Zn+2CuSO4+2NaOH === Cu2O+ZnSO4+Na2SO4+H2O。该反应的下列说法正确的是( )A.Zn得到电子 B.CuSO4被氧化C.NaOH是还原剂 D.CuSO4是氧化剂答案 D解析 该反应过程中,Zn从0价升高到+2价,Cu从+2价降低到+1价。锌元素化合价升高,失去电子,A错误;CuSO4中铜元素化合价降低,CuSO4是该反应的氧化剂,被还原生成Cu2O,B错误,D正确;参加反应的NaOH中Na、O、H各元素化合价都没有发生变化,所以NaOH既不是该反应的氧化剂,也不是该反应的还原剂,C错误。对点训练3-2氢化钙可以作为生氢剂(CaH2中氢元素显-1价),发生反应的化学方程式为CaH2+2H2O === Ca(OH)2+2H2↑。其中H2( )A.既是氧化产物又是还原产物B.是氧化剂C.是还原剂D.既是氧化剂又是还原剂答案 A解析 反应中,CaH2中氢元素化合价由-1价升高至0价,H2O中氢元素化合价由+1价降低至0价,氢气既是氧化产物又是还原产物。典例4已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )A.3Cl2+6FeI2 === 2FeCl3+4FeI3B.Cl2+FeI2 === FeCl2+I2C.Co2O3+6HCl === 2CoCl2+Cl2↑+3H2OD.2Fe3++2I- === 2Fe2++I2答案 A解析 Fe3+能氧化I-,所以不可能生成FeI3,A项错误,D项正确;B项,当Cl2少量时,I-先被氧化,正确;C项,由于Co2O3的氧化性强于Cl2,所以Co2O3能氧化Cl-得到Cl2,而Co2O3被还原为Co2+,正确。1.氧化还原反应的基本规律 2.守恒法思维模型 答案 D









