




浙江专用高中化学课时检测20原子结构与元素的性质课件新人教版必修第一册
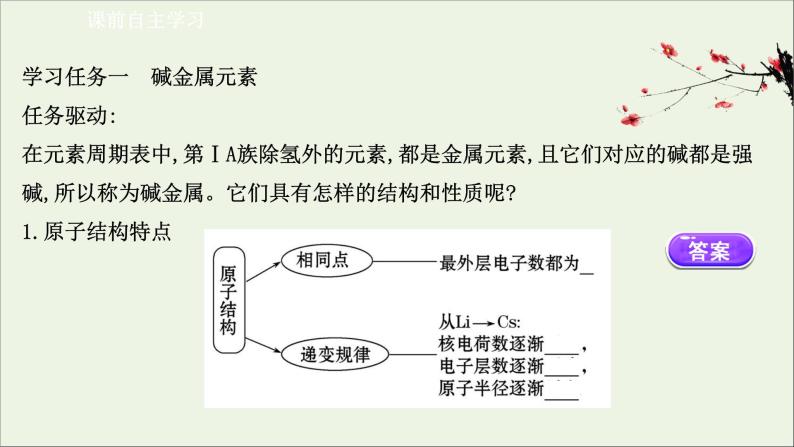
展开学习任务一 碱金属元素任务驱动:在元素周期表中,第ⅠA族除氢外的元素,都是金属元素,且它们对应的碱都是强碱,所以称为碱金属。它们具有怎样的结构和性质呢?1.原子结构特点
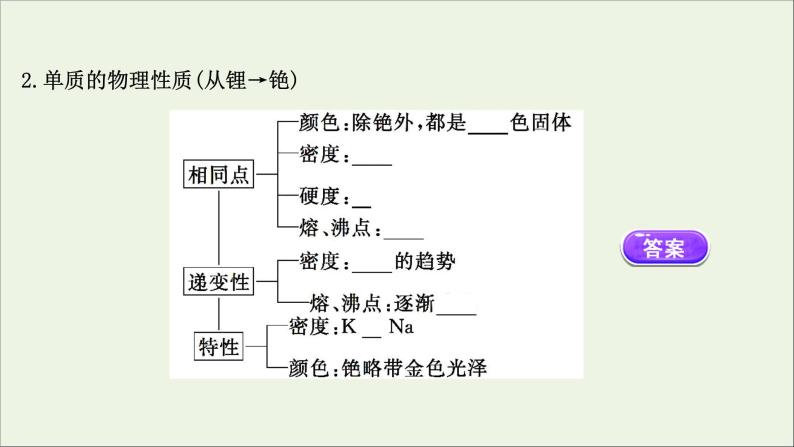
2.单质的物理性质(从锂→铯)
3.化学性质(1)锂、钠、钾与O2的反应。Li、Na分别在加热条件下与O2反应的化学方程式:_________________、_________________。K+O2 KO2,钾与O2的反应比钠_______。
4Li+O2 2Li2O
2Na+O2 Na2O2
(2)钠、钾与H2O的反应。
2Na+2H2O====2NaOH+H2↑
2K+2H2O====2KOH+H2↑
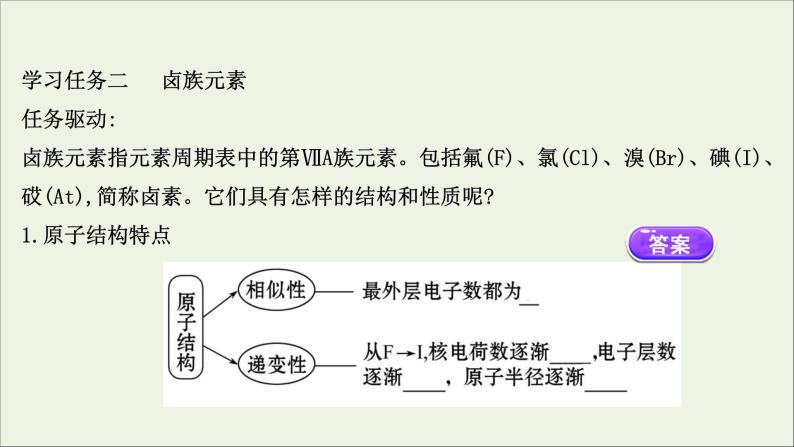
学习任务二 卤族元素任务驱动:卤族元素指元素周期表中的第ⅦA族元素。包括氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At),简称卤素。它们具有怎样的结构和性质呢?1.原子结构特点
2.卤素单质物理性质的相似性和递变性
3.单质的化学性质(1)与H2的反应。①X2与H2反应的比较。
H2+F2====2HF
H2+Cl2 2HCl
H2+Br2 2HBr
H2+I2 2HI
②结论。从F2到I2,与H2反应所需要的条件逐渐_____,剧烈程度:逐渐_____。从F2到I2,氢化物的稳定性:逐渐_____。
(2)单质间的置换反应。
2KBr+Cl2====2KCl+Br2
2Br-+Cl2====2Cl-+Br2
2KI+Cl2====2KCl+I2
2I-+Cl2====2Cl-+I2
2KI+Br2====2KBr+I2
2I-+Br2====2Br-+I2
(3)特性:I2遇淀粉变蓝色;溴是常温常压下唯一的液态非金属单质。(4)卤素单质都有毒,液溴易挥发,保存时常用水封。4.同主族元素性质的递变规律(从上到下)
【做一做】如表为元素周期表的一部分。
(1)表中元素__的非金属性最强;元素__的金属性最强;元素___的单质在室温下呈液态(填写元素符号)。(2)表中元素③的原子结构示意图是________。(3)表中元素⑥、⑦的氢化物的稳定性顺序为____>____(填写化学式,下同)。(4)表中元素最高价氧化物对应水化物酸性最强的酸的分子式是_____。
【探究任务一】碱金属元素 【问题情境】钠、钾的最外层电子数相同,都是碱金属元素,二者具有相似的化学性质。
【问题探究】1.锂、钠、钾在加热条件下与O2反应的产物类型相同吗?试分别写出产物的化学式。提示:不相同。产物分别是Li2O、Na2O2、KO2。2.钾比钠活泼,钾能否从NaCl溶液中置换出钠?提示:不能。因为钾与NaCl溶液中的水发生反应而不是与NaCl反应。3.你能根据钠、钾单质及其化合物的性质推测出氯化铯和碳酸铯能否溶于水吗?提示:能。碱金属单质及其化合物的性质具有相似性,依据NaCl(KCl)、Na2CO3(K2CO3)易溶于水可推测出CsCl、Cs2CO3也是易溶于水的。
【探究总结】1.碱金属元素单质化学性质的相似性和递变性(1)相似性(用R表示碱金属元素)
(2)递变性具体表现如下(按从Li→Cs的顺序)①与O2的反应越来越剧烈,产物越来越复杂,如Li与O2反应只能生成Li2O,Na与O2反应还可以生成Na2O2,而K与O2反应能够生成KO2等。
②与H2O的反应越来越剧烈,如K与H2O反应可能会发生轻微爆炸,Rb与Cs遇水发生剧烈爆炸。③最高价氧化物对应水化物的碱性逐渐增强。即碱性:LiOH
3.元素金属性强弱的判断依据
【探究特训】1.下列各组比较不正确的是( )A.锂与水反应不如钠与水反应剧烈B.还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠C.熔、沸点:Li>Na>KD.碱性:LiOH
【解析】选B。A中锂的活泼性比钠弱,与水反应不如钠剧烈;B中还原性K>Na>Li,但K不能置换出NaCl溶液中的Na,而是先与H2O反应;C中碱金属元素从Li到Cs,熔、沸点逐渐降低,即Li>Na>K>Rb>Cs;D中从Li到Cs,碱金属元素的金属性逐渐增强,对应最高价氧化物的水化物的碱性依次增强,即碱性:LiOH
2.(2020·菏泽高一检测)美国GPS采用了铯原子钟和铷原子钟结合的方式,我国北斗三号组网卫星使用的是先进氢钟和铷钟。下列有关氢、铷(Rb)、铯(Cs)的说法错误的是( )A.H、Rb、Cs均位于第ⅠA族B.H、Rb、Cs的最高正价均为+1C.Rb、Cs与水的反应均比K与水的反应更剧烈D.离子半径:Rb+>Cs+
【解析】选D。H、Rb、Cs的最外层都只有1个电子,均位于第ⅠA族,故A正确;最外层只有一个电子,最高价为+1价,故B正确;金属性Cs>Rb>K,则Rb、Cs与水的反应均比K与水的反应更剧烈,故C正确;电子层数越多半径越大,离子半径:Rb+
2.如图表示碱金属的某些性质与核电荷数的变化关系,则下列各性质中不符合图示关系的是( ) A.还原性 B.与水反应的剧烈程度C.熔点D.原子半径【解析】选C。由图可知,随着核电荷数的增大,碱金属的性质呈增大趋势,而碱金属单质的熔、沸点随核电荷数的增大而降低。
【探究任务二】 卤族元素【问题情境】卤族元素的单质都是双原子分子,它们的物理性质改变都是很有规律的,随着相对分子质量的增大,卤素分子的颜色变深,熔点、沸点、密度依次递增。卤素都有氧化性,氟单质的氧化性最强。
【问题探究】1.依据卤素单质的物理性质的递变规律,试推测砹的颜色和状态是________。 提示:黑色,固体。卤素单质自上而下,颜色逐渐加深,熔点依次升高,状态由气态→液态→固态,故砹为黑色固体。2.试比较F、Cl、Br、I对应氢化物的稳定性,据此,能否判断F、Cl、Br、I非金属性的强弱?提示:稳定性:HF>HCl>HBr>HI;氢化物的稳定性越强,则对应元素的非金属性越强,即非金属性强弱顺序为F>Cl>Br>I。
3.氯气能从NaBr溶液中置换出Br2,F2比Cl2活泼,F2能否从NaBr溶液中置换出Br2?提示:不能。F2能与NaBr溶液中的水反应生成HF和O2,不能从NaBr溶液中置换出Br2。4.已知还原性I->Br->Cl->F-,试从原子结构的角度分析原因。提示:还原性即微粒失去电子的能力。按I-→Br-→Cl-→F-的顺序,离子的半径逐渐减小,原子核对最外层电子的吸引力逐渐增大,失去电子的能力逐渐减弱,故还原性逐渐减弱。
【探究总结】1.卤族元素单质化学性质的相似性和递变性(1)相似性(用X代表卤族元素):单质X2化合物→最高价氧化物对应水化物(除氟外)都为强酸
(2)递变性 具体表现如下:与H2反应越来越难,对应氢化物的稳定性逐渐减弱,离子的还原性逐渐增强。HCl、HBr、HI的水溶液都是强酸。
2.从原子结构角度认识卤族元素性质的递变规律
3.元素非金属性强弱的判断方法:
【拓展提升】卤素单质的特殊性1.氟无正价,无含氧酸,而Cl、Br、I都有正化合价和含氧酸。2.Cl2易液化,Br2易挥发,I2易升华。3.常温下呈液态的非金属单质是Br2,淀粉遇I2变蓝色。4.活泼的卤素单质能置换较不活泼的卤素单质,但F2不能从NaCl溶液中置换出Cl2,原因是2F2+2H2O====4HF+O2。
4.对卤族元素F、Cl、Br、I①单质熔点由高到低的顺序为I2>Br2>Cl2>F2。②非金属性由强到弱的顺序为F>Cl>Br>I。③单质的氧化性由强到弱的顺序为F2>Cl2>Br2>I2。④对应简单阴离子还原性由强到弱的顺序为I->Br->Cl->F-。⑤氢化物的稳定性由强到弱的顺序为HF>HCl>HBr>HI。⑥与H2反应的剧烈程度为F2>Cl2>Br2>I2。⑦最高价氧化物对应水化物的酸性由强到弱的顺序为HClO4>HBrO4>HIO4。
【探究特训】1.下列对卤素的说法不符合递变规律的是( )A.F2、Cl2、Br2、I2的氧化性逐渐减弱B.HF、HCl、HBr、HI的热稳定性逐渐减弱C.F-、Cl-、Br-、I-的还原性逐渐增强D.卤素单质按F2、Cl2、Br2、I2的顺序颜色变浅,密度增大【解题指南】解答本题需注意以下两点:(1)卤族元素性质上的相似性和递变性。(2)卤族元素在性质上的特殊性。
【解析】选D。从F→I,原子半径依次增大,单质氧化性逐渐减弱,则阴离子的还原性逐渐增强,氢化物的稳定性逐渐减弱,卤素单质按F2、Cl2、Br2、I2的顺序颜色逐渐变深,密度也逐渐增大。
【延伸探究】(1)若将B项中的“热稳定性”改为“酸性”, B项是否正确?提示:不正确。HF、HCl、HBr、HI的酸性逐渐增强。(2)若将D项中的“颜色变浅”改为“熔、沸点升高”,D项是否正确?提示:正确。F2、Cl2为气体,Br2为液体,I2为固体。
2.(2020·成都高一检测)有关卤族和碱金属元素性质的递变规律说法正确的是( )A.卤族元素从F到I,对应氢化物的还原性逐渐增强B.碱金属元素与O2反应均可得到多种氧化物C.碱金属元素从Li到Cs,金属性逐渐减弱D.X2+2NaI====2NaX+I2(X为:F、Cl、Br)
【解析】选A。卤素离子从上往下半径逐渐增大,所以对应氢化物的还原性逐渐增强,故A正确;Li与氧气反应只生成Li2O,活泼碱金属元素单质与O2反应可得到多种氧化物,故B错误;从Li到Cs同主族金属性逐渐增强,故C错误;氟气和水反应生成HF和氧气,不能用X2+2NaI====2NaX+I2(X为:F、Cl、Br)表示,故D错误。
【补偿训练】1.(2020·长治高一检测)下列关于碱金属或卤族元素的叙述中,正确的是( )A.碱金属单质都可保存在煤油中B.Rb比Na活泼,故Rb可以从NaCl溶液中置换出NaC.砹(At)是第六周期的卤族元素,根据卤素性质的递变规律,还原性:HAt>HID.卤素单质与水反应的通式为X2+H2O====HX+HXO
【解析】选C。Li密度小于煤油,所以Li会浮在煤油表面,不能用煤油保存Li,可以用石蜡,故A错误;Rb和Na都能和水反应生成氢气,将Rb投入NaCl溶液中,Rb先和水反应生成RbOH和氢气,所以不能用Rb置换出NaCl溶液中的Na,故B错误;元素的非金属性越强,其氢化物的还原性越弱,非金属性At
2.下列关于卤素(用X表示)的叙述中正确的是( )A.卤素单质与水反应均可用X2+H2O====HXO+HX表示B.HX都极易溶于水,它们的热稳定性随核电荷数的增大而增强C.卤素单质的颜色从F2→I2按相对分子质量的增大而加深D.X-的还原性强弱依次为F-
3.卤族元素(F、Cl、Br、I)属于第ⅦA族元素,除F外,其他元素的最高正价为+7,最高价的含氧酸为HXO4,但氟元素无正价,形不成含氧酸。下列有关卤族元素的说法中,正确的是( )A.酸性:HFO4>HClO4 B.最外层电子数:Br>IC.密度:Cl2>Br2 D.氢化物的稳定性:HBr>HI【解析】选D。氟元素无正价,无最高价含氧酸,A错误;卤族元素的最外层电子数都是7,B错误;随着原子序数的增大,卤族元素单质的密度逐渐增大,氢化物的稳定性逐渐减弱,C错误,D正确。
4.某同学做同主族元素性质的相似性、递变性实验时,自己设计了一套实验方案,并记录了有关实验现象(表中的“实验方案”与“实验现象”前后不一定是对应关系)。
请你帮助该同学整理并完成实验报告。(1)实验目的:探究同主族元素性质的相似性和递变性。(2)实验用品:①仪器:________、________、镊子、小刀、玻璃片等。 ②试剂:金属钠、金属钾、新制氯水、溴水、0.1 ml·L-1 NaBr溶液、0.1 ml·L-1 NaI溶液、CCl4等。
(3)实验内容(填写与实验方案对应的实验现象的字母和化学方程式):(4)实验结论:_______________________。
【解析】钾的金属性比钠强,钾与冷水反应比钠与冷水反应剧烈,产生的H2能发生燃烧或轻微的爆炸;将新制氯水滴入NaBr溶液中,发生反应:Cl2+2NaBr====Br2+2NaCl,用CCl4萃取,液体分层,下层呈橙红色。将溴水滴入NaI溶液中发生反应:Br2+2NaI====I2+2NaBr,用CCl4萃取,液体分层,下层呈紫红色。
答案:(2)①试管 胶头滴管(3)(4)同主族元素性质相似;自上到下元素原子失去电子的能力增强,得到电子的能力减弱
浙江专用高中化学课时检测23离子键课件新人教版必修第一册: 这是一份浙江专用高中化学课时检测23离子键课件新人教版必修第一册,共27页。PPT课件主要包含了课前自主学习,静电作用,带相反电荷离子,阴离子,阳离子,活泼金属,活泼非金属,离子键,KCl,MgCl2等内容,欢迎下载使用。
浙江专用高中化学课时检测1物质的分类课件新人教版必修第一册: 这是一份浙江专用高中化学课时检测1物质的分类课件新人教版必修第一册,共60页。PPT课件主要包含了课前自主学习,同一种元素,C60,混合物,~100,FeCl3饱和溶液,一条光亮的“通,丁达尔效应,课堂合作探究,酸能和活泼金属反等内容,欢迎下载使用。
浙江专用高中化学课时检测24共价键课件新人教版必修第一册: 这是一份浙江专用高中化学课时检测24共价键课件新人教版必修第一册,共49页。PPT课件主要包含了课前自主学习,共用电子对,共价化合物,电子式,旧化学键,新化学键,HCl,分子聚集在一起,化学键,课堂合作探究等内容,欢迎下载使用。












