




高中化学苏教版选修4 化学反应原理第一单元 化学反应中的热效应多媒体教学ppt课件
展开H2(g)+1/2O2(g)==H2O(g) △H1=-241.8kJ/ml 那么,H2的燃烧热△H究竟是多少?如何计算?已知: H2O(g)==H2O(l) △H2=-44kJ/mlH2(g)+1/2O2(g)==H2O(l) △H=△H1+△H2=-285.8kJ/ml
下列数据△H1表示燃烧热吗?why
小组讨论汇报
如何测出这个反应的反应热: (1)C(s)+1/2O2(g)==CO(g) ΔH1=?
①C(s)+1/2O2(g)==CO(g) ΔH1=? ②CO(g)+1/2O2(g)== CO2(g) ΔH2=-283.0kJ/ml③C(s)+O2(g)==CO2(g) ΔH3=-393.5kJ/ml
① + ② = ③ , 则 ΔH1 + ΔH2 =ΔH3所以, ΔH1 =ΔH3- ΔH2 =-393.5kJ/ml+ 283.0kJ/ml=-110.5kJ/ml
不管化学反应是分一步完成或分几步完成,其反应热是相同的。 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
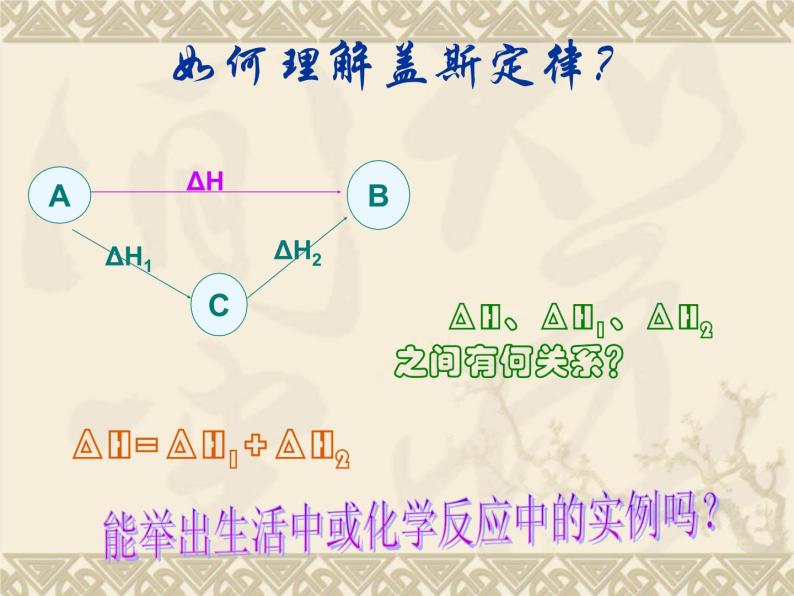
ΔH、ΔH1、ΔH2之间有何关系?
能举出生活中或化学反应中的实例吗?
例1:写出石墨变成金刚石的热化学方程式 (25℃,101kPa时)说明: (1)可以在书中查找需要的数据 (2)并告诉大家你设计的理由。
石墨能直接变成金刚石吗?
先思考,之后小组讨论汇报
查燃烧热表知:①C(石墨,s)+O2(g)==CO2(g) △H1=-393.5kJ/ml②C(金刚石,s)+O2(g)==CO2(g) △H2=-395.0kJ/ml
所以, ①- ②得: C(石墨,s)= C(金刚石,s) △H=+1.5kJ/ml
观察该热化学方程式,回答:金刚石能自动变成石墨吗?需要什么条件?
你知道神六的火箭燃料是什么吗?
例2:某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知: N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/ml N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/ml 假如都在相同状态下,请写出发射火箭反应的热化学方程式。
2 N2H4(g)+ 2NO2(g)== 3N2(g)+4H2O(l) △H=-1135.2kJ/ml
思考:如何选择火箭燃料? 对照书中燃烧热的表格
1、怎么比较各种燃料?2、若只考虑能量,用什么最好?3、只考虑能量行吗?为什么?
比冲性能、自燃特性、无毒、可贮存
1、请用自己的话描述一下盖斯定律。2、盖斯定律有哪些用途?
人教版 (2019)选择性必修1第二节 反应热的计算课前预习课件ppt: 这是一份人教版 (2019)选择性必修1第二节 反应热的计算课前预习课件ppt,共18页。PPT课件主要包含了盖斯定律,盖斯定律直观化,△H=△H1+△H2,COg,CO2g,P12,盖斯定律的应用,求未知反应焓变的方法等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第三节 化学反应热的计算说课ppt课件: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第三节 化学反应热的计算说课ppt课件,共17页。PPT课件主要包含了根据下列反应计算,盖斯定律的内容,盖斯定律模型,△H=△H1+△H2,盖斯定律,盖斯定律的应用,加减消元法,求未知反应焓变的方法,可逆反应焓变等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第三节 化学反应热的计算课前预习课件ppt: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第三节 化学反应热的计算课前预习课件ppt,共12页。PPT课件主要包含了反应热的计算,典型例题等内容,欢迎下载使用。













