



高中化学苏教版选修4 化学反应原理第一单元 化学反应中的热效应评课课件ppt
展开考点一 反应热 焓变
符号:△H
单位:KJ·ml-1
在恒温、恒压的条件下,化学反应过程中所吸收或释放的热量称为反应的焓变。
化学反应过程中吸收或放出的热量叫做化学反应的反应热.
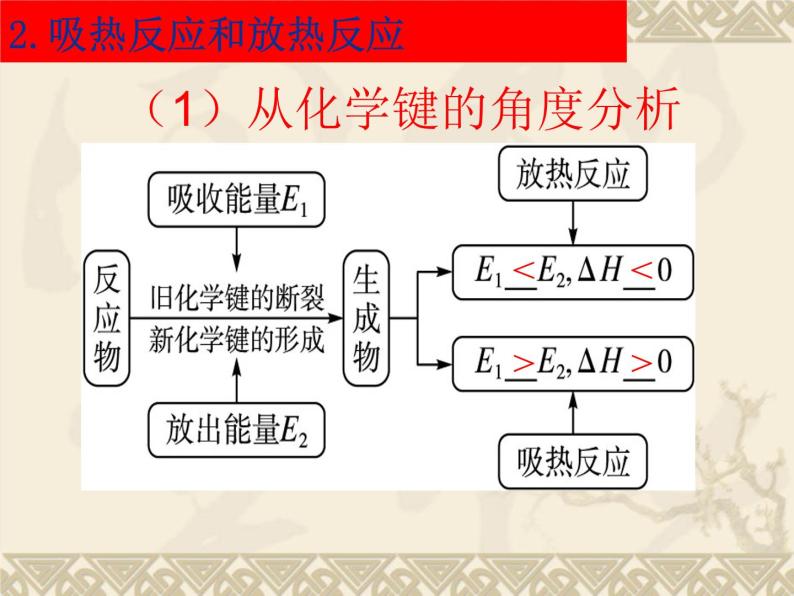
(1)从化学键的角度分析
2.吸热反应和放热反应
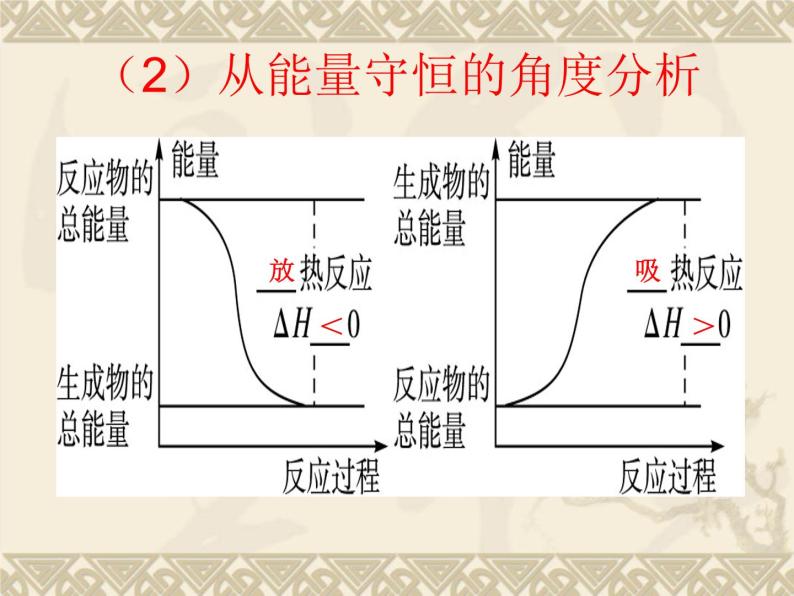
(2)从能量守恒的角度分析
1、吸热、放热反应的实质:
取决于所有断键吸收的总能量与所有形成新键放出的总能量的相对大小
取决于生成物的总能量与反应物的总能量的相对大小
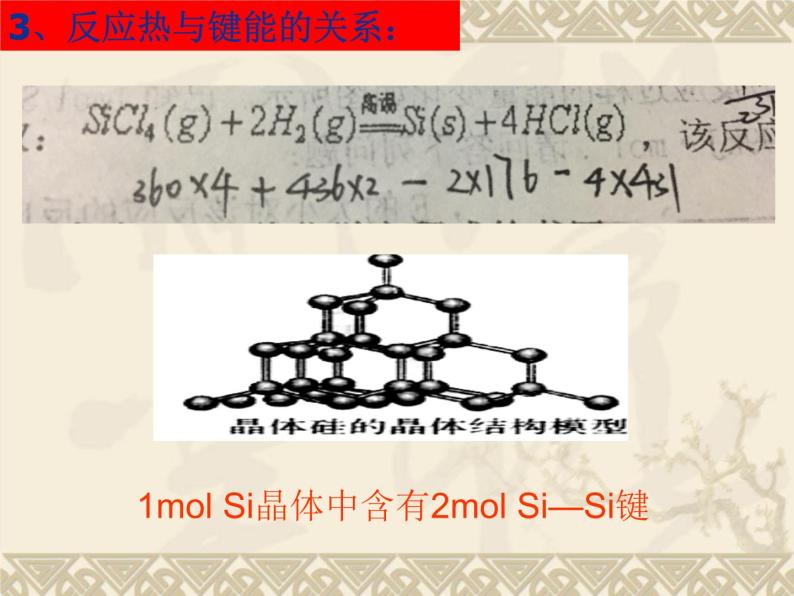
1ml Si晶体中含有2ml Si—Si键
3、反应热与键能的关系:
考点二 热化学反应方程式的书写
热化学方程式定义:能够表示反应热的化学方程式叫做热化学方程式。 不仅表示了化学反应中的 物质变化,也表明了化学反应中的能量变化。
(1)反应物和生成物要标明其聚集状态,用g、l、s 、aq分别代表气态、液态、固态、溶液 。 (2)方程式右端用△H 标明恒压条件下反应放出或吸收的热量,放热为负,吸热为正。 (3)热化学方程式中各物质前的化学计量数不表示分子个数,只表示物质的量,因此可以是整数或分数。 (4)对于相同物质的反应,化学计量数不同时,△H 也不同,即△H 的值与计量数成正比。
考点三 盖斯定律及反应热计算
盖斯定律:一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。
Al2O3(s)+AlC13(g)+3C(s) =3AlCl(g)+3CO(g) △H=a kJ·ml-1 3AlCl(g)=2Al(l)+AlC13(g) △H=b kJ·ml-1①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·ml-1
同一物质:确保系数相同, 在不同边相加,相同边相减。各个方程式的△H也相加减。
1、小组“合作探究”完成【典例精析】2、思考【展示提升】的对应问题, 并形成结论交流讨论
化学选修4 化学反应原理第一单元 化学反应中的热效应评课ppt课件: 这是一份化学选修4 化学反应原理第一单元 化学反应中的热效应评课ppt课件,共14页。PPT课件主要包含了展示提升,书写要点,ΔHΔH1+ΔH2,知识小结等内容,欢迎下载使用。
2021学年第一单元 化学反应中的热效应教课ppt课件: 这是一份2021学年第一单元 化学反应中的热效应教课ppt课件,共21页。PPT课件主要包含了“-”表示放热,表示反应热的大小等内容,欢迎下载使用。
苏教版选修4 化学反应原理第一单元 化学反应中的热效应教案配套ppt课件: 这是一份苏教版选修4 化学反应原理第一单元 化学反应中的热效应教案配套ppt课件,共26页。PPT课件主要包含了复习回顾,反应热焓变,放热反应,吸热反应,化学键的断裂和形成,观察下列示意图,从键能角度看,交流与讨论,热化学方程式,物质变化等内容,欢迎下载使用。













