高中苏教版第一单元 化学反应速率教案设计
展开《化学反应速率的表示方法》教学设计
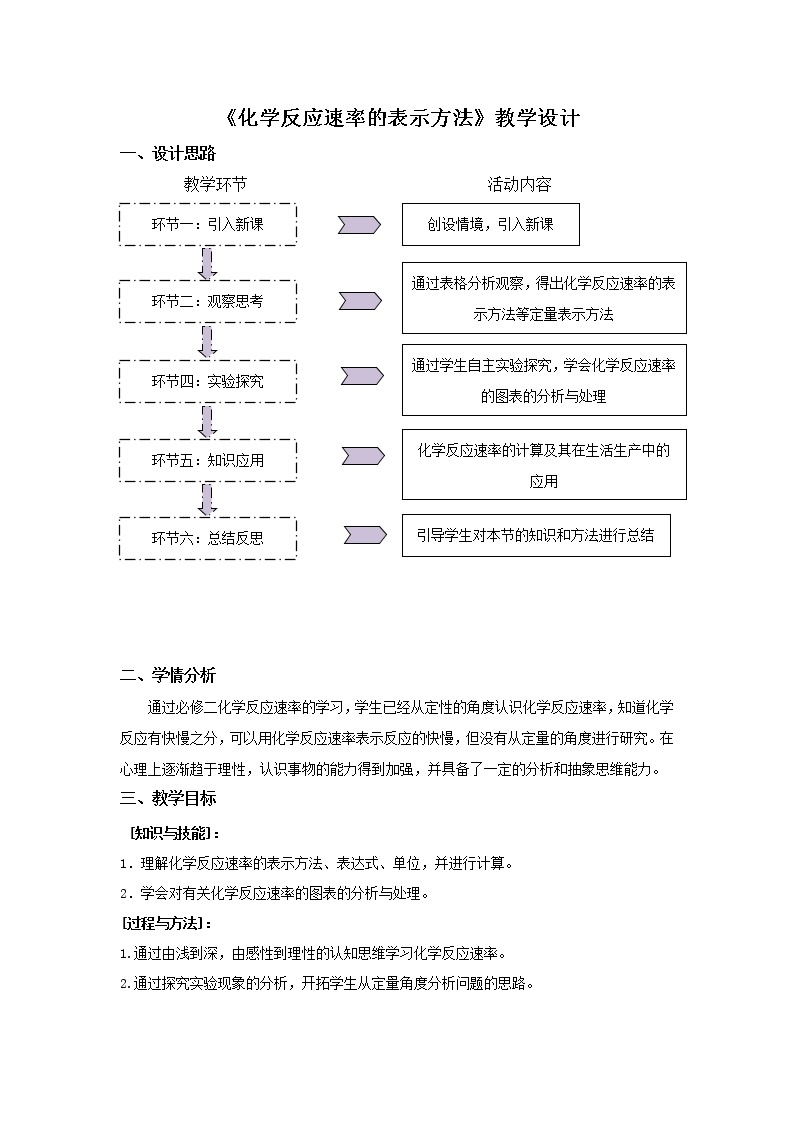
一、设计思路
教学环节 活动内容
二、学情分析
通过必修二化学反应速率的学习,学生已经从定性的角度认识化学反应速率,知道化学反应有快慢之分,可以用化学反应速率表示反应的快慢,但没有从定量的角度进行研究。在心理上逐渐趋于理性,认识事物的能力得到加强,并具备了一定的分析和抽象思维能力。
三、教学目标
[知识与技能]:
1.理解化学反应速率的表示方法、表达式、单位,并进行计算。
2.学会对有关化学反应速率的图表的分析与处理。
[过程与方法]:
1.通过由浅到深,由感性到理性的认知思维学习化学反应速率。
2.通过探究实验现象的分析,开拓学生从定量角度分析问题的思路。
[情感态度与价值观]:
1.培养学生对化学反应研究的兴趣,能够在化学反应原理的探究过程中找到成功的喜悦,激发学习化学、探究原理的动力。
2.通过学习了解人们在工农业生产和实际生活中控制外因,实现控制化学反应快慢的事实,感受化学学科的社会价值。
四、教学重点和难点
教学重点:1.化学反应速率的表达式以及相关计算;
2.化学反应速率的图表的分析与处理,化学反应速率的实验测定
教学难点:化学反应速率的图与表的应用
五、教学方法 诱思探究法、实验分析法
六、教学过程
教学环节 |
教师活动 | 学生 活动 | 设计 意图 | ||||||||||||||||||||||
引入新课 | [图 片] | 烟火的燃放在瞬间就能完成,煤的形成在短时间内无法察觉 |
观察、描述反应快慢的定性判断方法
| 1、从学生熟悉的实验着手重现化学反应有快慢之分2、从定性表达自然过渡到定量表示 | |||||||||||||||||||||
[回 忆] | 比较NaHCO3、Na2CO3与盐酸反应的快慢 | ||||||||||||||||||||||||
[设 疑] | 化学反应中可以通过哪些直观的现象来判断反应的快慢? |
| |||||||||||||||||||||||
[过渡] | 同学们刚才提到的都属于定性判据,只能粗略的表示化学反应的快慢,这就有必要引入一个物理量来准确、定量的表示反应的快慢。 | ||||||||||||||||||||||||
观 察 思 考 |
[投影] [定量分析]
[板书] |
已知反应:2H2O2=2H2O+O2↑,H2O2溶液在室温下浓度的变化如下:
1、算出0-20min双氧水的反应速率 2、作出过氧化氢分解反应的浓度-时间曲线图 3、从图像中归纳出反应速率随时间的变化情况,有何启示? | |||||||||||||||||||||||
化学反应速率表达式、常用单位 | 1、板演反应速率计算过程2、在书上作图3、思考回答:速率随反应时间增长而减小 | 1、巩固化学反应速率计算过程2、学会结合图像进行问题分析 | |||||||||||||||||||||||
[投影] | 1、阅读P33页,完成表2-2中的0-1min、1-2min的变化浓度(小数点保留两位)、反应速率(小数点保留三位) 2、从表格的每一组数据中可以得到什么结论?
| 在书中表格填写相关数据,小组讨论思考回答:1、不同物质表示同一反应速率结果不同2、各物质速率比等于系数比 |
学会结合表格进行数据分析,从而得出相应结论 | ||||||||||||||||||||||
|
[板书] | mA+nB=pC+qD V(A):V(B):V(C):V(D)=m:n:p:q |
|
| |||||||||||||||||||||
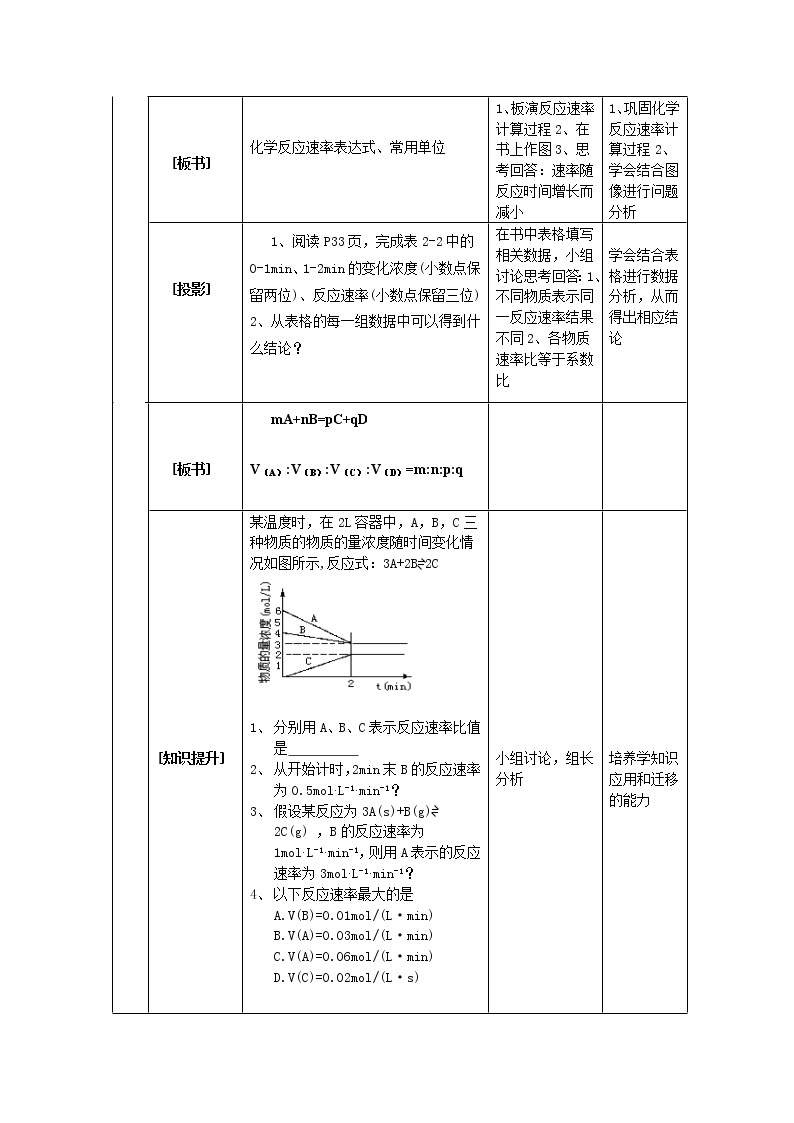
[知识提升]
| 某温度时,在2L容器中,A,B,C三种物质的物质的量浓度随时间变化情况如图所示,反应式:3A+2B=2C 1、 分别用A、B、C表示反应速率比值是 2、 从开始计时,2min末B的反应速率为0.5mol.L-1.min-1? 3、 假设某反应为3A(s)+B(g)= 2C(g) ,B的反应速率为1mol.L-1.min-1,则用A表示的反应速率为3mol.L-1.min-1? 4、 以下反应速率最大的是 A.V(B)=0.01mol/(L·min) B.V(A)=0.03mol/(L·min) C.V(A)=0.06mol/(L·min) D.V(C)=0.02mol/(L·s) |
小组讨论,组长分析 |
培养学知识应用和迁移的能力 | ||||||||||||||||||||||
[归纳] 1、固体、纯液体无浓度可言,不能用来表示反应速率2、比较反应速率时注意转化为同一单位、同一基准物质 | |||||||||||||||||||||||||
自 主 实 验 探 究 |
[设疑] |
在掌握的化学反应速率的定量表示方法后,进一步来了解化学反应速率有哪些实验测定方法?说出书上介绍的方法有哪些? |
看书归纳: 1、气体生成的反应——体积法 2、颜色变化的反应——比色法
| 学会从书上找到有用的信息,提高分析概括能力 | |||||||||||||||||||||
[图片] | 电导仪和折光仪分别通过测定溶液的导电能力和折光率,再换算成溶液的浓度进行相关计算 |
|
| ||||||||||||||||||||||
[设疑] |
根据现有的知识基础,想一想有哪些实验方法可以用来测定稀HCl和CaCO3的反应速率? CaCO3 + 2HCl =CaCl2 +H2O + CO2↑ ( CaCO3 + 2H+ =Ca2+ +H2O + CO2↑ )
| 小组讨论, 组长代表概括: 1、固体在一定时间内的减少量 2、一定时间内产生气体的体积3、产生一定气体体积所需要的时间4、测定一定时间内钙离子浓度的改变量5、测定一定时间内氢离子浓度的改变量 |
培养知识应用、分析归纳能力 | ||||||||||||||||||||||
[学生实验] | 考虑到实验的简便性及可行性,采用测定一定时间内产生二氧化碳体积的方法来测定该化学反应的速率。在锥形瓶中加20g大理石,再加入80毫升1mol·L -1的盐酸。每隔10S,读一次数据。 |
学生代表实验,记录实验数据,其余学生观看实验过程 |
培养化学实验操作能力 | ||||||||||||||||||||||
[强调]
|
注: 1.盐酸要迅速加入2.装置气密性要好3.计时迅速准确 |
|
培养实验的严谨性
| ||||||||||||||||||||||
|
[设疑] |
1、为什么同一化学反应测定得到的数据存在差异? 2、造成这种结果的原因可能有哪些? 3、有何实验改进方法? | 记录实验数据,讨论归纳: 1、读表的时间存在误差2、大理石的颗粒大小不同3、塞上橡胶塞的速度不同4、加入盐酸的速度不同5、玻璃针筒内部存在的摩擦力不用…… 可增加分液漏斗 | ||||||||||||||||||||||
[设疑] | 请同学们把P34表中的数据在左图的直角坐标系中表示出来 双氧水分解速率随时间增加而减小,碳酸钙和盐酸反应速率在一定时间内随时间的增加而加快,为什么? |
画图,讨论归纳:前者反应速率主要受反应物浓度的影响,后者此时主要受温度的影响 | 培养实验作图能力,通过前后图像的差异对比加深了对知识的理解和应用 | ||||||||||||||||||||||
知识应用 |
[讲述+图片] | 化学反应速率与我们的生活是息息相关的,我们总希望对我们有利的反应越快越好,而对我们不利的反应则越慢越好!因此有效的控制反应速率就变得尤为重要! |
感受生活中中反应速率的影响 |
体会与社会、生活有密切的关系 | |||||||||||||||||||||
总结反思 |
[总结] | 通过今天的学习,掌握了化学反应速率的定性、定量表达方法,我们从一个新的角度再次认识了化学反应除了伴随物质变化和能量变化外还有快慢的问题。另外,对于化学反应的描述远不止这几个方面,将在以后学习中继续学习。 |
归纳总结 |
培养归纳能力 | |||||||||||||||||||||
高中化学苏教版选修4 化学反应原理第一单元 化学反应速率教学设计: 这是一份高中化学苏教版选修4 化学反应原理第一单元 化学反应速率教学设计,共1页。教案主要包含了教学中值得发扬的方面等内容,欢迎下载使用。
高中化学苏教版选修4 化学反应原理第一单元 化学反应速率教案及反思: 这是一份高中化学苏教版选修4 化学反应原理第一单元 化学反应速率教案及反思,共5页。教案主要包含了学习任务分析,学习者分析,教学目标,教学重难点,教学过程等内容,欢迎下载使用。
2021学年第一单元 化学反应速率教学设计: 这是一份2021学年第一单元 化学反应速率教学设计,共4页。教案主要包含了适用对象,适用阶段等内容,欢迎下载使用。













