






利用化学方程式的简单计算PPT课件免费下载
展开一、【课程的主要内容】
初步掌握化学方程式计算的解题步骤和格式
理解化学变化中存在固定的质量比且相对质量之比等于实际质量之比
1、写出电解水的化学方程式,找出其中的定量关系
反应中水、氢气、氧气的微粒个数比= ;相对质量比= 。
由 可知任何化学反应都存在确定的定量关系
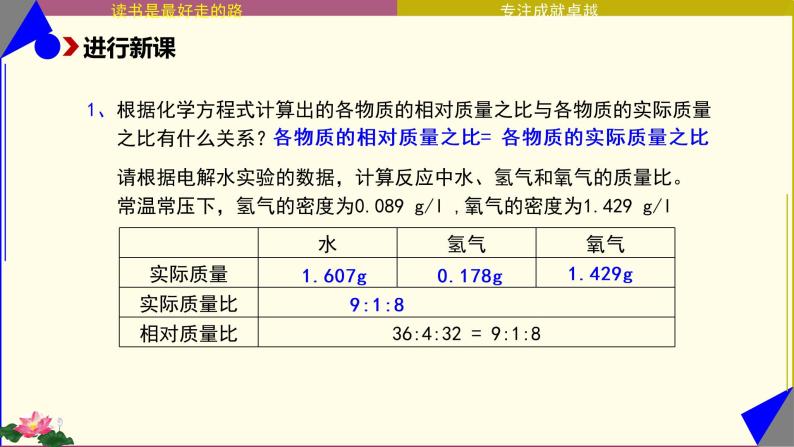
请根据电解水实验的数据,计算反应中水、氢气和氧气的质量比。常温常压下,氢气的密度为0.089 g/l ,氧气的密度为1.429 g/l
1、根据化学方程式计算出的各物质的相对质量之比与各物质的实际质量 之比有什么关系?
各物质的相对质量之比 = 各物质的实际质量之比
根据电解水得到的0.178g氢气和1.429g的氧气,如何推算水的化学式?
解法1:设水的化学式为HaOb
解法2:设水的化学式为HaOb
2、化学反应中各物质有固定的质量比有哪些应用?
(1)判断反应物是否完全参加了化学反应
例1:4g氢气与16g氧气充分反应,是否有20g水生成?
(2)计算反应中各物质的质量
【结论】 只要知道化学方程式中任何一种物质的实际质量,即可求出其他物质的质量
4、阅读教材101~102页例题,在学法69页填写下列空白
二、【例题分析】
【例】实验室以过氧化氢溶液为原料制取4kg氧气,需要过氧化氢的 质量是多少?
解:设需要过氧化氢的质量为 x 。
答:需要8.5kg的过氧化氢 。
【练习】学法69页【即学即用2-1】。将12.5g混有二氧化锰的氯酸钾固体加 热至质量不再减少,冷却后称量固体的质量为7.7g。反应 (1)反应生成氧气的质量为 g (2)计算反应前固体中二氧化锰的质量分数。
245 96
答:反应前固体中二氧化锰的质量分数是2%。
解:设二氧化锰的质量为 x
利用化学方程式的简单计算
未知量为x(不带单位)
化学方程式、相关物质的相对质量、已知量和未知量
列比例(左右比=左右比或上下比=上下比)求解
氢气在氯气中燃烧生成氯化氢气体,写出该反应的化学方程式,并计算燃烧100g氢气需要氯气的质量是多少?生成氯化氢气体的质量是多少?
答:参加反应的过氧化氢的质量为3.4g。
实验室用68g过氧化氢溶液和2g二氧化锰制取氧气,实验的相关数据如图。请回答:(1)反应生成氧气的质量为 g;(2)参加反应的过氧化氢的质量是多少?
为了测定实验室中氯酸钾样品的纯度,某学习小组取2.5g该样品与0.5g二氧化锰混合,加热该混合物t1时间后(假设杂质不参加反应),冷却、称量剩余固体的质量,重复以上操作,依次称得加热t1、t2、t3、t4 时间后剩余固体的质量,记录数据如下表:
(1)在 时间后,该样品中氯酸钾已经完全反应。(2)完全反应后产生氧气的质量 。(3)计算该样品中氯酸钾的质量分数。
解:设样品中氯酸钾的质量为x
245 96
答:样品中氯酸钾的质量分数为98%。
三、【思考与探究】
4、请你应用质量守恒定律的有关知识,完成下列各题。 (1)硅是太阳能电池和电脑芯片中不可缺少的材料。生产硅的一个重要 化学反应为:SiO2 + 2C Si+ 2X↑。由此推断X的化学式为 。 (2)过氧化钙的化学式为CaO2,与水反应生成氧气和氢氧化钙,所以, 过氧化钙常用于鱼池供氧剂。配平该反应的化学方程式: CaO2 + H2O = Ca(OH)2 + O2↑ (3)北京奥运火炬所用的燃料是丙烷(化学式为C3H8),丙烷燃烧的化学 方程式为 。
2 2 2 1
5、用“ ”和“ ”分别代表两种不同的单质分子A2和B2,它们 在一定条件下能发生化学反应,其反应的微观示意图如下:
若3 g A2完全反应,得到17 g产物。已知B2的相对分子质量为28,则生成物的相对分子质量为 。
分析:该反应的化学方程式为6A2 + 2B2 = 4BA3,B2的质量=17g-3g=14g
56 4x14g 17g
1、取氯酸钾与二氧化锰的混合物30g,加热到不再产生氧气为止, 得剩余固体20.4g。 ①二氧化锰的质量= 。 ②生成氯化钾多少克?
解:设氯化钾的质量为X,则二氧化锰的质量=20.4g-X。由质量守恒 定律可知生成氧气的质量=30g-20.4g=9.6g。
149 96 X 9.6g
二氧化锰的质量=20.4g-14.9g=5.5g
答:生成14.9gKCl。
人教版九年级上册课题 3 利用化学方程式的简单计算多媒体教学课件ppt: 这是一份人教版九年级上册课题 3 利用化学方程式的简单计算多媒体教学课件ppt,共18页。PPT课件主要包含了学习目标,我能行,最易出错的地方等内容,欢迎下载使用。
初中化学人教版九年级上册第五单元 化学方程式课题 3 利用化学方程式的简单计算背景图课件ppt: 这是一份初中化学人教版九年级上册第五单元 化学方程式课题 3 利用化学方程式的简单计算背景图课件ppt,共9页。PPT课件主要包含了解题步骤,x32g,引导归纳,讨论点拨,g×15%,x45g等内容,欢迎下载使用。
人教版九年级上册课题 3 利用化学方程式的简单计算习题课件ppt: 这是一份人教版九年级上册课题 3 利用化学方程式的简单计算习题课件ppt,共23页。PPT课件主要包含了质量守恒定律,设未知量,写出反应的化学方程式,列出比例式求解,简明地写出答案,92g,化学方程式未配平,计算结果错误,都正确等内容,欢迎下载使用。













