





高中第二节 电解池多媒体教学ppt课件
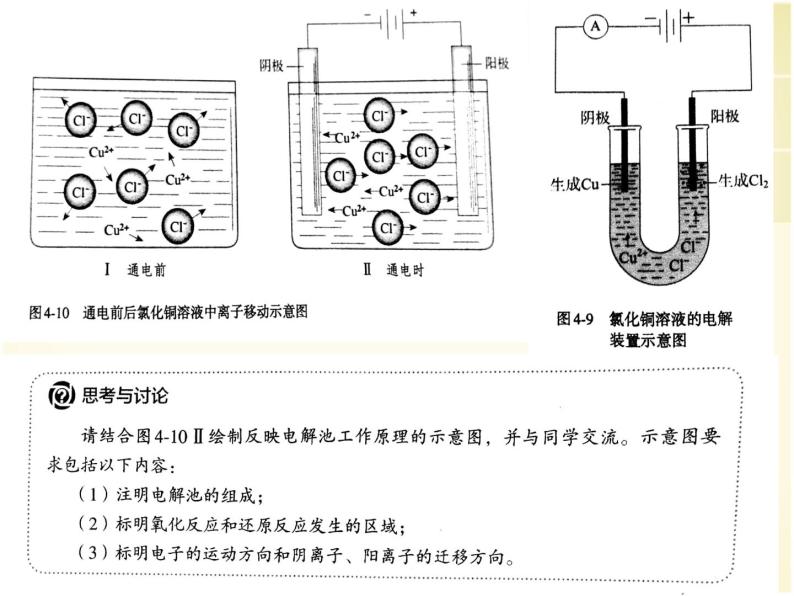
展开现象:通电后不久可以看到,与直流电源负极相连的石墨棒上逐渐覆盖一层红色的铜,与直流电源正极相连的石墨棒上有气泡产生,湿润的碘化钾淀粉试纸变成蓝色。根据气体的刺激性气味和试纸变色情况,可以推测产生的是氯气。
结论:实验表明,CuCl2溶液在通电条件下生成了Cu和Cl2
(二)电解池的定义:
将电能转变为化学能的装置,也成电解槽
两极一液一电源,氧化还原是条件
注:电解法是一种强氧化还原手段,可以完成一个不自发的氧化 还原反应
(1)阴极——负极——阳离子——还原反应
(2)阳极——正极——阴离子——氧化反应
使电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起氧化还原反应的过程。
(1)活性电极:电极自身放电即电极自身发生氧化反应, 如:Fe、Cu、Ag
(2)惰性电极:电极自身不反应,由电解质中的阴离子 发生氧化反应。如:Au、Pt、C
4、能发生氧化还原反应:
可以是自发的反应,也可以是非自发的反应
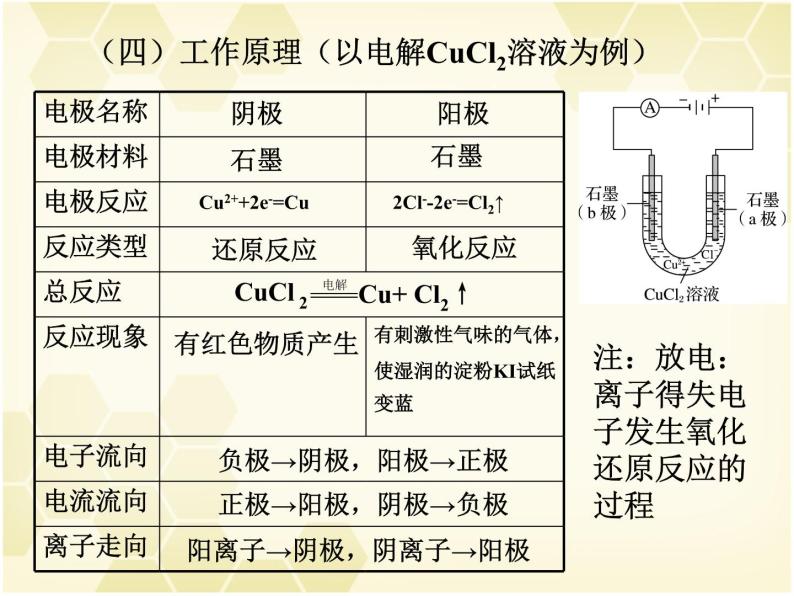
(四)工作原理(以电解CuCl2溶液为例)
Cu2++2e-=Cu
2Cl--2e-=Cl2↑
负极→阴极,阳极→正极
正极→阳极,阴极→负极
阳离子→阴极,阴离子→阳极
注:放电:离子得失电子发生氧化还原反应的过程
反应方式:M-ne-=Mn+
Au、Pt、C。溶液中的阴离子放电
常见放电顺序: 活性电极>S2- >I- >Br- >Cl- >OH- >含氧酸根>F-
Fe-2e- =Fe2+
Cu-2e- =Cu2+
2Br--2e-=Br2
2Cl--2e-=Cl2
2H2O—4e-=4H++O2↑
常见阳离子放电顺序:金属活动性顺序的倒序
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
最常见的阴极产物有Ag、Cu、H2
注:在电镀时,通过控制条件,Fe2+和Zn2+的得电子 能力会强于酸中的H+,即浓度越大,得电子能力越强
Cu2++2e-=Cu
2H++2e-=H2或2H2O+2e-=H2↑+2OH-
(六)电解方程式的书写
看电极→找离子→分阴阳→排顺序→写反应
注:(1)必须在总反应方程式的“=”上标明“通电”或“电解”
(2)只是电解质被电解,电解化学方程式中只写电解 质及电解产物,无关的不写
练习:1、阳极为铁,阴极为铜,电解质为氯化铁 2、阳极为铜,阴极为铁,电解质为氯化铜 3、阳极为银,阴极为石墨,电解质为稀盐酸 4、阴阳极均为石墨,分别写出电解质为硫酸、氢氧化钾、 硝酸钠;溴化铜;氯化钠;硫酸铜、硝酸银
(七)惰性电极电解规律
阴极: 2H2O+2e-=H2↑+2OH-
阳极:2H2O—4e-=4H++O2↑
含氧酸(H2SO4)
活泼金属含氧酸盐(KNO3、Na2SO4)
电解质电离出的阴阳离子分别在两极放电
不活泼金属含氧酸盐(CuCl2)
阴极: 2H2O+2e-=H2↑+2OH- 生成碱
阳极:电解质阴离子放电
活泼金属的无氧酸盐(NaCl、MgCl2)
生成新电解质,原电解质浓度减小
阴极:电解质阳离子放电
阳极:2H2O—4e-=4H++O2↑生成酸
不活泼金属的含氧酸盐(CuSO4、AgNO3)
加对应的氧化物(CuO)
注:常考的电解池反应式:惰性电极的情况下,电解强碱、含氧酸、活泼金属含氧酸盐(KNO3、Na2SO4)、HCl、CuCl2、NaCl、MgCl2、CuSO4、AgNO3
(八)电解池与原电池的比较
自发进行的氧化还原反应
非自发或自发进行的氧化还原反应
阳离子→正极,阴离子→负极
小结:原电池与电解池的电极反应:负阳氧,正阴还 原电池的离子走向:正向正,负向负;电解池的离子走向:阴阳相吸
(一)氯碱工业——电解饱和食盐水制烧碱和氯气
阳极:2Cl--2e-=Cl2↑
总反应:2Cl―+2H2O
2OH―+Cl2↑+H2↑
阴极:有无色、无味气泡产生,滴加酚酞——变红
阳极:有黄绿色、刺激性气味的气体产生,使湿润的淀粉KI试纸变蓝
3、阳离子交换膜的作用
(1)将电解池隔成阳极室和阴极室,只允许阳离子(Na+、H+)通过,而阻止阴离子(Cl-、OH-)和气体通过
(2)既能防止阴极产生的H2和阳极产生的Cl2相混合,而引起爆炸,又能避免Cl2和NaOH作用生成NaClO而影响烧碱的质量
工业生产中,这个反应在离子交换膜电解槽中进行。离子交换膜电解槽是由多个单元槽组成的。图4-12所示是一台离子交换膜电解槽(包括16个单元槽),图4-13是一个单元槽的电解原理示意图。
1、定义:利用电解原理在某些金属表面镀上一薄层其他金属或 合金的加工工艺
2、目的:使金属增强抗腐蚀能力,增加美观和表面硬度
阴极:待镀金属——镀件
阳极:镀层金属(通常是一些在空气或溶液里不易起变化的金属(如Cr、Ni、Ag和合金(如黄铜)))
电解质溶液:含有镀层金属阳离子的电解质溶液——电镀液
5、特点:一多一少一不变
一多:阴极上有镀层金属沉积
一少:阳极上镀层金属溶解
一不变:电解质溶液浓度不变
阳极:Cu—2e-=Cu2+
(Zn-2e-=Zn2+、Fe-2e-=Fe2+、Ni-2e-=Ni2+)
阳极泥成分:Au、Ag
阴极:Cu2++2e-=Cu
(电解质溶液浓度减小,因为mCu(溶解)< mCu(析出))
1、金属冶炼的本质:使矿石中的金属离子获得电子变成金属单质的过程。
2、特点:电解是最强有力的氧化还原手段
3、适用范围:制取活泼金属单质。 如:Na、Ca、Mg、Al等
4、实例:电解熔融NaCl制备单质Na
阴极:Na++e-=Na
阳极:2Cl-—2e-=Cl2↑
总反应:2NaCl(熔融)
5、常见金属的冶炼方法:
答:1.电镀前,如果将铜片与直流电源的负极相连,铁制镀件与直流电源的正极相连,通电后,铁制镀件逐渐溶解,铜片上附着新生成的铜,电镀液蓝色逐渐变浅。阳极反应为:Fe-2e-=Fe2+,阴极反应为:Cu2++2e-=Cu。
高中化学人教版 (2019)选择性必修1第二节 电解池备课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第二节 电解池备课课件ppt,共22页。PPT课件主要包含了第六组电解NaCl,电解原理的应用,电镀铜,电解熔融氯化钠制钠,电解池小结等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第三节 电解池备课课件ppt: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第三节 电解池备课课件ppt,共21页。PPT课件主要包含了有关电解,☆分析,实验分析,牢记放电顺序,巩固练习等内容,欢迎下载使用。
化学选修4 化学反应原理第三节 电解池说课课件ppt: 这是一份化学选修4 化学反应原理第三节 电解池说课课件ppt,共60页。PPT课件主要包含了有关电解,巩固练习,第四章电化学基础,电解原理的应用,精制食盐水,铜的电解精炼,电化学专题3\4,拓展练习,金属的电化学腐蚀,吸氧腐蚀等内容,欢迎下载使用。













