





人教版 (五四制)八年级全册第六单元 碳和碳的氧化物综合与测试复习课件ppt
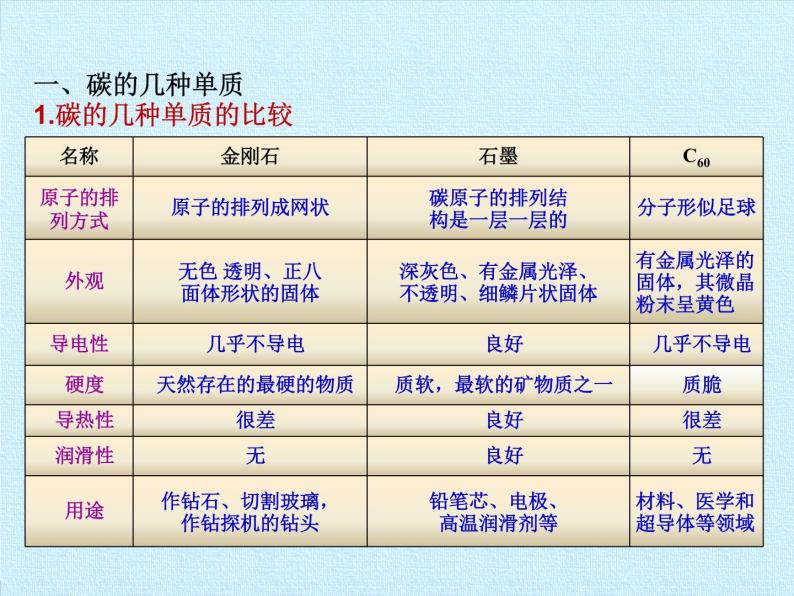
展开一、碳的几种单质1.碳的几种单质的比较
碳的不同单质它们物理性质不同的原因:碳原子的排列方式不同,即结构不同,体现了:
物质的组成结构 物质的性质 物质的用途
碳的单质除了金刚石、石墨和C60,还有无定形碳,如木炭、活性炭、焦炭、炭黑等物质结构与石墨类似,由于木炭和活性炭均具有疏松多孔的结构,因此他们具有较强的吸附能力,可以吸附毒气、色素以及有异味的物质等,可做吸附剂。因此,木炭和活性炭在制糖工业、食品工业、防毒面具制作等方面有重要的作用。
【练习1】继“分子足球”C60之后,科学家又发现另一种“分子足球”N60。一定条件下N60中积累的巨大能量会在一瞬间释放出来,是未来的火箭燃料,N60属于( )A.金属单质 B.非金属单质 C.化合物 D.混合物
碳的各种单质在常温下化学性质不活泼。如果温度升高,碳的活动性大大增强,表现出可燃性和还原性。
C + O2 CO2
2C + O2 2CO
2.碳与某些氧化物的反应
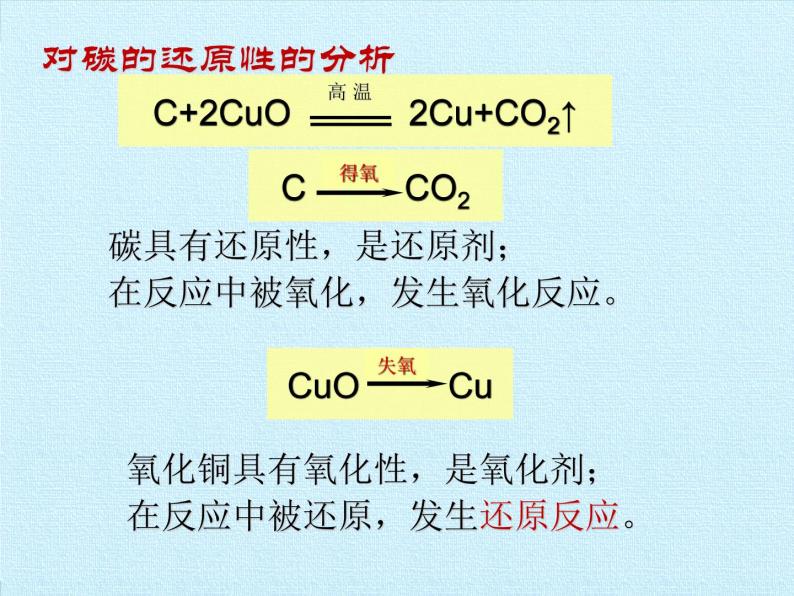
C+ 2CuO 2Cu + CO2↑
高温下碳能跟某些氧化物反应,夺取其中的氧元素,使这些氧化物失去氧而发生还原反应,如:
3C + 2Fe2O3 4Fe + 3CO2↑
CO2 + C 2CO
C CO2
CuO Cu
碳具有还原性,是还原剂;在反应中被氧化,发生氧化反应。
氧化铜具有氧化性,是氧化剂;在反应中被还原,发生还原反应。
【练习2】我国的黑白山水画用的墨汁主要成分为炭黑的微粒,用这种墨汁画的图画千百年都不易褪色,这是因为墨汁中的碳( )A.具有氧化性 B.具有还原性 C.具有吸附性D.常温下化学性质稳定
三、二氧化碳制取的研究1.实验室制取气体的一般思路和方法:(1)确定制取气体的化学反应原理;(2)确定制取气体时应采用的实验装置,包括发生装置和收集装置;(3)确定如何验证制得的气体就是所要制取的气体。
确定制取气体的化学反应原理
设计实验室制取气体的装置
●确定气体, 应考虑的因素
●确定气体, 应考虑的因素
实验室制取二氧化碳的反应原理
CaCO3+2HCl=CaCl2+H2CO3
H2CO3 =H2O+CO2↑
CaCO3+2HCl=CaCl2+
用这种方法制二氧化碳优点是:反应物易找且价廉,反应速度适中易控制。
,主要成分是碳酸钙(CaCO3 )】
注意:酸是用稀盐酸而不能用浓盐酸或硫酸。
硫酸与碳酸钙反应后产生的硫酸钙微溶于水,会阻止硫酸与碳酸钙进一步发生反应,反应无法彻底进行。
CaCO3+H2SO4=CaSO4+ H2O+CO2↑
现象:开始反应时有气泡,一会儿就无气泡产生。
浓盐酸具有挥发性使制得的气体不纯。
实验室制取二氧化碳装置
注意:1、长颈漏斗一定要插入液面以下。2、不能用普通漏斗代替长颈漏斗,因为普通漏斗颈太短,产生的二氧化碳气体会从漏斗处逸出。长颈漏斗下端管口必须在液面以下才能达到密封的效果。
可用注射器、分液漏斗代替长颈漏斗,其优点是:通过控制滴加液体的速度来控制反应速度,也可控制液体量的多少。
用启普发生器制取气体的优点:可以使制备气体的反应随时发生,随时停止。
适用范围:固(块状或大颗粒)液常温型气体的制取。
验满方法:用燃烧着的木条放在集气瓶口。若燃烧着的木条熄灭,证明二氧化碳已经收集满,若未熄灭,则还未收集满。
检验:用澄清的石灰水检验
操作步骤:①按实验要求装配好仪器。②检查装置的气密性。③加入块状大理石或石灰石。④从长颈漏斗中加入稀盐酸。⑤用澄清的石灰水检验生成的气体。⑥收集气体并验满。
收集好的二氧化碳要用玻璃片盖住正放在桌上。
实验室制取氧气、二氧化碳比较
【例1】只用C、CO、CuO、CaCO3、稀盐酸五种物质,进行单一或两两反应,可写出生成物中有CO2的化学方程式有( ),其中适合实验室制取二氧化碳的有( ) A.1个 B.2个 C.3个 D.4个
C+ 2CuO 高温 2Cu + CO2↑
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
CaCO3 高温 CaO + CO2↑
CO+ CuO 加热 Cu + CO2
【练习3】老师从实验桌上拿出两瓶常用的但标签已经模糊不清的试剂, 分别是固体和液体,他取少量试剂在试管中混合,立即产生一种无色气体。我们对此气体展开了一系列探究:(1)①此气体是什么物质?验证它的实验方案如下:
②我想制取该气体, 发生装置将选取下图中的 (填序号, 以下同),收集装置选取 。
③如果用右图所示装置收集我猜想的气体,我认为气体应从 端(填“a”或“b”)导入。
(2)我猜想无色气体还可能是另外一种气体,产生它的其中一个化学方程式是: ;收集装置可采用上图中的 (填序号)。
能溶于水(1体积水溶解约1体积CO2)
难溶于水(1体积水溶解约0.02体积CO)
CO与CO2的物理性质比较
CO与CO2的化学性质比较
CO2+H2O=H2CO3
Ca(OH)2+CO2=CaCO3↓+H2O
不能燃烧,也不能支持燃烧
不能供给人和动物呼吸,但无毒
CO+CuO == Cu+CO2
2CO + O2 = 2CO2(放热、蓝色火焰)
C、CO、H2化学性质的比较
C+O2 CO22C+O2 2CO
2CO+O2 2CO2
2H2+O2 2H2O
C+2CuO 2Cu+CO2↑
CO+CuO Cu+CO2
H2+CuO Cu+H2O
①二氧化碳不支持燃烧,不能燃烧,密度比空气大,可用它来灭火。②干冰(固态的CO2)升华时吸收大量热,可用它做致冷剂或用于人工降雨。“干冰”还可以做食品速冻保鲜剂。③生产碳酸饮料、啤酒、汽水等都需要二氧化碳。④工业制纯碱和尿素。⑤植物光合作用。⑥在现代化仓库里常充入二氧化碳,防止粮食虫蛀和蔬菜腐烂,延长保存期。贮藏粮食、水果、蔬菜,用二氧化碳贮藏的食品由于缺氧和二氧化碳本身的抑制作用,可有效地防止食品中细菌、霉菌、虫子生长,避免变质和有害健康的过氧化物产生,并能保鲜和维持食品原有的风味和营养成分。
二氧化碳(CO2)的用途
一氧化碳(CO)的用途
根据一氧化碳具有可燃性和还原性,一氧化碳可作燃料和冶炼金属。
防止温室效应进一步增强的措施:①各国严格执行有关限制二氧化碳排放的政府和国际规定。②采取措施控制二氧化碳的排放量,如减少使用化石燃料,更多地使用太阳能、风能、地热能等清洁能源;促进节能减排产品和技术的进一步开发和普及,提高能源的生产效率和使用效率;大力植树造林,严禁乱砍乱伐森林;采用物理或化学方法,人工吸收二氧化碳。③传播“低碳”理念,倡导“低碳”生活。
能产生温室效应的气体有:CO2、O3、CH4、氟氯代烷。
【练习4】下列物质中,前者是单质,后者是化合物的一组是( )A.C60——金刚石B.C60——碳酸钙C.石墨——石灰水 D.冰——干冰【练习5】下列二氧化碳的用途,既跟它的物理性质有关,又跟它的化学性质有关的是( )A.用来灭火B.制干冰C.制纯碱D.制化肥
【例2】将CO2、CO、O2、N2的混合气体依次通过澄清石灰水,灼热的CuO, 灼热的铜网,充分反应冷却至室温,最后剩余的气体是 ( ) A.N2B.CO2和N2 C.O2和N2 D.CO2和CO
CO2、CO、O2、N2
① 2C+O2 2CO
② C+O2 CO2
③ 2CO+O2 2CO2 CO+CuO Cu+CO2
④ CO2+C 2CO
⑤ Ca(OH)2+ CO2=CaCO3 ↓+H2O
⑥ CaCO3+2HCl= CaCl2+H2O+CO2↑
⑦ H2O+CO2=H2CO3
⑧ H2CO3=H2O+CO2↑
CO2 +C 2CO
【例3】向CaCO3和Na2CO3的混合物90g中加入足量盐酸使之完全反应,产生二氧化碳的质量为m,则m的取值范围为 <m< (计算结果保留两位小数)
解析:设90g CaCO3与足量盐酸完全反应,产生二氧化碳的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
4490g x
设90g Na2CO3与足量盐酸完全反应,产生二氧化碳的质量为y。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 4490g y
所以m的取值范围为:37.36g<m<39.60g。
37.36g 39.60g
【练习6】5.6g不纯的铁片与足量的稀盐酸反应放出0.21gH2,则原铁片中含有的金属杂质可能为( )(提示:Fe+2HCl=FeCl2+H2↑, Zn+2HCl=ZnCl2+H2↑,Mg+2HCl=MgCl2+H2↑, 铜与稀盐酸不反应)A、Zn B、Mg C、Cu
解析: 设5.6g纯铁与足量的稀盐酸反应放出H2的质量为x。
Fe + 2HCl = FeCl2 + H2↑ 25.6g x=0.2g
设5.6g锌与足量的稀盐酸反应放出H2的质量为y。
Zn + 2HCl = ZnCl2 + H2↑ 25.6g y=0.17g
设5.6g镁与足量的稀盐酸反应放出H2的质量为z。
Mg+ 2HCl = MgCl2 + H2↑ 25.6g z=0.47g
5.6g铜与足量的稀盐酸反应放出H2的质量为0。
∵ 0.2g<0.21g<0.47g,
【例4】有一种石灰石样品,其中含有的杂质是二氧化硅(二氧化硅是一种不溶于水,不与酸反应,耐高温的固体)。某学生想测定该样品的纯度,他取用2g的石灰石样品,把20g稀盐酸平均分4次加入,充分反应后剩余固体的质量见下表:
(1)2g石灰石样品中,有杂质多少克? (2)石灰石样品的纯度是多少? (3)100kg这种纯度的石灰石煅烧后,可得到固体多少千克?
解:(1)第3次和第4次剩余固体的质量均为0.3g,所以杂质二氧化硅的质量为0.3g。
【提示:碳酸钙(CaCO3)与盐酸反应生成的氯化钙(CaCl2)能溶于水】
(2)石灰石样品的纯度为
(3)100kg这种纯度的石灰石中含碳酸钙(CaCO3)的质量为:
100Kg×85%=85Kg
设煅烧后生成氧化钙的质量为x。
,杂质的质量为:100Kg-85Kg=15Kg
CaCO3 CaO+CO2↑
煅烧后可得到固体的质量为:47.6Kg+15kg=62.6Kg
答:2g石灰石样品中有杂质0.3克,石灰石样品的纯度是85%,100kg这种纯度的石灰石煅烧后,可得到固体62.6Kg。
【拓展提升1】有一不纯的石灰石样品,经分析知道它含9%的碳,则该样品里碳酸钙(CaCO3)的质量分数为( ) A.9% B.12% C.25% D.75%
解析:取石灰石样品1g,
1gx 9%=0.09g
样品中碳酸钙(CaCO3)的质量为
样品里碳酸钙(CaCO3)的质量分数为
碳酸钙(CaCO3)中碳元素的质量分数为
【拓展提升2】将CO2通入澄清石灰水中,有白色沉淀生成,若通入过量的CO2,白色沉淀将溶解。其反应方程式为: Ca(OH)2+CO2=CaCO3↓+H2O CaCO3+CO2+H2O=Ca(HCO3)2 当CO2持续不断地通入澄清石灰水中时,沉淀质量的变化符合下列图像中的( )
【提示:CaCO3不溶于水,Ca(HCO3)2能溶于水】
【拓展提升3】将CO和CO2的混合气体2.4g,通过足量的灼热的CuO后,得到CO2的质量为3.2g,原混合气体中CO和CO2的质量比是多少?
CO+=CuO Cu+CO2
解:原混合气体中CO2的质量为x。
28 44
2.4g-x 3.2g-x
原混合气体中CO和CO2的质量比为
(2.4g-1g):1g=7:5
答:原混合气体中CO和CO2的质量比为7:5。
【拓展提升4】将一定质量的碳酸钙和铜粉置于一敞口容器中,加热煅烧使其完全反应。若反应前后容器内固体质量不变,则容器中铜和碳酸钙的质量比是( )(Cu-64 Ca-40 C-12 O-16)A.11:14 B.20:14 C.44:25 D.16:25
解析:加热煅烧置于敞口容器中碳酸钙和铜粉,碳酸钙会发生分解反应产生二氧化碳(CO2)会导致固体质量减少,铜粉会与空气中的氧气发生化合反应生成氧化铜会导致固体质量增加,反应前后容器内固体质量不变,说明碳酸钙分解产生的二氧化碳(CO2)与铜粉化合的氧气质量相等,设二者的质量均为a。
CaCO3 CaO+ CO2↑
2Cu + O2 2CuO
44
128 32
【拓展提升5】炭和碳酸钙的混合物在空气中受强热后,碳酸钙完全分解、炭完全氧化,如果生成二氧化碳的总质量等于原混合物的总质量,则原混合物中碳的质量分数为多少?
解:混合物在空气中受强热发生以下反应
设生成二氧化碳(CO2)的总质量为a,则
质量为a的CO2中碳元素的质量为
则原混合物中碳的质量分数为
原混合物的总质量也为a。
答:原混合物中碳的质量分数为27.3%。
C+O2 CO2
又因为生成二氧化碳( CO2 )的总质量等于原混合物的总质量。
由发生的化学反应可知,原混合物中碳的质量等于生成二氧化碳( CO2 )中碳的质量。
解:参加反应的CuO中氧元素的质量为12g-10g=2g
参加反应的CuO的质量为
未反应的CuO的质量为12g-10g=2g
10g残渣中含有2gCuO和8gCu
残渣中的2gCuO中铜元素的质量为
10g残渣中铜元素的质量分数
答:残渣中铜元素的质量分数为96%。
【拓展提升6】将盛有12g氧化铜(CuO)的试管,通一会氢气后加热,当试管内残渣为10g时,这10g残渣中铜元素的质量分数?(相对原子质量:Cu-64;O-16)
解:参加反应的CuO的质量为x。
CuO + H2 H2O + Cu
80 64
△2=12g-10g=2g
△1=80-64=16
【拓展提升6】将盛有12g氧化铜(CuO)的试管,通一会氢气后加热,当试管内残渣为10g时,这10g残渣中铜元素的质量分数是多少?(相对原子质量: Cu-64;O-16)
解:12gCuO中铜元素的质量为
10g残渣中铜元素的质量分数为
10g残渣中铜元素的质量与12gCuO中铜元素的质量相等,故10g残渣中铜元素的质量为9.6g。
【拓展提升7】高温加热10g碳酸钙,一段时间后停止加热,测得剩余固体中钙元素的质量分数为50%。(1)若10g碳酸钙全部分解可产生多少克氧化钙?(2)实际反应生成的二氧化碳是多少克?
解:(1)设若10g碳酸钙全部分解产生氧化钙的质量为x。
CaCO3 CaO+ CO2↑
5610g x
(2)10gCaCO3中钙元素的质量为:
高温加热后剩余固体质量为
根据质量守恒定律,实际生成二氧化碳质量为
答:10g碳酸钙全部分解可产生5.6克氧化钙;实际反应生成的二氧化碳是2克。
人教版中考化学复习第六单元碳和碳的氧化物教学课件: 这是一份人教版中考化学复习第六单元碳和碳的氧化物教学课件,共52页。PPT课件主要包含了不活泼,撤导管,熄灭酒精灯,冷凝水倒流使试管炸裂,黑色粉末逐渐变红色,红色粉末逐渐变黑色,血红蛋白,支持燃烧,澄清石灰水变浑浊,Na2CO3+H2O等内容,欢迎下载使用。
人教版中考化学复习第六单元碳和碳的氧化物练习课件: 这是一份人教版中考化学复习第六单元碳和碳的氧化物练习课件,共35页。PPT课件主要包含了一团棉花,均匀连续,把带火星的木条伸入,分液漏斗,密度比空气大,HCl,温室效应,干冰升华吸收热量,澄清石灰水,澄清石灰水变浑浊等内容,欢迎下载使用。
人教版中考化学复习第六单元碳和碳的氧化物教学课件: 这是一份人教版中考化学复习第六单元碳和碳的氧化物教学课件,共52页。PPT课件主要包含了不活泼,撤导管,熄灭酒精灯,冷凝水倒流使试管炸裂,黑色粉末逐渐变红色,红色粉末逐渐变黑色,血红蛋白,支持燃烧,澄清石灰水变浑浊,Na2CO3+H2O等内容,欢迎下载使用。













