




高中化学人教版 (新课标)选修2 化学与技术课题2 海水的综合利用课文配套ppt课件
展开学习目标1.了解海水中盐的开发和利用,掌握食盐资源的利用。2.了解海水提溴的重要步骤。
一、海水中盐的开发和利用海水中含有多种盐类,以_________最多,约占海水中盐类总量的_______,还含有________、________等。1.海水制盐(1)海水制盐以_______法(盐田法)为主,主要原理是太阳照射后,水分蒸发,各种盐分达到_______浓度时,依次以固体形式析出。
(2)盐田必须符合的条件:①有平坦空旷的海滩,潮汐落差大;②气候干燥、多风、少雨;③远离江河入海口。(3)盐田一般分为________、________、________三部分。(4)海水制盐要经过风吹、日晒逐渐蒸发浓缩,达到饱和后会析出_________,分离后所得的母液叫______,可综合利用制得副产品_______、_______等。(卤水中主要含氯化镁、碘化钾、溴化钾。)
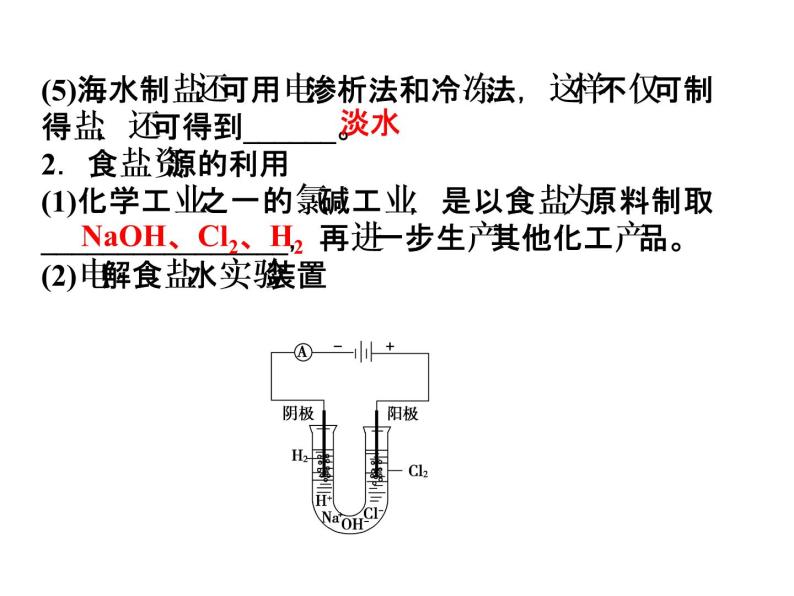
(5)海水制盐还可用电渗析法和冷冻法,这样不仅可制得盐,还可得到______。2.食盐资源的利用(1)化学工业之一的氯碱工业,是以食盐为原料制取________________,再进一步生产其他化工产品。(2)电解食盐水实验装置
NaOH、Cl2、H2
用电解饱和食盐溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品的工业,称为氯碱工业。氯化钠溶液中存在着 Na+、Cl-、OH-、H+四种离子,通直流电后,______________向阳极移动,____________向阴极移动。(3)阳极反应式 _____________________,阴极反应式 _____________________。
2Cl--2e-===Cl2↑
2H++2e-===H2↑
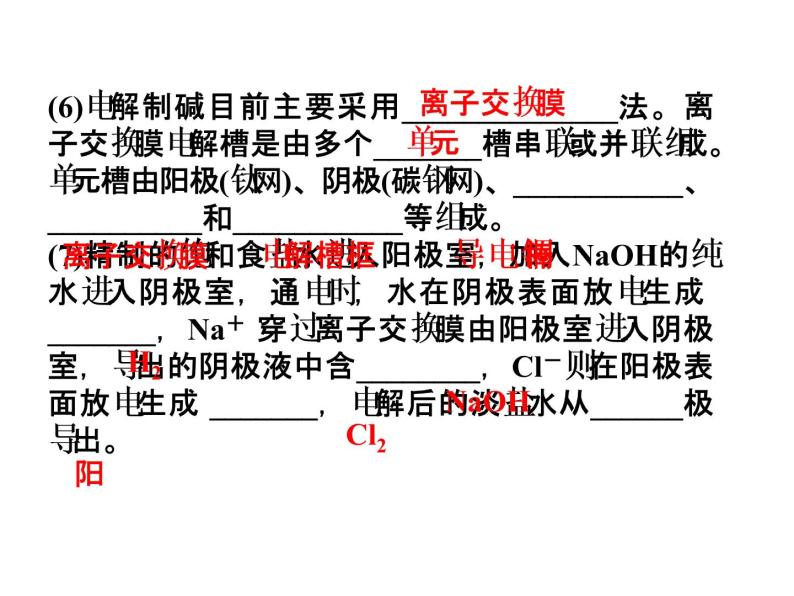
(6)电解制碱目前主要采用______________法。离子交换膜电解槽是由多个_______槽串联或并联组成。单元槽由阳极(钛网)、阴极(碳钢网)、___________、__________和___________等组成。(7)精制的饱和食盐水进入阳极室,加入NaOH的纯水进入阴极室,通电时,水在阴极表面放电生成 _______,Na+ 穿过离子交换膜由阳极室进入阴极室,导出的阴极液中含________,Cl-则在阳极表面放电生成 _______,电解后的淡盐水从______极导出。
3.离子交换膜法制烧碱二、海水提溴从海水中提溴约占世界溴年产量的1/3,常用的方法叫_________,即用氯气氧化海水中的Br-,使其变成Br2,然后用空气或水蒸气吹出。1.氯化(1)用氯气置换溴离子的反应式为 ___________________________。(2)氯气置换溴离子之前,要使海水_____化,使pH=______。
Cl2+2Br-===Br2+2Cl-
2.吹出当Br-被氧化成 Br2后,用______将其吹出,也可用_________与溴一起蒸出。3.吸收用二氧化硫做还原剂回收溴,再用氯气将其氧化得到溴产品的反应方程式为Br2+SO2+2H2O===2HBr+H2SO4,Cl2+2Br-===2Cl-+Br2。溴的用途:工业上:燃料的防爆剂;胶卷的感光材料;农业上:杀虫剂;医药上:红药水、镇静剂。氧化性:Cl2>Br2>I2。
Cl2+2Br-===Br2+2Cl-;Cl2+2I-===I2+2Cl-;Br2+2I-===I2+2Br-。三、海水提镁1.海水中镁的总储量约为___________t,目前世界生产的镁_________来自海水。2.工业生产中提取镁的主要方法和主要反应方程式:
四、从海水中提取重水2. 氘的原子核内有一个_______和一个_______,所以叫_______,化学符号是_____。重水可作原子反应堆的___________和_________________。3.热核聚变指的是两个氘核在高温高压下融合成氦核,同时放出大量能量的过程。4.海水中含重水约_______________。
2.0×1014 t
一、海水中盐的开发和利用1.海水制盐(1)利用蒸发法,从海水中主要获得氯化钠,及氯化镁、氯化钾等副产品。(2)电渗析法、冷冻法不仅能制得盐,同时还可得到淡水。
2.氯碱工业——食盐资源的利用离子交换膜法电解食盐水:(1)设备:离子交换膜电解槽。离子交换膜只允许Na+通过。(2)原理:化学方程式为
2.主要反应原理:Cl2+2Br-===Br2+2Cl-。3.溴的吸收富集(1)纯碱吸收法:海水中的溴离子被氧化为溴单质后,用热空气或水蒸气吹出,通过Na2CO3溶液使溴富集后,再将得到的溶液用稀硫酸酸化,用有机溶剂萃取溴单质。发生反应:3Br2+3Na2CO3===5NaBr+NaBrO3+3CO2↑5NaBr+NaBrO3+3H2SO4===3Br2+3Na2SO4+3H2O(2)SO2吸收法:用空气吹出的溴和大量的空气混合在一起,不易分离,用还原剂SO2吸收后,再用氯气氧化HBr即得到溴单质。
特别提醒:①通氯气前要将海水酸化,pH为3.5时,氯气的氧化效果最好。②用空气或H2O(g)将溴吹出,而不用CCl4萃取,因后者工艺复杂,设备投资大,经济效益低且对环境污染严重。
三、海水提取镁工艺流程和化学平衡原理的应用1.生产步骤(1)加熟石灰 (2)过滤 (3)加盐酸 (4)浓缩结晶脱水干燥 (5)熔融电解2.工艺流程
4.工业生产中平衡原理的应用(1)沉淀溶解平衡原理的应用①向海水中加入沉淀剂Ca(OH)2,由于c(OH-)增大,Mg(OH)2的溶解度小于Ca(OH)2,则最大程度地将Mg2+转化为Mg(OH)2沉淀。②向Mg(OH)2沉淀中加入盐酸,使沉淀溶解平衡右移。(2)水解平衡原理的应用在MgCl2·6H2O脱水变为MgCl2时,由于MgCl2+2H2OMg(OH)2+2HCl水解平衡的存在,在HCl气体环境中,增大c(HCl),抑制了MgCl2的水解,避免了Mg(OH)2的生成。
特别提醒:①为提高反应中Mg2+的浓度,将海水浓缩或用提取食盐后的盐卤。②电解熔融MgCl2生成的Cl2可用于制盐酸,循环使用,节省成本。③所得Mg(OH)2沉淀中含有的CaSO4杂质在加盐酸前应除去,以保证MgCl2的纯度。
1.海水淡化通过从海水中提取淡水或从海水中分离出盐分,都可以达到淡化海水的目的。海水淡化的方法已有十几种,主要的有蒸馏法、电渗析法、离子交换法等。其中蒸馏法的历史最久,技术和工艺也比较完善,是目前海水淡化的主要方法,其蒸馏原理如图所示。
2.海水中镁、钾、溴、碘等化工产品元素的提取海水中含有的各种元素的特点:种类多,总储量大,富集程度低。因此,从海水中提取物质需要解决物质的富集问题。如海水中溴的提取流程:(1)用蒸馏法将海水浓缩,用硫酸将浓缩的海水酸化。(2)向酸化的海水中通入适量的氯气,使溴离子转化为溴单质。2NaBr+Cl2===Br2+2NaCl
(3)向含溴单质的水溶液中通入空气和水蒸气,将溴单质吹入盛有二氧化硫溶液的吸收塔内以达到富集的目的。Br2+SO2+2H2O===2HBr+H2SO4(4)向吸收塔内的溶液中通入适量的氯气。2HBr+Cl2===2HCl+Br2(5)用四氯化碳(或苯)萃取吸收塔内溶液中的溴单质。海带中碘的提取原理:海带中的碘元素主要以I-的形式存在,提取时用适当的氧化剂将其氧化成I2,再萃取出来。
如用H2O2做氧化剂,反应的离子方程式是:2I-+H2O2+2H+===I2+2H2O实验先将干海带灼烧去除有机物,剩余物用H2O2、H2SO4处理,使得I-被氧化成I2。3.海水资源的综合利用(1)从海水中提取淡水——海水淡化;(2)直接利用海水进行循环冷却;(3)海水制盐;
(4)从海水中提取镁、钾、溴、碘等化工产品;(5)从海水中获取铀和重水作为核能开发的重要原料;(6)从海水中获取其他物质和能量。
请回答氯碱工业中的如下问题:(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_____________(要求计算表达式和结果);
①图中X、Y分别是________、________(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小________;②分别写出燃料电池B中正极、负极上发生的电极反应正极:____________________;负极:________________;③这样设计的主要节(电)能之处在于(写出2处)____________________、_________________。
变式训练 工业上对海水资源综合开发利用的部分工艺流程如图所示:
(1)电解饱和食盐水常用离子膜电解槽和隔膜电解槽,离子膜和隔膜均允许通过的分子或离子是________。电解槽中的阳极材料为________。(2)本工艺流程中先后制得Br2、CaSO4和Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4顺序制备?________(填“是”或“否”)。原因是_______________________________________。(3)溴单质在四氯化碳中的溶解度比在水中大得多,四氯化碳与水不互溶, 故可用于萃取溴,但在上述工艺中却不用四氯化碳,原因是________________________________________。
解析:(1)电解饱和食盐水用的是阳离子交换膜,而在食盐水中的阳离子只有H+和Na+,电解时,H+在阴极上生成氢气,Na+在外加电场作用下向阴极运动,所以通过离子膜和隔膜的是Na+。由于阳极上发生氧化反应,是溶液中Cl-放电生成Cl2,所以必须用惰性电极,工业上一般用钛(表面涂有钌氧化物),也可以用石墨电极。(2)在该流程开始时向苦卤中加入硫酸,因CaSO4微溶于水,先形成CaSO4沉淀而将Ca2+除去。若先制取Mg(OH)2,加入的石灰水会有部分与硫酸反应生成CaSO4而使制得的Mg(OH)2不纯净。
(3)CCl4是一种易挥发、有毒的液体,所以此流程中不用CCl4萃取的方法,而是利用溴的挥发性,向得到的含溴水的海水中吹入热空气,使溴挥发出来。与萃取相比,该方法简单、实用、经济、无污染。答案:(1)阳离子(或Na+) 钛(或石墨)(2)否 如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,产品不纯(3)四氯化碳萃取法工艺复杂、设备投资大,经济效益低、环境污染严重
人教版 (新课标)选修2 化学与技术课题2 海水的综合利用教学课件ppt: 这是一份人教版 (新课标)选修2 化学与技术课题2 海水的综合利用教学课件ppt,共26页。PPT课件主要包含了海洋里有什么,海水中主要元素含量,海水综合利用,氯碱工业,实验室如何提取溴,海水提溴,海水提镁,从海水提取重水,锰结核,海洋能源的利用等内容,欢迎下载使用。
高中人教版 (新课标)课题2 海水的综合利用图文ppt课件: 这是一份高中人教版 (新课标)课题2 海水的综合利用图文ppt课件,共34页。PPT课件主要包含了第一课时,氯碱工业,第二课时,海水提溴,海水提镁等内容,欢迎下载使用。
人教版 (新课标)选修2 化学与技术课题2 海水的综合利用教课ppt课件: 这是一份人教版 (新课标)选修2 化学与技术课题2 海水的综合利用教课ppt课件,共14页。PPT课件主要包含了电解饱和食盐水,氯碱工业,工业上如何制碘,灼烧海带变成灰烬,从海水中提取重水,硫化氢-水双温交换法,电解法氧化法等内容,欢迎下载使用。













