




高中化学人教版 (新课标)选修2 化学与技术第一单元 走进化学工业课题1 化工生产过程中的基本问题集体备课ppt课件
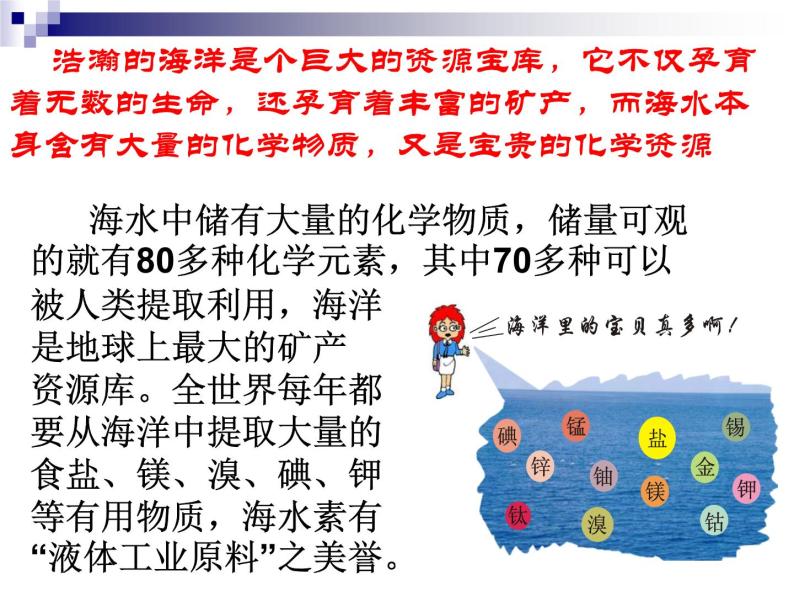
展开浩瀚的海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还孕育着丰富的矿产,而海水本身含有大量的化学物质,又是宝贵的化学资源
海水中储有大量的化学物质,储量可观的就有80多种化学元素,其中70多种可以被人类提取利用,海洋是地球上最大的矿产资源库。全世界每年都要从海洋中提取大量的食盐、镁、溴、碘、钾等有用物质,海水素有“液体工业原料”之美誉。
一、海水中盐的开发和利用(一)海水制盐
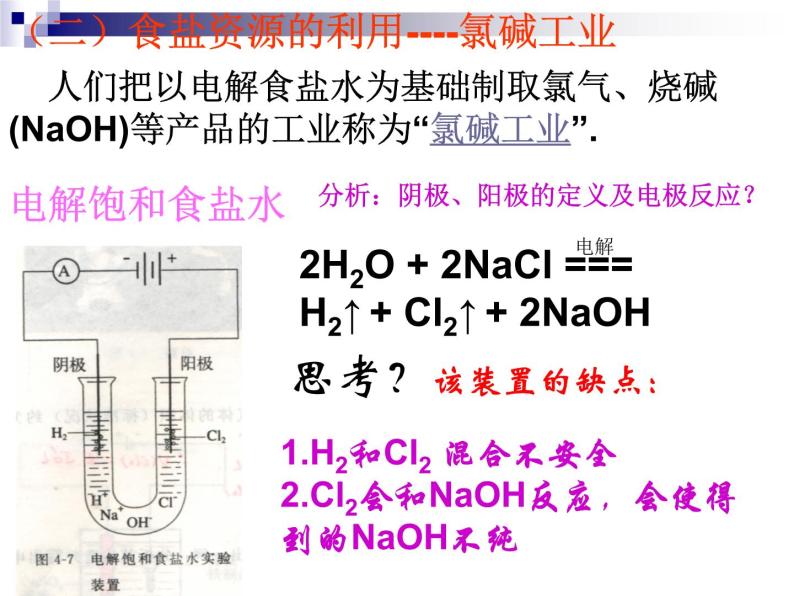
(二)食盐资源的利用----氯碱工业
人们把以电解食盐水为基础制取氯气、烧碱(NaOH)等产品的工业称为“氯碱工业”.
2H2O + 2NaCl === H2↑ + Cl2↑ + 2NaOH
1.H2和Cl2 混合不安全2.Cl2会和NaOH反应,会使得到的NaOH不纯
分析:阴极、阳极的定义及电极反应?
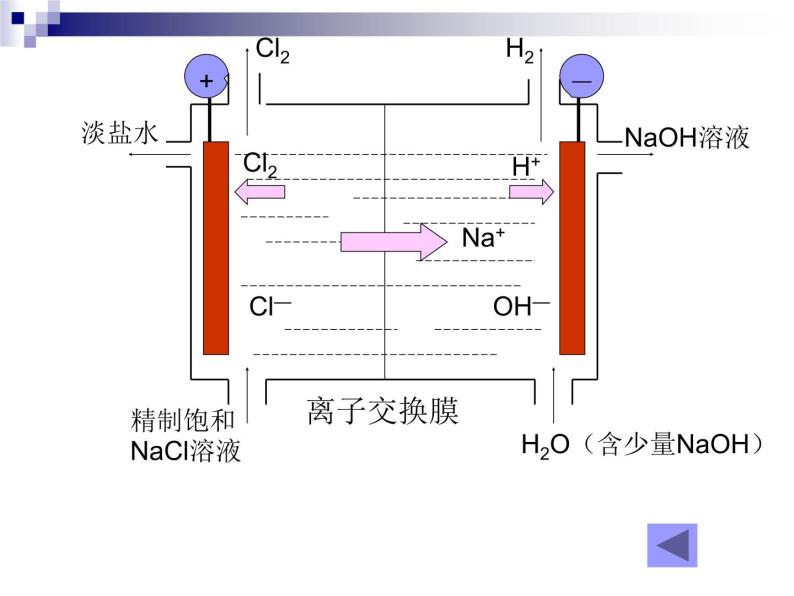
电解饱和食盐水反应原理
阴极: 阳极:总反应:
2H+ + 2e- = H2↑
2Cl- -2e- = Cl2↑
H2O(含少量NaOH)
1、生产的主体设备:离子交换膜电解槽简单构造:阳极、阴极、离子交换膜、电解槽框和导电铜棒等 2、添加原料阳极室:精制的饱和食盐水阴极室:添加纯水(加一定量的NaOH溶液) 3、离子交换膜的作用: (1)防止Cl2和H2混合而引起爆炸 (2)避免Cl2与NaOH反应生成NaClO,影响NaOH的产量。
1.用什么方法除去泥沙?2.用什么试剂除去Ca2+、Mg2+、Fe3+、SO42-?3.所用试剂只有过量才能除净这些杂质,你能设计一个合理的顺序逐一除杂吗?
粗盐水(Ca2+、Mg2+、Fe3+、SO42-、Na+ 、 Cl-)
Ba2+ + SO42- =BaSO4↓
Na+ 、 Ca2+、Mg2+、Fe3+、Ba2+ 、 Cl-
Ca2+ + CO32- = CaCO3↓Ba2+ + CO32- = BaCO3↓
CaCO3↓BaCO3↓
(少Mg2+、Fe3+) Ca2+ Na+ 、 Ba2+ 、 Cl- 、 OH-
Mg2+ + 2OH- = Mg(OH)2↓Fe3+ + 3OH- = Fe(OH)3↓
Fe(OH)3↓Mg(OH)2↓
(少Mg2+、Ca2+、 Fe3+) )Na+、Cl-、OH-、CO32-
造纸、玻璃、肥皂、纺织等
Cl2 +2Br - =Br2+ 2Cl -
1.氯化:通过Cl2将海水中溴氧化成单质溴(pH=3.5)
2.吹出:用热空气或水蒸气将溴吹出
1、如何实现Mg2+ 的富集和分离?
可以加入一种试剂使Mg2+ 沉淀
2、是不是直接往海水中加沉淀剂?
不是,因为海水中的Mg2+ 的浓度很小,直接加沉淀剂不利于Mg2+的沉淀,而且会增大沉淀剂的用量,我们可以先将海水浓缩,再加沉淀剂。
3、从综合角度考虑选用哪种试剂作沉淀剂好?
1、从沉淀效果看,澄清石灰水比氢氧化钠效果 差得多,如何解决这一矛盾?
3、如何制得无水MgCl2 ?
4、由MgCl2 到Mg究竟用还原法还是电解法好?
先加盐酸反应,再浓缩得MgCl2·6H2O晶体,然后再将MgCl2·6H2O晶体在HCl气氛中加热脱水即可得无水MgCl2。
由于镁本身比较活泼,用还原法比较困难,工业上常使用电解熔融的氯化镁得到镁。
2、请设计由Mg(OH)2到Mg的可能途径。
思考:电解产生的Cl2怎么处理?
Mg(OH)2+2HCl=MgCl2+2H2O
镁的化学性质:探究一:取一小段除去氧化膜的镁条投入盛有一定量稀盐酸的试管中;现象: 结论或化学方程式:
镁条逐渐溶解,有大量气体产生
Mg+2HCl=MgCl2+H2↑
探究二:取一小段除去氧化膜的镁条投入滴有酚酞的水中;现象: 结论或化学方程式:
有气体产生,滴有酚酞的水溶液变红(但比钠与水反应缓和得多)
探究三:取一根除去氧化膜的镁条,点燃后插入充满CO2的的集气瓶中。现象: 结论或化学方程式:
燃着的镁条在CO2中继续燃烧,发出耀眼的白光,生成白色固体,在集气瓶的内壁有黑色固体附着
四、Mg条与氮气的反应
1、海水中含的MgCl2是Mg的重要来源之一,从海水中提镁,可按如下步骤进行:(1)将贝壳制成石灰乳(2)在引入的海水中加入石灰乳、沉降、过滤、洗涤沉淀物(3)将沉淀物与盐酸反应、结晶、过滤、干燥产物(4)将产物熔融后电解关于提取镁,下列说法中不正确的是( )A、此法的优点之一是原料来源丰富B、进行(1)、(2)、(3)步的目的是从海水中提取MgCl2 C、第四步会产生氯气 D、以上过程中涉及到复分解反应、化合反应和置换反应
2、分析镁在空气中的燃烧产物,肯定不存在的物质是 ( )A、C B、 MgO C、MgCO3 D、Mg3N2
四、从海水中提取重水
海水中溶存着80多种元素,其中不少元素可以提取利用,具有重要的开发价值。据计算,每立方千米海水中含有3 750×104 t固体物质,其中除氯化钠约3 000×104 t外,镁约450×104 t,钾、溴、碘、钍、钼、铀等元素也不少。
中 国 海 域
镁在海水中含量很高,仅次于氯和钠,居第3位。
溴的浓度较高,平均为67×10-3 mL/L,地球上99%以上的溴都储存在海水里,故溴有“海洋元素”之称。
碘在海水中的浓度只有0.06× 10-6,属于微量元素。
钾在海水中的总量为500 ×1012 t以上。海水中所含钾的储量远远超过钾盐矿物储量。
铀海水中的总量非常可观,达45×108 t,相当于陆地储量的4500倍。
一吨海水中所含重水的核聚变反应,可释放出相当于256t石油燃烧所产生的能量。
重水核聚变反应可释放出相当能量,海水中约有200×108 t重水。
氘是氢的同位素。氘的原子核除包含一个质子外,比氢多了一个中子。氘的化学性质与氢一样,但是一个氘原子比一个氢原子重一倍,所以叫做“重氢”。氢二氧一化合成水,重氢和氧化合成的水叫做“重水”。重水主要赋存于海水中,总量可达250亿吨。重水现在已是核反应堆运行不可缺少的辅助材料,也是制取氘的原料。
制备重水有两种方法, 蒸馏法:这种方法只能得到纯度为92%的重水; 电解法:可得99.7%的重水,但消耗电能特别大。 化学法:
人教版 (新课标)选修2 化学与技术课题2 海水的综合利用教学课件ppt: 这是一份人教版 (新课标)选修2 化学与技术课题2 海水的综合利用教学课件ppt,共26页。PPT课件主要包含了海洋里有什么,海水中主要元素含量,海水综合利用,氯碱工业,实验室如何提取溴,海水提溴,海水提镁,从海水提取重水,锰结核,海洋能源的利用等内容,欢迎下载使用。
高中化学人教版 (新课标)选修2 化学与技术课题2 海水的综合利用课文配套ppt课件: 这是一份高中化学人教版 (新课标)选修2 化学与技术课题2 海水的综合利用课文配套ppt课件,共41页。PPT课件主要包含了氯化钠,氯化镁,硫酸钙,贮水池,蒸发池,结晶池,食盐晶体,氯化钾,OH-,离子交换膜等内容,欢迎下载使用。
高中人教版 (新课标)课题2 海水的综合利用图文ppt课件: 这是一份高中人教版 (新课标)课题2 海水的综合利用图文ppt课件,共34页。PPT课件主要包含了第一课时,氯碱工业,第二课时,海水提溴,海水提镁等内容,欢迎下载使用。













