
化学专题六 物质的溶解综合与测试课堂检测
展开一、单选题
1.如图是 a、b 两种固体物质(不含结晶水)的溶解度曲线图,下列说法不正确的是
A.t2℃时,a 物质的溶解度为 50g
B.t1℃时,a、b 两种物质的溶解度相等
C.b 物质的溶解度随温度的升高而增大
D.降低温度可使 a 的不饱和溶液变为饱和溶液
2.下列关于溶液的说法正确的是
A.溶液都是无色的B.均一的、稳定的液体叫做溶液
C.溶质一定是固体D.冰水混合物不属于溶液
3.下列物质溶于水能形成溶液的是
A.牛奶B.酒精C.汽油D.面粉
4.如图是a、b两种固体物质的溶解度曲线,下列说法中错误的是
A.t℃时,a、b溶解度相等
B.分别将a、b的饱和溶液从t℃降温至0℃,析出的质量a比b多
C.在t℃时,a、b的饱和溶液中溶质质量分数相等
D.当a中含有少量b时,可以用降温结晶法提纯a
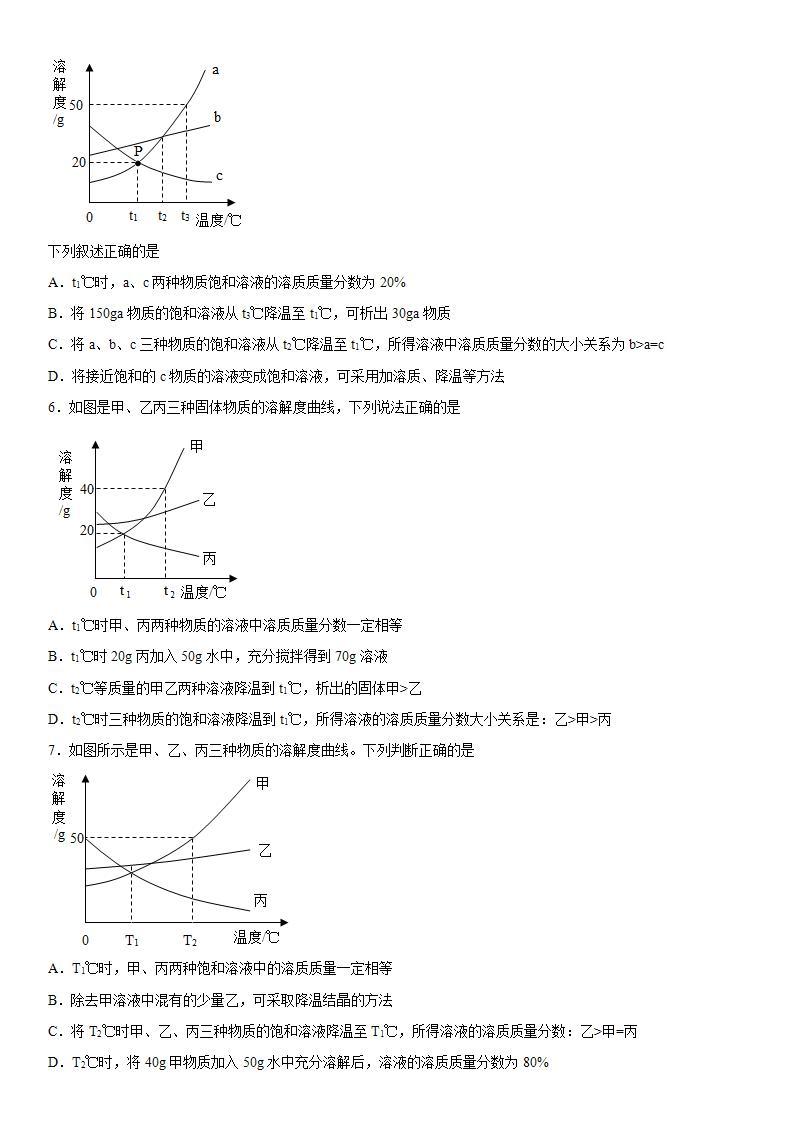
5.如图是a、b、c三种固体物质(不含结晶水)的溶解度曲线。
下列叙述正确的是
A.t1℃时,a、c两种物质饱和溶液的溶质质量分数为20%
B.将150ga物质的饱和溶液从t3℃降温至t1℃,可析出30ga物质
C.将a、b、c三种物质的饱和溶液从t2℃降温至t1℃,所得溶液中溶质质量分数的大小关系为b>a=c
D.将接近饱和的c物质的溶液变成饱和溶液,可采用加溶质、降温等方法
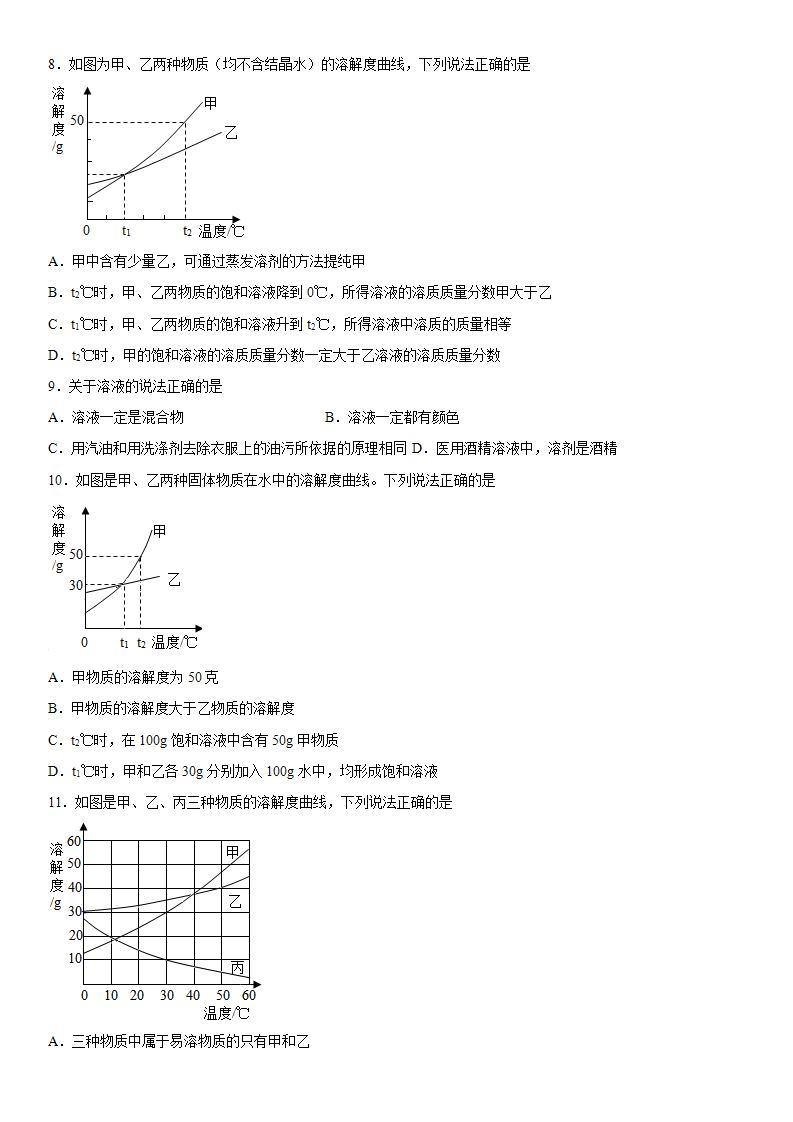
6.如图是甲、乙丙三种固体物质的溶解度曲线,下列说法正确的是
A.t1℃时甲、丙两种物质的溶液中溶质质量分数一定相等
B.t1℃时20g丙加入50g水中,充分搅拌得到70g溶液
C.t2℃等质量的甲乙两种溶液降温到t1℃,析出的固体甲>乙
D.t2℃时三种物质的饱和溶液降温到t1℃,所得溶液的溶质质量分数大小关系是:乙>甲>丙
7.如图所示是甲、乙、丙三种物质的溶解度曲线。下列判断正确的是
A.T1℃时,甲、丙两种饱和溶液中的溶质质量一定相等
B.除去甲溶液中混有的少量乙,可采取降温结晶的方法
C.将T2℃时甲、乙、丙三种物质的饱和溶液降温至T1℃,所得溶液的溶质质量分数:乙>甲=丙
D.T2℃时,将40g甲物质加入50g水中充分溶解后,溶液的溶质质量分数为80%
8.如图为甲、乙两种物质(均不含结晶水)的溶解度曲线,下列说法正确的是
A.甲中含有少量乙,可通过蒸发溶剂的方法提纯甲
B.t2℃时,甲、乙两物质的饱和溶液降到0℃,所得溶液的溶质质量分数甲大于乙
C.t1℃时,甲、乙两物质的饱和溶液升到t2℃,所得溶液中溶质的质量相等
D.t2℃时,甲的饱和溶液的溶质质量分数一定大于乙溶液的溶质质量分数
9.关于溶液的说法正确的是
A.溶液一定是混合物B.溶液一定都有颜色
C.用汽油和用洗涤剂去除衣服上的油污所依据的原理相同D.医用酒精溶液中,溶剂是酒精
10.如图是甲、乙两种固体物质在水中的溶解度曲线。下列说法正确的是
A.甲物质的溶解度为50克
B.甲物质的溶解度大于乙物质的溶解度
C.t2℃时,在100g饱和溶液中含有50g甲物质
D.t1℃时,甲和乙各30g分别加入100g水中,均形成饱和溶液
11.如图是甲、乙、丙三种物质的溶解度曲线,下列说法正确的是
A.三种物质中属于易溶物质的只有甲和乙
B.将甲、乙的饱和溶液由50℃降温至10℃,甲析出的晶体比乙多
C.30℃时,把10g丙溶解在200g水中,得到丙的饱和溶液
D.50℃时,蒸发溶质质量分数为15%的乙溶液,蒸发一段时间后才会析出晶体
12.常温下,对100mL氯化钠饱和溶液进行图示实验。下列分析错误的是
A.实验1后,甲、乙中溶液的溶质质量分数相等
B.实验2后,甲中溶液一定是氢化钠的不饱和溶液
C.实验2后,氯化钠的溶解度乙中比甲中大
D.实验2后,甲、乙中溶液所含溶质质量相等
13.如图是甲、乙两种物质的溶解度曲线。下列说法正确的是
A.t1℃时,甲、乙溶液的溶质质量分数相等
B.t2℃时,分别溶解等质量的甲、乙物质达到饱和,需水量少的是乙
C.t2℃时,甲、乙的饱和溶液降温t1℃,甲溶液中析出的固体质量比乙溶液中的多
D.t2℃时,往60g乙的饱和溶液中加入40g水可得到10%的溶液
二、填空题
14.如图是a、b、c三种固体物质的溶解度曲线,请回答下列问题:
(1)t1℃时a物质的溶解度是______g,t2℃时将50g b物质跟100g水混合,充分溶解后,所得溶液是______(填“饱和”、“不饱和”)溶液;
(2)将c物质从其溶液中结晶析出的常用方法是______;
(3)分别将t2℃时a、b、c三种物质饱和溶液降温到t1℃后(不考虑溶剂的质量变化),三种溶液中溶质的质量分数由小到大的顺序是______(填物质代号)。
15.水是一种重要的物质。
(1)用水可以获得氢气。请写出一个由水生成氢气的化学方程式______。
(2)水还可以用于鉴别物质。水鉴别氯化钠和硝酸铵依据的是______。
(3)水是最常见的溶剂,下列溶液用水作溶剂的是______(填字母序号);
a.生理盐水 b.碘酒 c.葡萄糖溶液
16.溶液对人类的生产、生活具有重要的意义。如图为X、Y两种固体物质的溶解度曲线,回答下列问题:
(1)使Y从其饱和溶液中析出采取的方法是______(填“升温”或“降温”);
(2)t1℃时,50克X的饱和溶液,升高温度到t2℃时,溶液中溶质的质量分数______(填“变大”“变小”或“不变”)。
17.如图是甲、乙两种固体物质的溶解度曲线。相同质量的甲、乙饱和溶液分别从t2℃降温到t1℃时,析出固体的质量为甲___________乙(填“>”、“<”或“=”);t3℃时,将75g甲的饱和溶液与25g水混合后所得溶液中溶质的质量分数为___________。
18.如图所示是ab、c三种固体物质(均不含结晶水)的溶解度曲线。
(1)P点表示的含义为______。
(2)在t3℃时,将30g物质a加入50g水中,充分溶解后所得到的溶液质量为______g。
(3)t1℃时,将a、c的饱和溶液分别升温至t3℃,所得溶液中溶质质量分数的大小关系是a______(选填“>”、“=”或“<”)c。
(4)分别将t3℃时a、b的饱和溶液降温至t2℃,析出晶体的质量大小关系为______(填字母)。
A.a>bB.a
(1)杯子中的现象是______,其反应的化学方程式为______。
(2)产生该现象的原因______。
三、简答题
20.化学与生活
①喝了汽水以后,常常会打嗝,说明气体溶解度与_____有关。
②炒菜时油锅中的油不慎着火,可采取的灭火方法是_____或放入较多蔬菜。
21.为探究中和反应放热的问题进行了下列实验,回答有关问题。
(1)实验甲,依据 ___ 现象证明该反应是放热的。
(2)实验乙,饱和石灰水出现了浑浊现象,其原因是 ___ 。
(3)丙图为向10mL 10%的NaOH溶液中逐滴加入10%的稀硫酸的溶液温度数据,本实验用10%的NaOH溶液而未用NaOH固体的理由是 ___ 。
22.如图甲是A、B、C三种固体物质的溶解度曲线图
(1)甲图中,t2℃时,A、B、C三种物质中,溶解度最大的是______。P点所表示的含义为______;
(2)t2℃时,将B物质的不饱和溶液转变成饱和溶液可采取的方法是______;
(3)t2℃时,A固体中混有的少量B,要提纯A物质,采取实验步骤:加水溶解,蒸发浓缩,______,然后过滤、洗涤、干燥;
(4)若物质A在VC时的溶解度为60克,t1℃时的溶解度为20克,把100克质量分数为10%的A溶液从t2℃降温到t1℃,此时A溶液的质量分数为______;
(5)如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5mL稀盐酸,立即产生大量的气泡,同时烧杯中出现浑浊,则X可能为A、B、C三种固体物质中的哪一种?______。原因是______。
23.(1)把分别盛有热水和冷水的两个玻璃杯放在地上,小心的向杯中各滴入一滴红墨水,不要搅动,观察到的现象是_______________________该实验说明____________。
(2)碘酒是一种常见的外科消毒剂,其溶剂是________。
24.a、b、c三种固体物质的溶解度曲线如图所示:
(1)P点表示___________________________________ 。
(2)将接近饱和的c溶液变为饱和溶液,可采用____________的方法(写出一种)。
(3)t2℃时,将30g的a物质加入到50g水中充分搅拌,所得溶液质量为___________g。
25.20℃时,在盛有 100g 水的烧杯中加入 70g 硝酸钾,充分溶解后,逐渐升温(不 考虑水蒸发的影响),测定不同温度时剩余固体质量。测定结果记录如下表:
(1)20℃时,硝酸钾的溶解度为_____。
(2)30℃时,所得溶液是硝酸钾的_____(填“饱和”或“不饱和”)溶液,该溶液中硝酸钾 的质量分数为_____(结果保留到 0.1%)
(3)温度从 50℃升高到 60℃过程中,溶液中硝酸钾的质量分数_____(填字母)。
A 变大 B 变小 C 不变 D 无法判断
(4)将 60℃时接近饱和的硝酸钾溶液变成饱和溶液,下列方法能达到目的有_____(填字母)。
a 升温 b 降温 c 加适量硝酸钾 d 加适量水 e 恒温蒸发水
(5)某同学要配制 50g 溶质质量分数为 15%的硝酸钾溶液,实验时发现硝酸钾已结块,为 了较快地溶解,合理的方法有_____(填字母)。
A将硝酸钾研碎 B 用热水溶解 C 多加一些水 D 用玻璃棒搅拌
溶液温度/℃
20
30
40
50
60
剩余固体质量/g
38.4
24.2
6.1
0
0
参考答案
1.C
【详解】
A、从图中可以看到,在温度为t2℃时,对应a曲线的纵坐标为50,即t2℃时,a 物质的溶解度为 50g,故A正确;
B、从图中可以看出,t1℃时,正好对应着a、b两曲线的交点,即t1℃时,a、b 两种物质的溶解度相等,故B正确;
C、在图像中,b曲线随着温度的升高呈下降趋势,即b 物质的溶解度随温度的升高而减小,故C错误;
D、在图像中,a曲线随着温度的升高呈上升趋势,即温度越高,溶解度越大,温度越低,溶解度越小,所以降低温度可使 a 的不饱和溶液变为饱和溶液,故D正确;
故选C。
2.D
【分析】
根据溶液的定义和特征进行推测。
【详解】
A、溶液不一定是无色的,例如硫酸铜溶液是蓝色的,A错误;
B、溶液具有均一性和稳定性,但均一的、稳定的液体不一定是溶液,例如水,B错误;
C、溶质不一定是固体,也可以是液体或气体,例如酒精的水溶液,稀盐酸等,C错误;
D、冰水混合物是纯净物,不属于溶液,D正确。
故选D。
【点睛】
溶液是指一种或几种物质分散到另一种物质里形成的均一的、稳定的混合物。溶液具有均一性和稳定性。
3.B
【详解】
A、牛奶与水形成不均一、不稳定的混合物,属于乳浊液,故A错误;
B、酒精易溶于水,形成均一、稳定的混合物,属于溶液,故B正确;
C、汽油不溶于水,与水混合形成乳浊液,故C错误;
D、面粉不溶于水,与水混合形成悬浊液,故D错误。
故选B。
4.B
【详解】
A、通过分析溶解度曲线可知,t℃时,a、b溶解度曲线相交,两者溶解度相等,正确;
B、a、b的饱和溶液的质量不能确定,所以分别将a、b的饱和溶液从t℃降温至0℃,析出的质量不能确定,错误;
C、在t℃时,a、b物质的溶解度相等,所以a、b的饱和溶液中溶质质量分数相等,正确;
D、a物质的溶解度受温度变化影响较大,所以当a中含有少量b时,可以用降温结晶法提纯a,正确。
故选B。
5.B
【详解】
A、t1℃时,a、c两种物质饱和溶液的溶质分数=,故选项错误;
B、t3℃时,a物质的溶解度是50g,150ga物质的饱和溶液中含有溶质质量50g,溶剂质量100g,从t3℃降温至t1℃,溶解度为20g,所以可析出50g-20g=30ga物质,故选项正确;
C、t1℃时,b物质的溶解度最大,a、c物质的溶解度相等,降低温度,a、b物质的溶解度减小,会析出晶体,c物质的溶解度增大,不会析出晶体,应该按照t2℃时的溶解度计算,所以将a、b、c三种物质的饱和溶液从t2℃降温至t1℃,所得溶液中溶质质量分数的大小关系为b>a>c,故选项错误;
D、将接近饱和的c物质的溶液变成饱和溶液,可采用加溶质、升温等方法,故选项错误。
故选:B。
6.D
【详解】
A、t1℃时甲和丙的溶解度相等,所以t1℃时甲、丙饱和溶液中所含溶质质量分数才相等,说法错误;
B、t1℃时,丙的溶解度是20g,即在该温度下,100g水中最多溶解20g,所以50g水中最多溶解10g,t1℃时20g丙加入50g水中,充分搅拌得到10g+50g=60g溶液,说法错误;
C、t2℃等质量的甲乙两种溶液降温到t1℃,因不明确溶液的状态,不能比较析出的固体质量,说法错误;
D、t2℃时三种物质的饱和溶液降温到t1℃,甲和乙的溶解度都变小,都会析出晶体,因为降温后乙的溶解度大于甲的溶解度,所以降温后乙的溶质质量分数大于甲的溶质质量分数,降温后丙的溶解度变大,变为不饱和溶液,溶质质量分数不变,因为t1℃甲的溶解度大于t2℃时丙的溶解度,所以t2℃时三种物质的饱和溶液降温到t1℃,所得溶液中溶质质量分数乙>甲>丙,说法正确。
故选:D。
7.B
【详解】
A、没有说明甲、丙两种饱和溶液是否相等,无法比较溶质质量是否相等,故A错误;
B、甲的溶解度随着温度升高变化比较大,乙的溶解度随着温度升高变化比较小,除去甲溶液中混有的少量乙,可采取降温结晶的方法,故B正确;
C、将T2℃时甲、乙、丙三种物质的饱和溶液降温至T1℃,甲、乙有晶体析出,溶液仍然为饱和溶液,T1℃是乙的溶解度大于甲,故溶质质量分数:乙>甲;而丙降温后,溶解度变大,溶液由饱和变为不饱和,但是溶质质量分数不变,故丙为最小,故C错误;
D、T2℃时,甲的溶解度是50g,则100g水最多溶解50g甲,那么50g水就最多溶解25g甲,溶液的溶质质量分数为,故D错误;
故选B。
8.D
【详解】
A、甲物质的溶解度受温度变化影响较大,乙物质的溶解度受温度变化影响较小,所以甲中含有少量乙,可通过降温结晶的方法提纯甲,故A错误;
B、t2℃时,甲、乙两物质的饱和溶液降到0℃,甲、乙物质的溶解度都减小,但是0℃时,乙物质的溶解度大于甲物质,所以所得溶液的溶质质量分数甲小于乙,故B错误;
C、t1℃时,甲、乙两物质的饱和溶液的质量不能确定,所以升到t2℃,所得溶液中溶质的质量也不能确定,故C错误;
D、t2℃时,甲物质的溶解度大于乙物质的溶解度,所以甲的饱和溶液的溶质质量分数一定大于乙溶液的溶质质量分数,故D正确。
故选:D。
9.A
【分析】
应熟悉溶液是一种均一稳定的混合物,在不改变条件时,溶液的组成和浓度都不会发生变化,要与悬浊液和乳浊液区分,知道溶液的特点,溶质和溶剂的判断方法。
【详解】
A、溶液是一种均一稳定的混合物,故选项正确;
B、溶液不一定都有颜色,如氯化钠溶液是无色的,故选项错误;
C、汽油去除衣服上的油污是用的原理是相似相容,用洗涤剂去除衣服上的油污是利用洗涤剂的乳化原理,故选项错误;
D、医用酒精溶液中,溶剂是水,溶质是酒精,故选项错误。
故选:A。
【点睛】
10.D
【详解】
A..不知道温度范围,不能确定物质的溶解度大小,该选项说法不正确;
B.不知道温度范围,不能比较物质的溶解度大小,该选项说法不正确;
C.t2℃时甲的溶解度是50g,在150g饱和溶液中含有50g 甲物质,该选项说法不正确;
D.t1℃时甲和乙的溶解度都是30g,甲和乙各30g分别加入100g水中,均形成饱和溶液,该选项说法正确。
故选:D。
【点睛】
11.D
【详解】
A、易溶是指在室温(20℃左右)100g水中溶解度大于10g,由图可以看出,在20℃时,甲乙丙三种物质的溶解度都大于10g,故选项错误;
B、因为不确定甲乙饱和溶液的质量,因此不能确定甲乙饱和溶液降温后析出晶体的质量,故选项错误;
C、30℃时,丙物质的溶解度是10g,所以把10g丙溶解在200g水中,得到的是丙的不饱和溶液,故选项错误;
D、50℃时,乙的饱和溶液的质量分数为,因此蒸发溶质质量分数为5%的乙溶液还需要一段时间才会析出晶体,故选项正确。
故选:D。
12.C
【详解】
A、溶液具有均一性,故实验1后,甲、乙中溶液的溶质质量分数相等,故A分析正确,不符合题意;
B、实验2后,因为加入了溶剂,甲中溶液为氯化钠的不饱和溶液正确,故B分析正确,不符合题意;
C、固体物质溶解度与温度有关,实验2是常温下向氯化钠的饱和溶液中继续加入5g氯化钠,温度不变,溶解度不变,故C分析错误,符合题意;
D、实验2后,甲、乙中溶液所含溶质质量相等正确,因为甲中加水,溶质不变,乙中的加溶质不再溶解,因此甲、乙中溶液所含溶质质量相等,故D分析正确,不符合题意。
故选:C。
13.D
【详解】
A、未说明溶液的状态,而在t1℃时,饱和状态的甲、乙溶液中溶质的质量分数相等,A错误;
B、t2℃时,甲比乙的溶解度大,故等质量的甲和乙恰好溶解时需水量少的是甲,B错误;
C、t2℃时,未说明溶液的质量,故结晶析出的固体无法比较,C错误;
D、t2℃时,60g乙的饱和溶液中溶质的质量为:,则加入40g水后所得溶液溶质的质量分数为: ,D正确;
故选D。
14.20 饱和 蒸发溶剂 c a b
【详解】
(1)t1℃时a物质的溶解度是20g,t2℃时b物质溶解度小于50g,将50g b物质跟100g水混合,充分溶解后,所得溶液是饱和溶液;
(2)c的溶解度随着温度升高而减小,将c物质从其溶液中结晶析出的常用方法是蒸发溶剂;
(3)分别将t2℃时a、b、c三种物质饱和溶液降温到t1℃后(不考虑溶剂的质量变化),a、b仍然是饱和溶液,b的溶解度大于a,因此b的质量分数大于a,由于a在t1℃时的溶解度大于c在t3℃时的溶解度,因此a的质量分数大于c,三种溶液中溶质的质量分数由小到大的顺序是c、a、b。
15. 氯化钠和硝酸铵溶于水后温度变化不同(或氯化钠溶于水温度变化不大,硝酸铵溶于水吸热会导致溶液温度降低等。合理即可) ac
【详解】
(1)水通电生成氢气和氧气,化学方程式为,故填:。
(2)水鉴别氯化钠和硝酸铵依据的是氯化钠溶于水不吸热、不放热,硝酸铵溶于水吸热温度降低,氯化钠和硝酸铵溶于水后温度变化不同,故填:氯化钠和硝酸铵溶于水后温度变化不同。
(3)生理盐水溶质是氯化钠,溶剂是水,碘酒溶质是碘,溶剂是酒精,葡萄糖溶液溶质是葡萄糖,溶剂是水,故选:ac。
16.升温 不变
【详解】
(1)Y的溶解度随温度的升高而减小,故使Y从其饱和溶液中析出采取的方法是升温;
(2)t1℃时,50克X的饱和溶液,升高温度到t2℃,升温后,X的溶解度增加,变为不饱和溶液,溶质和溶剂质量不变,溶质质量分数不变。
17.> 25%
【详解】
相同质量的甲、乙饱和溶液分别从t2℃降温到t1℃时,甲的溶解度受温度影响大,乙的溶解度受温度影响小,故析出固体的质量为甲>乙;
t3℃时,75g甲的饱和溶液中溶质质量为:,该温度下,将75g甲的饱和溶液与25g水混合后所得溶液中溶质的质量分数为: 。
18.
(1)t1℃时,a、c两物质的溶解度相等
(2)75
(3)>
(4)D
【分析】
(1)
P点,a、c溶解度曲线相交,表示的含义为t1℃时,a、c两物质的溶解度相等,故填:t1℃时,a、c两物质的溶解度相等。
(2)
在t3℃时,a溶解度50g,将30g物质a加入50g水中能溶解,充分溶解后所得到的溶液质量为50g+25g=75g,故填:75。
(3)
t1℃时,a、c溶解度相等,饱和溶液溶质质量分数相等,饱和溶液分别升温至t3℃,c溶解度减小,溶质结晶析出,溶质质量分数减小,a溶解度变大,溶质质量分数不变,所得溶液中溶质质量分数的大小关系是a>c,故填:>。
(4)
分别将t3℃时a、b的饱和溶液降温至t2℃,因为溶液质量不确定,析出晶体的质量大小无法比较,故选D。
19.澄清石灰水变浑浊 Ca(OH)2+CO2=CaCO3↓+H2O 生石灰与水反应放热,碳酸受热易分解产生较多二氧化碳,二氧化碳与澄清石灰水反应产生难溶于水碳酸钙
【详解】
(1)雪碧饮料中的碳酸受热易分解产生二氧化碳,经过导管进入石灰水中,氢氧化钙和二氧化碳反应产生碳酸钙沉淀和水,则澄清石灰水变浑浊;方程式:;
(2)生石灰与水反应放出大量的热,碳酸受热易分解产生较多二氧化碳,CO2的溶解度随温度的升高而减小,二氧化碳与澄清石灰水反应产生难溶于水碳酸钙。
20.温度 用锅盖盖灭
【解析】
【详解】
①喝了汽水以后,常常会打嗝,是由于胃内的温度高二氧化碳的溶解度变小而导致的,说明气体溶解度与温度;
②炒菜时油锅中的油不慎着火,用锅盖盖灭的目的是隔绝氧气,放入较多的蔬菜能降低温度。
21.烧杯内导管口处有气泡冒出 氢氧化钠与硫酸反应放热,使饱和石灰水温度升高,造成溶解度随温度升高而减小的氢氧化钙固体析出 排除NaOH固体溶于水放热的干扰。
【详解】
(1)若实验甲中的反应是放热反应,容器内的气压会因温度升高而增大,烧杯内导管口处有气泡冒出。实验甲,依据烧杯内导管口处有气泡冒出现象证明该反应是放热的;
(2)实验乙,饱和石灰水出现了浑浊现象,其原因是:氢氧化钠与硫酸反应放热,使饱和石灰水温度升高,导致溶解度随温度升高而减小的部分氢氧化钙固体析出;
(3)本实验用10%的NaOH溶液而未用NaOH固体的理由:排除NaOH固体溶于水放热的干扰。
22.A 在t1℃时,B和C的溶解度相等 增加溶质或减少溶剂 降温结晶 10% C 镁与盐酸反应放热,C的溶解度随温度的升高而减小
【详解】
(1)甲图中,t2℃时,A、B、C三种物质中,溶解度最大的是A;P点所表示的含义为:在t1℃时,B和C的溶解度相等,因为P是该温度下的交点;
(2)t2℃时,将B物质的不饱和溶液转变成饱和溶液可采取的方法是:增加溶质、减少溶剂;
(3)t2℃时,A固体中混有的少量B,要提纯A物质,采取实验步骤:加水溶解,蒸发浓缩,降温结晶、然后过滤、洗涤、干燥;因为A的溶解度随温度的变化比B大;
(4)若物质A在t2℃时的溶解度为60克,t1℃时的溶解度为20克,把100克质量分数为10%的A溶液从t2℃降温到t1℃,此时A溶液的质量分数为10%,因为降温后没有固体析出,溶液中溶质的质量分数不变;
(5)如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5mL稀盐酸,立即产生大量的气泡,同时烧杯中出现浑浊,则X可能是C,因为镁与盐酸反应放热,C的溶解度随温度的升高而减小。
23.热水中红墨水扩散速度快于冷水中红墨水的扩散速度 温度越高,分子运动越快 酒精
【详解】
(1)升高温度能加速分子的运动速度;所以可以看到热水中红墨水扩散速度快于冷水中红墨水的扩散速度;
故答案为:热水中红墨水扩散速度快于冷水中红墨水的扩散速度;温度越高,分子运动越快。
(2)碘酒是单质碘溶于酒精形成的溶液,所以溶剂为酒精;
故答案为:酒精。
24.t1℃时a、c物质溶解度相等 升温或加溶质 75
【详解】
(1)P点表示在t1℃时a、c物质溶解度相等;
(2)C物质的溶解度随温度的升高而降低,故可以加入溶质或升高温度使接近饱和的c溶液变为饱和溶液;
(3)t2℃时,a物质的溶解度是50g,含义是t2℃时100g的水中最低能溶解a 物质的质量为50g,故该温度下50g的水中最低能溶解a物质的质量为25g,故将30g的a物质加入到50g水中充分搅拌,所得溶液质量为75g。
25.31.6g 饱和 31.4% C bce ABD
【详解】
(1)由表格数据可知,20℃时,硝酸钾的溶解度为70g-38.4g=31.6g;故填:31.6g;
(2)由数据可知,30℃时,仍有未溶解的晶体存在,所以所得溶液为该温度下的饱和溶液,其中溶质的质量分数为:×100%=31.4%;故填:饱和;31.4%;
(3)由表格数据可知,50℃和60℃时,晶体均已完全溶解,所以所得两种溶液中溶质的质量分数相同;故填:C;
(4)硝酸钾的溶解度随着温度的升高而增大,所以将60℃时接近饱和的硝酸钾溶液变成饱和溶液,可以采用降温、蒸发溶剂和加入硝酸钾的方法;故填:bce;
(5)将硝酸钾研碎、用热水溶解、用玻璃棒搅拌均可加快硝酸钾的溶解速率;故填:ABD。
初中化学仁爱湘教版九年级上册专题六 物质的溶解综合与测试测试题: 这是一份初中化学仁爱湘教版九年级上册专题六 物质的溶解综合与测试测试题,共18页。试卷主要包含了单选题,填空题,简答题等内容,欢迎下载使用。
仁爱湘教版专题六 物质的溶解综合与测试课后作业题: 这是一份仁爱湘教版专题六 物质的溶解综合与测试课后作业题,共18页。试卷主要包含了单选题,填空题,简答题等内容,欢迎下载使用。
初中专题六 物质的溶解综合与测试达标测试: 这是一份初中专题六 物质的溶解综合与测试达标测试,共18页。试卷主要包含了单选题,填空题,简答题等内容,欢迎下载使用。













