





高中化学鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应教学演示课件ppt
展开1.通过实验探究离子反应的本质,体会含有相同微粒的物质会发生相同的离子反应,培养宏观辨识与微观探析的化学核心素养。2.能够依据电解质在水溶液中的电离结果和微粒间的相互作用推测离子反应的发生,正确书写离子方程式,培养证据推理与模型认知的化学核心素养。3.能够运用离子反应完成常见离子的检验、物质中杂质离子的去除等任务,培养科学态度与社会责任的化学核心素养。
1.盐的溶解性口诀钾钠铵硝四盐溶,钾钠铵钡四碱溶。硫酸铅钡难溶解,钙盐银盐仅微溶。碳酸正盐溶者少,镁盐却微溶水中。盐酸盐中多数溶,银盐不溶铅微溶。2.常见的四大强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2。三大强酸:H2SO4、HCl、HNO3。3.常见的弱酸:H2CO3、HClO、CH3COOH等。常见的弱碱:NH3·H2O等。
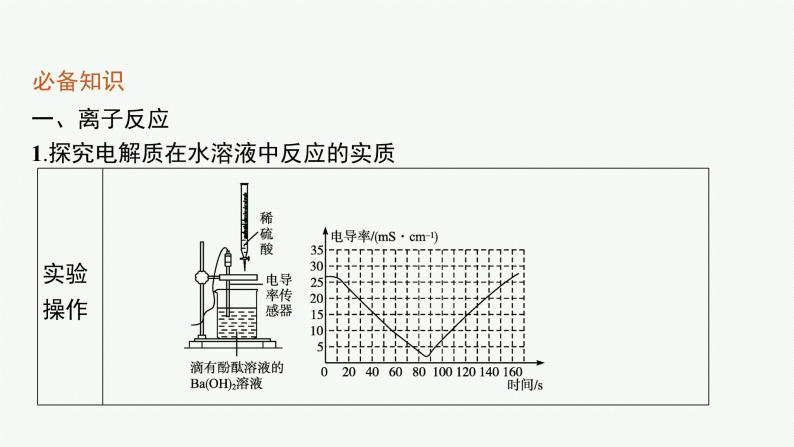
一、离子反应1.探究电解质在水溶液中反应的实质
2.定义在溶液中有离子参加的化学反应。3.实质溶液中某种或某些离子浓度降低。4.离子互换型的离子反应发生的条件生成难溶的物质、生成难电离的物质、生成挥发性的物质。
二、离子方程式1.表示离子反应可用离子方程式表示。例如,NaOH溶液与盐酸反应的离子方程式为H++OH-==H2O。2.意义不仅表示一个化学反应,还表示一类化学反应,例如S +Ba2+==BaSO4↓不仅可以表示Na2SO4和BaCl2两种溶液的反应,还表示可溶性硫酸盐(或硫酸)与可溶性钡盐在溶液中的反应。
【微思考1】离子方程式H++OH-==H2O能表示所有强酸与强碱之间发生的中和反应吗?提示 不能。H++OH-==H2O只表示酸中酸根离子与碱中阳离子之间不发生反应的强酸与强碱之间的反应,如NaOH与盐酸之间的反应等,Ba(OH)2与H2SO4之间的反应就不能用该离子方程式表示。
三、离子反应的应用1.利用离子反应可以检验某种离子是否存在
【微思考2】实验室如何检验混合溶液中的Cl-和S ?试写出相关反应的离子方程式。
写出上述实验过程中所涉及反应的离子方程式:
1.只要是生成气体的反应就是离子反应。( )2.溶液中有离子参加或生成的化学反应都属于离子反应。( )3.任何化学反应都是离子间的反应。( )4.将Na投入CuSO4溶液中,发生反应的离子方程式为2Na+Cu2+==2Na++Cu。( )
(1)如图所示,纵轴表示导电能力,横轴表示所加溶液的量:
哪条曲线表示向Ba(OH)2溶液中滴加稀硫酸?写出该过程中发生反应的离子方程式。
提示 向Ba(OH)2溶液中滴加稀硫酸,反应生成硫酸钡沉淀和极弱的电解质水,离子浓度降低,当硫酸过量时离子浓度又增大,因此导电能力先减小再增大,应该是曲线C。反应的离子方程式为2H++S +Ba2++2OH-==BaSO4↓+2H2O。
(2)所有的化学反应都能写成离子方程式吗?提示 不是。不是在溶液中进行的反应、不是自由移动的离子之间或不是生成自由移动离子的反应都不能写成离子方程式,如煅烧碳酸钙制氧化钙等。
1.离子方程式的书写步骤写化学方程式—易溶、易电离的物质拆成离子形式—删掉没反应的离子—检查是否配平。2.书写离子方程式的关键书写离子方程式的关键是物质的“拆分”是否合理。(1)强酸、强碱和大部分可溶性盐改写成离子形式。(2)弱酸、弱碱、难溶性盐、气体、单质、氧化物等都写成化学式。
3.“六看”判断离子方程式的正误(1)看是否符合反应的客观事实,如铁与稀硫酸反应。2Fe+6H+==2Fe3++3H2↑(×)Fe+2H+==Fe2++H2↑(√)(2)看是否符合拆写原则,如碳酸钙与盐酸反应。C +2H+==CO2↑+H2O(×)CaCO3+2H+==Ca2++CO2↑+H2O(√)
(3)看是否符合质量守恒,如钠与水的反应。2Na+H2O==2Na++2OH-+H2↑(×)2Na+2H2O==2Na++2OH-+H2↑(√)(4)看是否符合电荷守恒,如铝与盐酸反应。Al+2H+==Al3++H2↑(×)2Al+6H+==2Al3++3H2↑(√)
(5)看是否漏掉离子反应,如CuSO4和Ba(OH)2的反应。
(6)看是否符合阴、阳离子配比,如氢氧化钡溶液与稀硫酸反应。
例1(2020山西应县第一中学高一期中)写出下列反应的离子方程式。(1)CaCO3与醋酸反应: 。 (2)向澄清的Ca(OH)2溶液中通入过量CO2: 。 (3)向CuO中加入盐酸: 。 (4)三氯化铁溶液跟过量氨水反应: 。 (5)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性: 。
答案 (1)CaCO3+2CH3COOH==Ca2++2CH3COO-+H2O+CO2↑
解析 (1)CaCO3与醋酸反应的离子方程式为CaCO3+2CH3COOH==2CH3COO-+Ca2++H2O+CO2↑。
(2)向澄清的Ca(OH)2溶液中通入过量CO2,二氧化碳与氢氧根离子反应生成碳酸氢根离子,离子方程式为OH-+CO2==HC 。(3)氧化铜和稀盐酸反应生成氯化铜和水,离子方程式为CuO+2H+==Cu2++H2O。(4)三氯化铁溶液与氨水反应生成氢氧化铁沉淀和氯化铵,反应的离子方程式为Fe3++3NH3·H2O==Fe(OH)3↓+3N 。(5)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,反应生成硫酸钡、硫酸钠和水,反应的离子方程式为2H++S +2OH-+Ba2+==BaSO4↓+2H2O。
方法点拨离子方程式书写的特殊情况
变式训练1(2020天津一中高一期中)下列离子反应方程式正确的是( )稀盐酸与铁屑反应:2Fe+6H+==2Fe3++3H2↑碳酸镁与稀硫酸反应:MgCO3+2H+==H2O+CO2↑+Mg2+
A.①②③④B.②③④⑤ C.③④⑤⑥D.①②③⑤
查阅酸、碱和盐的溶解性表(室温),探究以下问题。(1)C 与H+(足量)、Ca2+、Na+、K+、OH-、N 中哪些离子能发生离子反应?试写出相关反应的离子方程式。
(2)某无色溶液中可能含有大量的Fe3+、Na+、Cl-、OH-吗?提示 不可能。无色溶液中不会含有大量Fe3+(棕黄色),且Fe3+与OH-因生成沉淀而不能大量共存。
(3)某溶液中加入紫色石蕊溶液显红色,则该溶液中可能含有大量的K+、C 吗?
1.离子共存的原则离子间不能发生化学反应,说明它们在同一溶液中能大量共存;离子间能发生化学反应,则它们在同一溶液中不能大量共存。
2.离子不能大量共存的三种情况(1)生成难溶或微溶物质的离子不能大量共存。
(2)能发生反应生成气体的离子不能大量共存。
(3)生成水或其他难电离物质的离子不能大量共存。
3.判断离子共存应注意的问题(1)不要忽略题干本身隐含的条件,如无色溶液中不能含有大量有颜色的离子,酸性溶液中不能大量存在与H+反应的离子,碱性溶液中不能大量存在与OH-反应的离子。(2)对于溶液中哪些离子能发生反应及反应的条件必须熟练掌握,知道哪些离子之间能发生反应,哪些离子之间不能发生反应。
例2(2020山西长治第二中学高一期中)(双选)常温下,下列各组离子在指定溶液中一定能大量共存的是( )
变式训练2(2020山西应县第一中学高一期中)在强酸性和强碱性溶液中都能大量共存的一组离子是( )
提示 不正确。如果溶液中含有Ag+,Ag+与Cl-生成AgCl白色沉淀会干扰S 的检验。
(2)检验Cl-一般要排除哪些离子的干扰?
提示 应排除C 等离子对Cl-检验的干扰。
常见离子的检验(1)氯离子(Cl-)的检验。①反应原理:Ag++Cl-==AgCl↓(白色)。
③试剂:AgNO3溶液、稀硝酸。
③试剂:稀盐酸、BaCl2溶液。④检验方法:
[注意]检验S 时一定是先加盐酸后加BaCl2溶液,不能将两种试剂的顺序颠倒,防止Ag+干扰。
②试剂及用品:NaOH溶液,湿润的红色石蕊试纸。③检验方法:
例3(2020山西大学附中高一模块诊断)对于某些常见离子的检验及结论一定正确的是( )A.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+B.加氯化钡溶液有白色沉淀产生,再加盐酸沉淀不消失,一定有SC.加入氯化钠溶液有白色沉淀产生,再加稀硝酸沉淀不消失,一定有Ag+D.加稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有C
答案 C解析 A中白色沉淀可能是碳酸钡、碳酸钙等,故无法判断原溶液存在的离子,故A错误;B中产生的沉淀可能是硫酸钡,还可能是氯化银,原溶液不一定有硫酸根离子存在,故B错误;C中产生的沉淀一定是氯化银,故原溶液中一定存在Ag+,故C正确;D中无色气体可能是二氧化碳,也可能是二氧化硫,原溶液不一定有碳酸根离子存在,故D错误。
变式训练3下列“实验结论”与“实验操作及现象”相符的一组是( )
上图为粗盐提纯的过程,提纯后的粗盐中还含有Ca2+、Mg2+、S 等杂质离子。在氯碱工业中,这些杂质不但会增加生产成本,而且会带来安全隐患,必须除去。
(1)除去杂质离子需要加入哪些试剂?加入的顺序是什么?
提示 粗盐水中含有Ca2+、Mg2+、S 等杂质离子。通常加入BaCl2、NaOH、Na2CO3溶液来除去这些离子,最后还要加入盐酸来中和。为了使杂质能除得比较干净,所加试剂一般要过量,为此要设计加入试剂的合理顺序,即要使前一过量试剂在后续除杂操作中除去。从反应原理可知,HCl必须在NaOH和Na2CO3的后面加入(确保除去过量的NaOH和Na2CO3试剂),Na2CO3必须在BaCl2的后面(确保除去过量的BaCl2试剂)。所以有三种顺序:BaCl2→NaOH→Na2CO3→HCl、BaCl2→Na2CO3→NaOH→HCl、NaOH→BaCl2→Na2CO3→HCl。最后通过蒸发结晶,过量的HCl挥发,便可获得纯净的NaCl。
(2)如何检验杂质离子是否除尽?提示 取提纯后的溶液少许置于洁净的试管中,继续加入沉淀剂,看是否有沉淀生成,若有沉淀生成,说明杂质离子未除尽。
1.分离提纯需要遵循的“四原则”“三必须”
2.除去粗盐中可溶性杂质的原理
例4(2020重庆育才中学高一期中)川菜之魂在味,然而在“七味八滋”中,盐应是百味之首。自贡市位于四川盆地南部,智慧的自贡人早在2 000年前就开始了用盐井采盐。但刚从盐井中采出的粗盐水因含有Na2SO4、MgCl2、CaCl2和泥沙等,需经过提纯才能被食用。下图展示了一种在实验室用该粗盐水制取NaCl晶体的操作流程:
请回答下列问题:(1)操作①所用到的玻璃仪器的名称是 。 (2)物质B和F的化学式分别为 、 。 (3)试剂Ⅰ和试剂Ⅱ分别为 、 。 (4)操作流程中,BaCl2溶液和Na2CO3溶液的滴加顺序 (填“可以”或“不可以”)调换,理由是 。
答案 (1)漏斗、玻璃棒、烧杯(2)BaSO4 Mg(OH)2(3)NaOH溶液 稀盐酸(4)不可以 调换后过量的Ba2+无法除去
解析 第①步除去不溶性杂质通过过滤的方法,得到含有Na2SO4、MgCl2、CaCl2的氯化钠溶液;第②步加入BaCl2溶液除去S ,故B为BaSO4;第③步加入Na2CO3溶液除去Ca2+和过量的Ba2+,所以D为CaCO3和BaCO3的混合物;第④步加入的溶液应除去Mg2+,且不引入新杂质,故试剂Ⅰ为NaOH溶液,F为Mg(OH)2;第⑤步加入的试剂应除去过量的Na2CO3溶液和NaOH溶液且不引入新杂质,故试剂Ⅱ为稀盐酸;第⑥步由氯化钠溶液得到氯化钠晶体,采用的方式为蒸发结晶。(1)由分析可知,操作①为过滤,所用到的玻璃仪器的名称是漏斗、玻璃棒、烧杯。
(2)由分析可知,B为BaSO4,F为Mg(OH)2。(3)由分析可知,试剂Ⅰ为NaOH溶液,试剂Ⅱ为稀盐酸。(4)BaCl2溶液和Na2CO3溶液的滴加顺序不能调换,加Na2CO3溶液的目的不仅仅是除去Ca2+,还可除去过量的Ba2+。
要点笔记 化学方法除杂的思路:先根据杂质特点选择除杂试剂,通常选择那些易与杂质反应生成气体或沉淀的物质,然后再根据“不能引入新的杂质”的原则,确定加试剂的顺序。
变式训练4(2020北京高一期末)(双选)为从粗食盐水中除去Ca2+、Mg2+、S 等离子,以制得精盐水。某同学设计如下方案:
以下说法正确的是( )A.A中主要有Mg(OH)2和BaSO4,也可能有一些Ca(OH)2B.②中加入过量Na2CO3溶液主要是为了除去Mg2+、Ca2+
1.(2020山西应县第一中学高一期中)下列各组物质相互混合后,不会发生离子反应的是( )A.NaOH溶液和CuCl2溶液B.Na2CO3溶液和稀硫酸C.Na2SO4溶液和MgCl2溶液D.Ca(OH)2溶液和盐酸
答案 C解析 溶质NaOH、CuCl2、Na2CO3、Na2SO4、Ca(OH)2、MgCl2、HCl、H2SO4都是电解质,它们在水溶液中电离成自由移动的阴、阳离子。是否能够发生离子反应,可根据是否生成难溶性物质、难电离的物质或易挥发性的物质进行判断。Na2SO4和MgCl2溶液混合后既没有难溶性物质,也没有难电离的物质或易挥发性的物质生成,故不能发生离子反应。
2.(2020山东济南外国语学校高一期中)下列离子方程式书写正确的是( )A.铁与稀盐酸反应:2Fe+6H+==2Fe3++3H2↑B.稀硫酸与氢氧化钡溶液反应:Ba2++H++OH-+S ==H2O+BaSO4↓C.碳酸钙与稀盐酸反应:CaCO3+2H+==Ca2++CO2↑+H2OD.铜片跟硝酸银溶液反应:Cu+Ag+==Cu2++Ag
解析 铁与稀盐酸反应生成亚铁盐,离子方程式为Fe+2H+==Fe2++H2↑,故A错误;稀硫酸与氢氧化钡溶液反应,Ba2+和OH-的物质的量之比应为1∶2,离子方程式为Ba2++2H++2OH-+S ==2H2O+BaSO4↓,故B错误;碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,离子方程式为CaCO3+2H+==Ca2++CO2↑+H2O,故C正确;铜片跟硝酸银溶液反应,离子方程式为Cu+2Ag+==Cu2++2Ag,故D错误。
3.(2021湖北荆州高一期末)在某无色透明的酸性溶液中,能大量共存的离子组是( )
答案 B解析 A项,OH-能与酸性溶液中的H+反应生成水;B项,四种离子均不与H+反应,相互之间也不反应,能大量共存;C项,Fe3+为棕黄色,不符合题意;D项,Ag+与Cl-能反应生成AgCl沉淀,不能大量共存。
4.下列各组中的物质在溶液中的反应,可用同一离子方程式表示的是( )A.氢氧化钠与盐酸;氢氧化钠与碳酸B.BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液C.Na2CO3溶液与盐酸;CaCO3与盐酸D.氧化铜与硝酸;氧化铜与盐酸
高中化学第4节 离子反应优质ppt课件: 这是一份高中化学第4节 离子反应优质ppt课件,共33页。PPT课件主要包含了学习目标,特征反应,氧化还原反应,消耗标准液的体积,物质的量浓度等内容,欢迎下载使用。
鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应备课ppt课件: 这是一份鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应备课ppt课件,共60页。PPT课件主要包含了分点突破1,离子反应,分点突破2,离子方程式,分点突破3,分点突破4,离子反应的应用等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应授课ppt课件: 这是一份高中化学鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应授课ppt课件,共49页。PPT课件主要包含了学习目标,任务分项突破,课堂小结提升,学科素养测评,自主梳理,白色沉淀,红色变浅至无色,Ba2+,OH-,离子符号等内容,欢迎下载使用。













