





高中鲁科版 (2019)第2节 电解质的电离 离子反应说课ppt课件
展开1.通过实验,以变化的思想领会电离的定义,从而掌握电解质定义的内涵和外延,逐步提升宏观辨识与微观探析的化学核心素养。2.通过对电解质和电离定义的理解,能从宏观和微观相结合的视角重新认识酸、碱、盐的定义。3.通过归纳总结,学会用电离方程式表示某些酸、碱、盐的电离,培养证据推理与模型认知的化学核心素养。
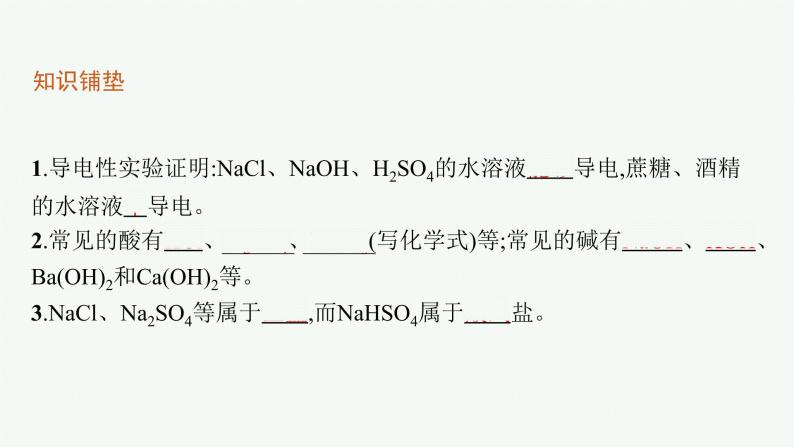
1.导电性实验证明:NaCl、NaOH、H2SO4的水溶液能够导电,蔗糖、酒精的水溶液不导电。2.常见的酸有HCl、H2SO4、HNO3(写化学式)等;常见的碱有NaOH、KOH、Ba(OH)2和Ca(OH)2等。3.NaCl、Na2SO4等属于正盐,而NaHSO4属于酸式盐。
一、电解质和非电解质1.电解质(1)定义:在水溶液中或熔融状态下能够导电的化合物。(2)常见的电解质:酸、碱、盐,如HCl、H2SO4、NaOH、Ca(OH)2、NaCl、KNO3等。
(3)电解质溶液或熔融电解质导电的原因(以NaCl为例)。①电解质溶液能导电必须具备的条件是有带电荷的粒子,粒子可自由移动。②NaCl属于电解质,固体中含有带电微粒Na+、Cl-,但这些离子不能自由移动,故固态氯化钠本身不导电。③NaCl固体溶于水时,在水分子的作用下,Na+、Cl-进入水中,形成了可自由移动的带电粒子,故NaCl溶液可导电。④氯化钠固体受热熔化时,离子随温度升高也变得能自由移动,故熔融NaCl也能导电。
2.非电解质(1)定义:在水溶液中和熔融状态下都不能导电的化合物。(2)常见的非电解质有蔗糖、乙醇等。
【微思考1】(1)NaCl溶液能导电,NaCl溶液是电解质吗?(2)纯H2SO4在熔融状态时不导电,H2SO4不是电解质吗?提示 (1)NaCl溶液是混合物,不是电解质。(2)H2SO4在水溶液中能导电,H2SO4是电解质。【微思考2】不能导电的物质是非电解质,能导电的物质一定是电解质吗?提示 不一定。不能导电的物质不一定是非电解质,能导电的物质也不一定是电解质,如石墨、金属、氯化钠溶液等都能导电,但都不是电解质。
二、电解质的电离1.定义:电解质溶于水或受热熔化时,形成自由移动离子的过程。2.电离的条件:溶于水或熔融状态。3.表示方法——电离方程式(1)酸的电离(如H2SO4):H2SO4==2H++S 。(2)碱的电离(如NaOH):NaOH==Na++OH-。(3)盐的电离(如CuSO4):CuSO4==Cu2++S 。
4.从电离的角度认识酸、碱、盐(1)酸:电离时生成的阳离子全部是H+的化合物。
(2)碱:电离时生成的阴离子全部是OH-的化合物。
(3)盐:电离时生成金属阳离子(或铵根离子)和酸根阴离子的化合物。
【微思考3】凡是能电离出H+的物质一定是酸吗?提示 不一定。如NaHSO4在溶液中可电离出H+:NaHSO4==Na++H++S ,但NaHSO4属于酸式盐。【微点拨】电离方程式遵循质量守恒和电荷守恒。
三、强电解质、弱电解质1.强电解质(1)定义:在水溶液里能完全电离的电解质。强酸、强碱和大部分盐等都是强电解质。(2)电离方程式。强电解质的电离方程式用“==”,如HCl:HCl==H++Cl-。KOH:KOH==K++OH-。KNO3:KNO3==K++N 。
2.弱电解质(1)定义:在水溶液中部分电离的电解质。弱酸、弱碱、水等都是弱电解质。(2)电离方程式。弱电解质的电离方程式用“ ”,如CH3COOH:CH3COOH CH3COO-+H+。NH3·H2O:NH3·H2O N +OH-。
判断下列说法是否正确,正确的画“√”,错误的画“×”。1.在水溶液里和熔融状态下都能导电的化合物才能称为电解质。( )2.在熔融状态下能导电的化合物才能称为电解质。( )3.电解质发生电离需要通电才能进行。( )4.电解质是化合物,电解质溶液是混合物。( )5.溶于水能电离产生H+的电解质一定属于酸。( )6.氯化钠晶体不能导电,是由于其中不含离子。( )7.NH3属于非电解质,但其水溶液能够导电。( )8.在溶于水或熔融状态下能够自身发生电离的化合物一定是电解质。( )
1.蔗糖为什么不属于电解质?提示 蔗糖在水溶液里和熔融状态下都不能导电。2.CO2的水溶液能导电,CO2为电解质吗?为什么?提示 不是。CO2的水溶液导电是因为CO2与H2O反应生成了电解质H2CO3,但CO2不是电解质。3.BaSO4、AgCl、CaCO3难溶于水,它们是电解质吗?提示 BaSO4、AgCl、CaCO3都属于盐,都是电解质。
1.电解质与非电解质的比较
2.强电解质和弱电解质
3.电解质与非电解质、强电解质与弱电解质的易混点(1)电解质和非电解质都是化合物,单质和混合物既不是电解质也不是非电解质。(2)电解质不一定能导电,如固态NaCl、液态HCl等。能导电的物质不一定是电解质,如铁、铝等金属单质。(3)化合物溶于水或熔融状态下,能否直接电离是判断化合物是不是电解质的依据。
(4)强电解质不一定易溶,如AgCl、BaSO4、CaCO3等。强电解质与弱电解质的根本区别是能否完全电离,与溶解度的大小无关,与溶液的导电能力无关。(5)溶液的导电能力只与溶液中的离子浓度大小及离子所带电荷数有关,与是强电解质还是弱电解质无关。
例1(2021北京师大附中高一期中)下列有关电解质的叙述正确的是( )A.液态HCl不导电,所以HCl是非电解质B.CO2的水溶液能够导电,所以CO2是电解质C.液态Cl2不导电,所以Cl2是非电解质D.BaSO4溶于水的部分能够电离,所以BaSO4是电解质答案 D解析 根据电解质的定义分析可知,D正确。
规律方法“三步曲”判断电解质、非电解质(1)首先看是不是化合物。电解质与非电解质都属于化合物。单质(如石墨)、混合物(如盐酸)既不是电解质,也不是非电解质。(2)其次看在水溶液里或者在熔融状态下能否导电。电解质在一定条件下能导电,电解质导电的条件是电解质溶于水或熔融状态,二者具备其一即可。有些电解质溶于水导电,但熔融状态下不导电,如HCl气体;有些电解质在溶于水和熔融状态下都能导电,如BaSO4。
(3)最后还要看是不是自身发生电离而导电。溶于水能导电的化合物不一定是电解质,如CO2水溶液能导电,不是CO2分子本身直接电离产生离子,而是CO2与水反应生成的H2CO3电离出自由移动的离子而导电,H2CO3是电解质,但CO2不是电解质。
变式训练1电解质不仅在工农业生产中占有重要地位,而且在各种生命活动中也起着重要作用,下列有关电解质的叙述正确的是( )A.化合物都是电解质B.纯水的导电性很差,但水也是电解质C.某化合物的水溶液能导电,该化合物一定是电解质D.NaNO3固体不导电,所以NaNO3不是电解质
答案 B解析 CO2不属于电解质,A项错误;水是电解质,B项正确;电解质导电是有条件的,化合物的水溶液能导电,该化合物不一定是电解质,如二氧化碳,C项错误;NaNO3溶液能导电,所以NaNO3是电解质,D项错误。
如图所示,两烧杯中分别有相同体积相同物质的量浓度的盐酸和CH3COOH溶液,甲灯泡比较亮,乙灯泡比较暗(电源省略)。
(1)电解质只有在水中才能发生电离吗?提示 不一定。有些电解质在熔融状态下也能发生电离。(2)电解质电离需要通电吗?试举例说明。提示 不需要。如NaCl在水分子作用下或熔融条件下就会电离出Na+和Cl-。(3)物质的量浓度相同的盐酸和CH3COOH溶液为何导电能力不同?提示 HCl是强电解质,在水溶液中完全电离,CH3COOH是弱电解质,在水溶液中只能部分电离,所以在浓度相同的情况下,盐酸中离子浓度更大,导电能力更强。
(4)有人通过实验得出结论“强电解质导电能力强,弱电解质导电能力弱”,这种说法对吗?为什么?提示 说法不正确。当弱电解质溶液浓度远远大于强电解质溶液的浓度时,可能弱电解质溶液的导电能力更强。
1.电解质的电离及导电性(1)实质:电离的内因是电解质本身具有离子或具有能产生离子的内部结构,外因是水分子的作用或受热熔化。(2)条件:溶于水或熔融状态。
(3)程度:根据电解质在水溶液中的电离程度不同,电解质又分为强电解质和弱电解质。有关电解质的强弱必须注意以下两点:①电解质的强弱与其溶解度的大小无关。某些难溶于水的盐,由于溶于水的部分完全电离,它们属于强电解质,如BaSO4、CaCO3等。②电解质的强弱与溶液导电性没有必然的联系。由于溶液的导电性强弱与溶液中自由移动离子的浓度大小和离子所带的电荷多少有关,所以强电解质溶液的导电能力不一定强,弱电解质溶液的导电能力也不一定弱。
(4)方式。①酸的电离是酸分子在水分子的作用下离解成自由移动的离子。②强碱和大多数盐在固态时不会发生电离,在水分子的作用下或熔融状态下才离解成自由移动的离子。
2.电离方程式的书写(1)电离方程式的书写。①强电解质:完全电离,用“==”表示。如NaCl==Na++Cl-,H2SO4==2H++S 。
③酸式盐的电离方程式。
b.弱酸的酸式盐:NaHCO3是由Na+和HC 组成的盐,是强电解质,完全电离。但HC 是二元弱酸碳酸的酸式酸根离子,不能完全电离。故NaHCO3溶于水的电离方程式应为
④活泼金属的氧化物在熔融状态下也可电离,如:Na2O==2Na++O2-。
(2)注意事项。①符合客观事实。不能随意书写离子符号,离子的个数用“2”“3”等标在离子符号之前。②符合质量守恒:“==”两边原子种类、数目、质量相同。③符合电荷守恒。
例2(2020浙江东阳中学高一月考)(双选)下列说法正确的是( )A.将AgBr放入水中不能导电,故AgBr不是电解质B.CO2溶于水得到的溶液能导电,但CO2是非电解质C.熔融的金属能导电,所以金属是电解质D.固态的NaCl不导电,但NaCl是电解质
答案 BD解析 溴化银在熔融状态下能够导电,属于电解质,故A错误;二氧化碳溶于水生成电解质碳酸,碳酸电离产生自由移动的离子而导电,但是二氧化碳本身不能电离,属于非电解质,故B正确;金属属于单质,不是化合物,金属不是电解质,故C错误;氯化钠在熔融状态下和溶于水都能导电,属于电解质,故D正确。
变式训练2有下列物质:①碳棒 ②盐酸 ③H2SO4 ④氨水 ⑤熔融KOH ⑥NH3 ⑦CCl4 ⑧CO2 ⑨冰醋酸 ⑩NaHSO4固体。(1)上述物质中,可导电的是 (填序号,下同)。 (2)上述物质中,属于非电解质的是 。 (3)上述物质中,属于电解质但不导电的是 。 (4)上述物质中,属于弱电解质的是 。 (5)写出⑨⑩两种物质在水溶液中的电离方程式。⑨: 。 ⑩: 。
答案 (1)①②④⑤ (2)⑥⑦⑧(3)③⑨⑩ (4)⑨(5)CH3COOH CH3COO-+H+ NaHSO4==Na++H++S
解析 (1)①碳棒能导电;②盐酸中含有自由移动的氢离子和氯离子,能导电;④氨水中有自由移动的离子,能导电;⑤熔融KOH中有自由移动的离子,能导电;③H2SO4、⑥NH3、⑦CCl4、⑧CO2、⑨冰醋酸、⑩NaHSO4固体中均没有自由移动的离子或电子,所以不能导电。(2)非电解质包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等),所以⑥NH3、⑦CCl4、⑧CO2是非电解质。
(3)③H2SO4、⑤熔融KOH、⑨冰醋酸、⑩NaHSO4固体都是电解质,其中只有熔融态的KOH能导电,其他的均不导电,因此属于电解质但不导电的是③⑨⑩。(4)在水溶液中部分电离的电解质属于弱电解质,故属于弱电解质的是⑨冰醋酸。(5)冰醋酸在水溶液中不完全电离产生氢离子和醋酸根离子,电离方程式为CH3COOH CH3COO-+H+。NaHSO4固体在水中完全电离产生钠离子、氢离子和硫酸根离子,电离方程式为NaHSO4==Na++H++S 。
1.(2020陕西西安中学高一期中)下列各组物质,前者属于电解质,后者属于非电解质的是( )A.NaCl晶体、碱石灰B.铜、二氧化硫C.液态的HCl、酒精D.KNO3溶液、CO2
答案 C解析 NaCl晶体是电解质,碱石灰是氢氧化钠和氧化钙的混合物,既不是电解质,也不是非电解质,A项错误;Cu属于金属单质,既不是电解质也不是非电解质,二氧化硫是非电解质,B项错误;HCl溶于水能导电,HCl属于电解质,酒精属于非电解质,C项正确;硝酸钾溶液为混合物,既不是电解质也不是非电解质,CO2是非电解质,D项错误。
2.下列说法正确的是( )A.石墨有较好的导电性,所以石墨属于电解质B.NH3的水溶液具有一定的导电性,所以NH3是电解质C.液态HCl、固态NaCl均不能导电,所以HCl、NaCl均不是电解质D.蔗糖在水溶液中和熔融状态下均不能导电,所以蔗糖是非电解质答案 D解析 石墨是单质,不是化合物,不属于电解质,A项不正确;NH3的水溶液导电,是因为NH3与H2O反应生成NH3·H2O,NH3·H2O电离产生离子而导电,B项不正确;虽然液态HCl、固态NaCl不导电,但它们的水溶液均能导电,故两者均属于电解质,C项不正确。
3.下列说法不正确的是( )A.熔融NaCl发生了电离,能导电B.NaCl固体不能导电
解析 熔融NaCl能电离出Na+和Cl-,故能导电;NaCl晶体中无自由移动的离子,所以不能导电;N 的性质与金属离子相似,NH4NO3是铵盐,C项错误。
4.(2020山东平度第九中学高一期末)下列电解质的电离方程式书写不正确的是( )
高中化学鲁科版 (2019)必修 第一册第2章 元素与物质世界第2节 电解质的电离 离子反应备课课件ppt: 这是一份高中化学鲁科版 (2019)必修 第一册第2章 元素与物质世界第2节 电解质的电离 离子反应备课课件ppt,共33页。PPT课件主要包含了分点突破1,电解质及其电离,分点突破2,强电解质和弱电解质等内容,欢迎下载使用。
2020-2021学年第2节 电解质的电离 离子反应背景图课件ppt: 这是一份2020-2021学年第2节 电解质的电离 离子反应背景图课件ppt,共40页。PPT课件主要包含了学习目标,任务分项突破,课堂小结提升,学科素养测评,自主梳理,水溶液里或熔融状态下,水溶液里和熔融状态下,H2SO4,H2CO3,NaOH等内容,欢迎下载使用。
高中化学第1节 元素与物质分类教学ppt课件: 这是一份高中化学第1节 元素与物质分类教学ppt课件,共48页。PPT课件主要包含了内容索引,课前篇素养初探,课堂篇素养提升,知识铺垫,必备知识,分散系,性质和应用,正误判断,问题探究,深化拓展等内容,欢迎下载使用。













