高中化学第一节 铁及其化合物导学案
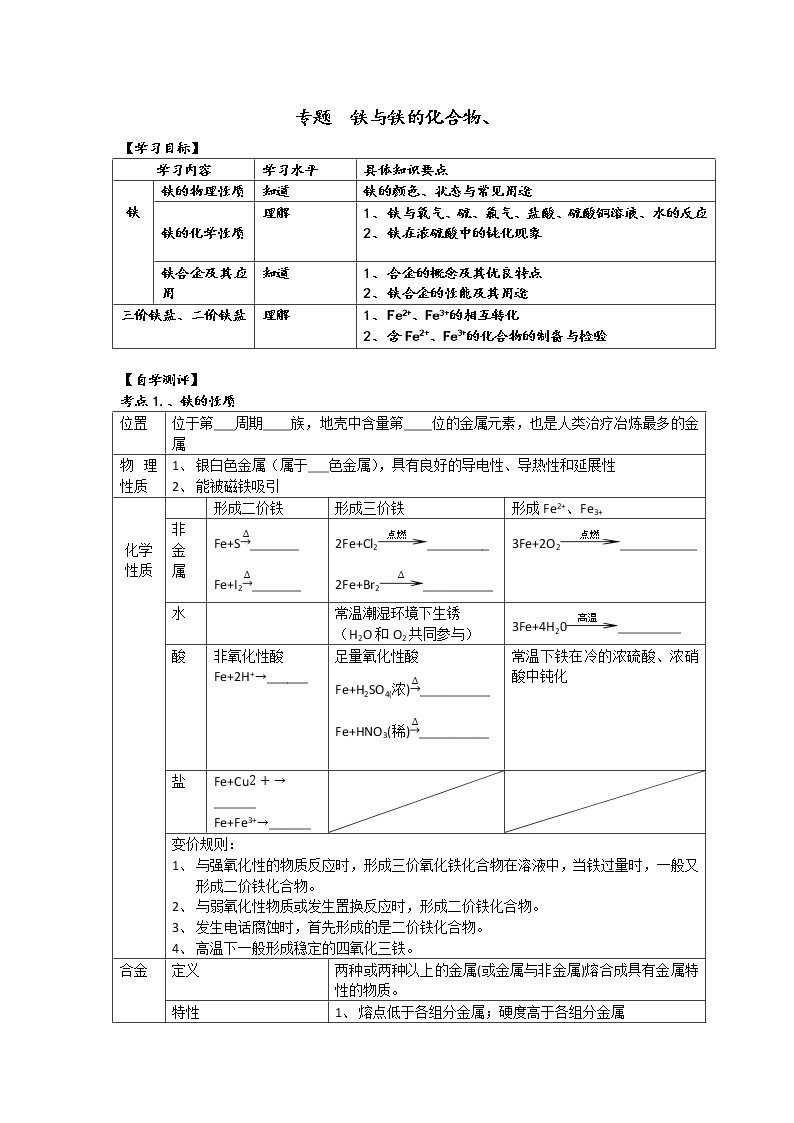
展开专题 铁与铁的化合物、
【学习目标】
学习内容 | 学习水平 | 具体知识要点 | |
铁 | 铁的物理性质 | 知道 | 铁的颜色、状态与常见用途 |
铁的化学性质 | 理解 | 1、 铁与氧气、硫、氯气、盐酸、硫酸铜溶液、水的反应 2、 铁在浓硫酸中的钝化现象 | |
铁合金及其应用 | 知道 | 1、 合金的概念及其优良特点 2、 铁合金的性能及其用途 | |
三价铁盐、二价铁盐 | 理解 | 1、 Fe2+、Fe3+的相互转化 2、 含Fe2+、Fe3+的化合物的制备与检验 | |
【自学测评】
考点1.、铁的性质
位置 | 位于第___周期____族,地壳中含量第____位的金属元素,也是人类治疗冶炼最多的金属 | |||
物理性质 | 1、 银白色金属(属于___色金属),具有良好的导电性、导热性和延展性 2、 能被磁铁吸引 | |||
化学性质
|
| 形成二价铁 | 形成三价铁 | 形成Fe2+、Fe3+ |
非金属 | Fe+S_______ Fe+I2_______ | 2Fe+Cl2_________ 2Fe+Br2__________ | 3Fe+2O2___________ | |
水 |
| 常温潮湿环境下生锈 (H2O和O2共同参与) | 3Fe+4H20_________ | |
酸 | 非氧化性酸 Fe+2H+______ | 足量氧化性酸 Fe+H2SO4(浓)__________ Fe+HNO3(稀)__________
| 常温下铁在冷的浓硫酸、浓硝酸中钝化 | |
盐 | Fe+Cu______ Fe+Fe3+______ |
|
| |
变价规则: 1、 与强氧化性的物质反应时,形成三价氧化铁化合物在溶液中,当铁过量时,一般又形成二价铁化合物。 2、 与弱氧化性物质或发生置换反应时,形成二价铁化合物。 3、 发生电话腐蚀时,首先形成的是二价铁化合物。 4、 高温下一般形成稳定的四氧化三铁。 | ||||
合金 | 定义 | 两种或两种以上的金属(或金属与非金属)熔合成具有金属特性的物质。 | ||
特性 | 1、 熔点低于各组分金属;硬度高于各组分金属 2、 延展性、颜色、抗腐蚀能力等均有可能发生变化 | |||
考点2、铁的氧化物与氢氧化物
铁的氧化物 | ||||
化学式 | FeO | Fe3O4 | Fe2O3 | |
铁的化合价 | +2价 | +2价(占1/3)、+3价(占2/3) | +3价 | |
名称 | 氧化亚铁 | 四氧化三铁(磁性氧化铁) | 1、 高温下,FeO、Fe2O3均会转化为最稳定的氧化铁(俗名铁红) | |
状态和颜色 | 黑色粉末 | 黑色晶体 | 红棕色固体 | |
化学性质 | 2、 加热或高温下均能被CO、H2、Al,C等还原 3、 与H+反应形成对应价态的盐Fe3O4 | |||
铁的氢氧化物 | ||||
化学式 | Fe(OH)2 | Fe(OH)3 | ||
物理性质 | 白色沉淀 | 红褐色沉淀 | ||
化学性质 | 1、 碱性:Fe(OH)3+3H+Fe3++3H2O 2、 热分解:2 Fe(OH)3 Fe2O3+3H2O 3、 Fe(OH)2的氧化:4 Fe(OH)2+O2+2H2O4 Fe(OH)3 | |||
氢氧化亚铁的制备 | 1、 Fe2+要纯——最好在过量铁粉中 2、 使用的碱要无氧状态——先煮沸除氧 3、 反应体系要在还原气氛中——如在氢气中 | |||
考点3、Fe2+与Fe3+相互转化与检验
知识梳理 | 基本转化关系 | Fe2+Fe3+ | ||
性质对比 |
| Fe2+ | Fe3+ | |
水溶液颜色 | 浅绿色 | 黄色 | ||
水溶液酸碱性 | 酸性 | 酸性 | ||
OH- | Fe(OH)2(白色) (灰绿色) Fe(OH)3(红褐色)
| |||
SCN- | 无变化 | 血红色 | ||
氧化性 | Fe2++ZnZn2++Fe | 2Fe3++2I-2Fe2++I2 2 Fe3++Fe3Fe2+ 2Fe3++Cu | ||
还原性 | 2Fe2++Cl22Fe3++2Cl- 2Fe2++H2O2+2H+2Fe3++2H2O 3Fe2++4H++NO3--3Fe3++NO+4H2O |
| ||
保存方法 | 加H+、加Fe粉 | 加H+ | ||
检验方法 | 沉淀法 | 滴加碱液,先生成Fe(OH)2白色絮状沉淀,沉淀迅速为灰绿色,直至红褐色 | 滴加碱液后,直接产生红褐色沉淀 | |
显色法 | 往溶液中滴加KSCN溶液不显红色,再滴加氯水后溶液显红色 | 往溶液中滴加KSCN溶液后,溶液立即呈现红色 | ||
人教版 (2019)必修 第一册第一节 铁及其化合物两课时学案: 这是一份人教版 (2019)必修 第一册第一节 铁及其化合物两课时学案,共4页。
高中化学人教版 (2019)必修 第一册第三章 铁 金属材料第一节 铁及其化合物导学案: 这是一份高中化学人教版 (2019)必修 第一册第三章 铁 金属材料第一节 铁及其化合物导学案,共12页。学案主要包含了学习目标,基础知识,实验3-2,考点剖析等内容,欢迎下载使用。
人教版 (2019)选择性必修3第一节 卤代烃导学案: 这是一份人教版 (2019)选择性必修3第一节 卤代烃导学案,共10页。学案主要包含了卤代烃的结构和性质,卤代烃的化学性质,卤代烃在有机合成中的应用等内容,欢迎下载使用。













