




专题02 物质结构专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)
展开专题02 物质结构专题
物质结构与性质综合题为“拼盘”命制的题型,各小题之间相对独立,重点考查考生对基础知识的掌握情况,主要考查原子结构与性质、分子结构与性质、晶体结构与性质。①在原子结构部分主要命题点有电子排布式或排布图的书写,电离能、电负性大小、微粒半径的比较与判断。②在分子结构部分主要命题点有化学键类型的判断,分子构型的判断,中心原子杂化方式的判断,能从化学键角度认识分子的结构、性质,从宏观和微观相结合的视角分析与解决实际问题。③在晶体结构部分主要命题点有晶体类型的判断,晶体结构的计算等。
试题有“三种”呈现形式:①以一种已知的元素立题,选取与其相关的某些典型单质或化合物展开设问,综合考查原子结构、分子结构和晶体结构。②以几种已知的元素立题,依托不同元素的物质分别独立或侧重考查原子结构、分子结构和晶体结构。③以推断出的几种元素立题,依托它们之间组成的物质综合考査原子结构、分子结构和晶体结构。
例1 CdSnAs2是一种高迁移率的新型热电材料,回答下列问题:
(1)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4。常温常压下SnCl4为无色液体,SnCl4空间构型为________,其固体的晶体类型为________________。
(2)NH3、PH3、AsH3的沸点由高到低的顺序为________________________(填化学式,下同),还原性由强到弱的顺序为________________,键角由大到小的顺序为________________。
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有________mol,该螯合物中N的杂化方式有________种。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如下图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
坐标
原子
x
y
z
Cd
0
0
0
Sn
0
0
0.5
As
0.25
0.25
0.125
一个晶胞中有________个Sn,找出距离Cd(0,0,0)最近的Sn________(用分数坐标表示)。CdSnAs2晶体中与单个Sn键合的As有________个。
一、原子核外电子排布
1.排布规律
(1)能量最低原理:原子核外电子先占有能量最低的原子轨道
(2)泡利原理:每个原子轨道中最多只能容纳2个自旋状态不同的电子
(3)洪特规则:原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占不同的原子轨道,且自旋状态相同
(4)洪特规则特例:能量相同的原子轨道在全充满、半充满和全空状态时,体系能量较低,原子较稳定。
2.表示形式
(1)核外电子排布式,如Cr:1s22s22p63s23p63d54s1,可简化为[Ar]3d54s1。
(2)价层电子排布式:如Fe:3d64s2。
(3)电子排布图又称轨道表示式:如O:
二、电离能和电负性
1.第一电离能
(1)规律:在元素周期表中,元素的第一电离能从左到右有增大的趋势,从上往下逐渐减小、
(2)特性:同周期主族元素,第ⅡA族(ns2)全充满、ⅤA族(np3)半充满,比较稳定,所以其第一电离能大于同周期相邻的ⅢA和ⅥA族元素。
2.电负性
(1)规律:在元素周期表中,电负性从左到右逐渐增大,从上往下逐渐减小。
(2)大小:F>O>N>Cl,N>C>H,P>H>Si
(3)化合价及物质类别判断电负性的大小
①HClO中Cl为+1价、O为-2价,可知O的电负性大于Cl;
②Al2O3是离子化合物、AlCl3是共价化合物,可知O的电负性大于Cl。
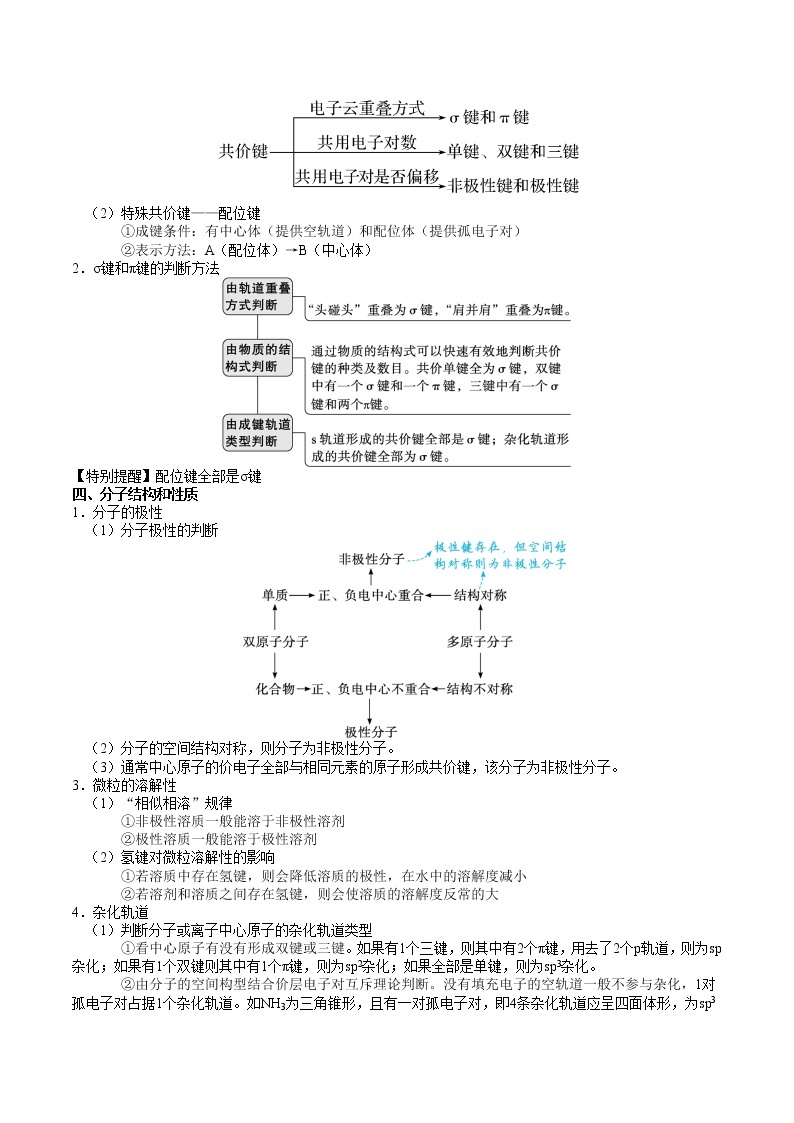
三、共价键
1.分类
(1)普通共价键
(2)特殊共价键——配位键
①成键条件:有中心体(提供空轨道)和配位体(提供孤电子对)
②表示方法:A(配位体)→B(中心体)
2.σ键和π键的判断方法
【特别提醒】配位键全部是σ键
四、分子结构和性质
1.分子的极性
(1)分子极性的判断
(2)分子的空间结构对称,则分子为非极性分子。
(3)通常中心原子的价电子全部与相同元素的原子形成共价键,该分子为非极性分子。
3.微粒的溶解性
(1)“相似相溶”规律
①非极性溶质一般能溶于非极性溶剂
②极性溶质一般能溶于极性溶剂
(2)氢键对微粒溶解性的影响
①若溶质中存在氢键,则会降低溶质的极性,在水中的溶解度减小
②若溶剂和溶质之间存在氢键,则会使溶质的溶解度反常的大
4.杂化轨道
(1)判断分子或离子中心原子的杂化轨道类型
①看中心原子有没有形成双键或三键。如果有1个三键,则其中有2个π键,用去了2个p轨道,则为sp杂化;如果有1个双键则其中有1个π键,则为sp2杂化;如果全部是单键,则为sp3杂化。
②由分子的空间构型结合价层电子对互斥理论判断。没有填充电子的空轨道一般不参与杂化,1对孤电子对占据1个杂化轨道。如NH3为三角锥形,且有一对孤电子对,即4条杂化轨道应呈四面体形,为sp3杂化。
(2)杂化轨道类型与分子构型的关系
杂化轨道类型
杂化轨道数目
分子构型
实例
sp
2
直线形
CO2、BeCl2、HgCl2
sp2
3
等性杂化:平面正三角形
BF3、BCl3、SO3
不等性杂化
CH2O(平面三角形)、SO2(Ⅴ形)
sp3
4
等性杂化:正四面体
CH4、CCl4、NH4+
不等性杂化
NH3(三角锥形)、H2S、H2O(Ⅴ形)
5.有关分子结构和性质的5个易错点
(1)误认为分子的稳定性与分子间作用力和氢键有关,其实分子的稳定性与共价键的强弱有关。
(2)误认为组成相似的分子,中心原子的杂化类型相同,其实要看其σ键和孤电子对数是否分别相同。如CO2和SO2中心原子的杂化方式不同,CO2分子中C原子是sp杂化,SO2分子中S原子是sp2杂化。
(3)误认为只要含有氢键物质的熔、沸点就高,其实不一定,分子间的氢键会使物质的熔、沸点升高,而分子内氢键一般会使物质的熔、沸点降低。
(4)误认为只含有极性键的分子都一定是极性分子,其实不ー定。如CO2、BF3等是非极性分子。
(5)误认为杂化轨道构型和分子的空间结构一致,其实不一定。如H2O中氧原子是sp3杂化,杂化轨道构型为四面体形,但由于分子中存在孤电子对,根据价层电子对互斥模型可知,H2O分子的空间结构是V形。
五、晶体结构和性质
1.晶体类型的判断
(1)科学判断法:X-射线衍射实验
(2)看构成微粒或作用力类型
离子晶体
共价晶体
分子晶体
金属晶体
构成微粒
阴阳离子
原子
分子
金属阳离子、自由电子
微粒间作用力
离子键
共价键
分子间作用力
金属键
(3)看物质类别
①单质类:金属单质及其合金属于金属晶体;大多数非金属单质属于分子晶体;金刚石、晶体硅、晶体硼等属于共价晶体。
②化合物类:离子化合物一定为离子晶体;共价化合物绝大多数为分子晶体,但SiO2、SiC、Si3N4等为原子晶体。
(4)看物理性质
①看晶体的熔、沸点:熔、沸点低的非金属单质和化合物一般为分子晶体;熔、沸点较高的化合物一般为离子晶体;熔、沸点很高的非金属单质和化合物一般为原子晶体。
②看导电性:熔融或固态时都不导电的是分子晶体或原子晶体;熔融或固态时都能导电的为金属晶体;固态时不导电,而熔融状态能导电的一定为离子晶体。
③看硬度和机械强度:具有高硬度的非金属单质或化合物为原子晶体:硬而脆的为离子晶体;硬度小且较脆的为分子晶体;有延展性的为金属晶体。
2.物质熔、沸点高低比较规律
(1)一般情况下,不同类型晶体的熔、沸点高低规律:原子晶体>离子晶体>分子晶体,如熔、沸点:金刚石>NaCl>Cl2;金属晶体>分子晶体,如熔、沸点:Na>Cl2(金属晶体熔、沸点有的很高,如钨、铂等,有的则很低,如汞等)。
(2)形成原子晶体的原子半径越小、键长越短,则键能越大,其熔、沸点就越高,如熔、沸点:金刚石>石英>碳化硅>晶体硅。
(3)形成离子晶体的阴阳离子所带的电荷数越多,离子半径越小,则离子键越强,熔、沸点就越高,如熔、沸点:MgO>MgCl2,NaCl>CsCl。
(4)金属晶体中金属离子半径越小,离子所带电荷数越多,其形成的金属键越强,金属单质的熔、沸点就越高,如Al>Mg>Na。
(5)分子晶体的熔、沸点比较规律。
①组成和结构相似的分子,相对分子质量越大,其熔、沸点就越高,如:HI>HBr>HCl。
②组成和结构不相似的分子,分子极性越大,其熔、沸点就越高,如:CO>N2。
③同分异构体分子中,支链越少,其熔、沸点就越高,如:正戊烷>异戊烷>新戊烷。
④同分异构体中的芳香烃及其衍生物,邻位取代物>间位取代物>对位取代物,如熔、沸点:邻二甲苯>间二甲苯>对二甲苯。
3.晶胞中微粒数目的计算方法——均摊法
(1)立方体晶胞
(2)其他晶胞
①顶点上微粒:被个晶胞共用
②侧棱上微粒:被顶点一半的晶胞共用
晶胞
正六棱柱
正三棱柱
示意图
顶点上微粒
6
12
侧棱上微粒
3
6
③上下棱上微粒:被4个晶胞共用
④面点上微粒:被2个晶胞共用
⑤内部的微粒:被1个晶胞独用
4.典型的晶体结构
(1)金属晶体的四种堆积方式
堆积名称
面心立方
最密堆积
体心立
方堆积
六方最
密堆积
简单立
方堆积
晶胞结构
堆积类型
A1型或铜型
A2型或钾型
A3型
或镁型
Po型
堆积方式
…ABCABC…
…ABAB…
配位数
12
8
12
6
空间利用率
74%
68%
74%
52%
典型代表
Cu、Ag、Au
Na、K、Fe
Mg、Zn、Ti
Po
(2)典型离子晶体的空间构型
类型
NaCl型
CsCl型
立方ZnS型
CaF2型
图示
结构特点
1/8晶胞为简单立方结构
体心立
方结构
间隔排列的4个小立方体的体心各有1个Zn2+
8个小立方体的
体心各有1个F-
配位数
6
8
4
Ca2+:8
F-:4
空隙形状
(3)常见分子晶体和共价晶体的晶胞
晶胞
二氧化碳
金刚石
碳化硅
二氧化硅
图示
结构特点
面心立方
同ZnS
将金刚石中内部的4个碳原子换成硅原子
将晶体硅中每个硅硅键中间插入1个氧原子
配位数
12
4
6
Si:4;O:2
5.晶胞密度的计算
(1)公式:ρ==
(2)单位换算
①1pm=10-12m=10-10cm
②1nm=10-9m=10-7cm
③1μm=10-6m=10-4cm
6.晶胞中空间利用率的计算
(1)空间利用率=×100%
(2)原子的体积:V=πr3(r为原子半径)
(3)晶胞体积
①根据晶胞参数计算
②根据密度计算:V=
(4)金属晶体原子半径(r)和晶胞参数(a)的关系
①面心立方:面对角线上的三个原子相切:4r=a
②体心立方:体对角线上的三个原子相切:4r=a
③简单立方:侧面上的原子两两相切:2r=1a
④六方最密:正四面体相邻原子两两相切:2r=1a
1.(2021~2022学年度唐山市高三年级摸底演练)半导体砷化硼具有超高的导热系数,有助于电子器件降温散热。回答下列问题:
(1)基态砷原子的电子排布式为________。
(2)实验测得,砷原子的第一电离能大于硒原子的第一电离能,原因是。
(3)三氧化二砷的分子结构如图所示,分子中砷原子的杂化方式是________,氧原子的杂化方式是________。
(4)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),则H、B、N电负性大小顺序是__________________。
(5)已知:
名称
硼酸
亚砷酸
亚磷酸
分子式
H3BO3
H3AsO3
H3PO3
结构式
类型
一元弱酸
三元弱酸
二元弱酸
①亚磷酸的结构式为________。
②硼酸溶于水的电离方程式为________________。
(6)砷化硼的晶胞结构如图(a)所示,图(b)中矩形AA’C’C是沿晶胞对角面取得的截图。
(a)
(b)
①若晶胞的边长均为apm,阿伏加德罗常数的值为NA,晶体的密度为________g·cm-3(列出计算表达式)。
②晶胞中各原子在矩形AA′C′C的位置为________(填标号)。
A
B
C
D
2.(福建省泉州市2022届高三下学期3月质监)(NH4)2BeF4是一种可溶于水的盐,多用于制备共价化合物BeF2和金属铍。回答下列问题:
(1)(NH4)2BeF4中第一电离能最大的元素,其基态原子的价电子轨道表示式为___________。
(2)(NH4)2BeF4中,阳离子具有___________结构,其中心原子的轨道杂化方式为___________。
(3)(NH4)2BeF4的阴离子中含有配位键,判断的依据是___________。1mol(NH4)2BeF4晶体中含有的配位键的数目为___________。
(4)(NH4)2BeF4晶胞结构如图1所示,晶胞中部分原子沿z轴的投影如图2所示(分数表示原子在晶胞内的比例,全部在晶胞内就不再标示)。投影图中的○是___________原子。
1.(2022~2023学年甘肃省张掖市高三上学期第一次诊断)Ge、GaAs、CdTe、CdSe等均为重要的半导体材料,在电子、材料等领域应用广泛。回答下列问题:
(1)Ge基态原子核外电子排布式为[Ar]_______。
(2)第四周期主族元素中,第一电离能介于Ga、As之间的元素是_______(填元素符号)。
(3)碲的化合物TeO2、TeO3、H2Te三种物质中,H2Te的中心原子杂化类型为_______,分子构型为V形的是_______。
(4)GaCl3熔点为77.9℃,气体在270℃左右以二聚体存在,GaCl3二聚体的结构式为________________________________。GaF3熔点为1000℃,GaCl3熔点低于GaF3的原因是_______________________________________________。
(5)CdSe的一种晶体为闪锌矿型结构,晶胞结构如图所示。
①原子坐标参数A为(,,),则B、C的原子坐标参数分别为____________、____________。
②已知Cd、Se的半径分别为anm和bnm,则CdSe的密度为_______g·cm-3(列出计算表达式,NA表示阿伏加德罗常数的值)。
2.(巴中市普通高中2023年高三“零诊”考试)Fe、Ni元素性质非常相似,属于铁系元素,得到广泛应用,请回答下列问题:
(1)Fe元素属于元素周期表的_______区(填分区)。
(2)基态Ni2+核外电子排布式为________________。
(3)鉴定Ni2+的特征反应是将丁二酮肟加入Ni2+盐溶液中,生成鲜红色的螯合物M,M的结构如图甲所示。
①组成M的5中元素中,除H元素外,另外4种元素第一电离能由大到小的顺序为______(填元素符号),其中C原子的杂化类型为_________________。
②图中各微粒不存在的作用力有________(填标号)
a.极性键 b.非极性键 c.配位键 d.π键 e.离子键 f.氢键
(4)一种铁氮化合物具有高磁导率,可用于制电子元件,其晶胞结构如图乙所示。
①铁氮化合物的化学式为_____________。
②在该晶胞结构的另一种表示中,N处于顶点位置,则铁处于_________、______位置。
③若该化合物密度为pg·cm-3,用NA表示阿伏伽德罗常数,则由Fe(II)构成的正八面体的体积为______________cm3。
3.(太原市2023届高三第一次适应性考试)完成下列问题。(1)已知气体溶解度(气体压强为1.01×105Pa,温度为293K,在100g水中的溶解度)数据如下表:
气体
溶解度/g
分子结构特点
乙烷
0.0062
中心原子sp3杂化,轨道半径较大,C负电性(δ-)及H正电性(δ+)不明显
乙炔
0.117
中心原子sp杂化,轨道半径较小,C负电性(δ-)及H正电性(δ+)明显
结合上表信息,说明乙烷与乙炔气体的溶解度存在差异的原因:_________________。
(2)已知乙酸(CH3COOH)的正交晶胞如图所示。阿伏加德罗常数为NA。
①第一电离能比C、O都大的同周期主族元素是:_______(填元素符号)。
②乙酸晶胞的密度=_______g/cm3。
(3)某笼形络合物A[Ni(CN)x(NH3)y(C6H6)z]结构中,金属离子与CN-连接形成平面层,两个平面层通过NH3分子连接,中间的空隙填充大小合适的分子(如C6H6)。其基本结构如图(H原子未画出):
①x∶y∶z=_______。
②该结构不是晶胞结构单元,理由是_______;
③通过分析,金属离子的配位数为_______(填入序号)。
A.2、3 B.4、6 C.3、4 D.5、6
4.(河南漯河市高2023届高三2月模拟)“天问一号”着陆火星,“嫦娥五号”采回月壤,探索宇宙离不开化学。镍铼合金是制造喷气发动机的燃烧室、涡轮叶片及排气喷嘴的重要材料。75号元素铼Re,熔点仅次于钨,是稀有金属之一,地壳中铼的含量极低,多伴生于铜、锌、铅等矿物中。
(1)镍原子价层电子表示式为___________,在元素周期表中,铼与锰在同族,铼在元素周期表中的位置是_______________。
(2)铼易形成高配位数的化合物如Re2(CO)10,该配合物中_______(填元素符号)提供孤对电子与铼成键,原因是___________________________,第二周期中第一电离能居于Li和O原子之间除了C原子之外,还有_______种原子。
(3)锌在潮湿的空气中极易生成一层紧密的碱式碳酸锌[ZnCO3·3Zn(OH)2]薄膜,使其具有抗腐蚀性。其中CO32-的空间构型为_______(用文字描述)。与CO32-互为等电子体的分子是_______(写一种即可)。Ge与C同族,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是:_____________________________________。
(4)三氧化铼晶胞如图所示,摩尔质量为Mg/mol,晶胞密度为bg/cm3,铼原子填在了氧原子围成的_______(填“四面体”“立方体”或“八面体”)空隙中,该晶胞的空间利用率为___________________(铼的原子半径为rRepm,氧原子半径为rOpm,列出计算式)。
5.(青海西宁市2023届高三1月模拟)氮化镓(CaN)、碳化硅(SiC)是第三代半导体材料。
(1)基态Ga原子的核外电子排布式为_______________。Ga、N和O的第一电离能由小到大的顺序为___________________。
(2)GaCl3的熔点为77.9℃,气体在270℃左右以二聚物存在,CaF3的熔点为1000℃;GaCl3的熔点低于GaF3的原因为___________________。
(3)GaCl3·xNH3(x=3,4,5,6)是一系列化合物,向含1molGaCl3·xNH3的溶液中加入足量AgNO3溶液,有难溶于稀硝酸的白色沉淀生成;过滤后,充分加热滤液,有4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1∶2。
①NH3的VSEPR模型名称为___________。
②能准确表示GaCl3·xNH3结构的化学式为___________。
(4)与镓同主族的硼(B)具有缺电子性,硼砂(四硼酸钠Na2B4O7·10H2O)中B4O72-是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应写成[B4O5(OH)4]2-的形式,结构如下图所示,则该离子中存在的作用力含有_______(填序号),B原子的杂化方式为_______。
A.离子键 B.极性键 C.氢键 D.范德华力 E.配位键
(5)氮化镓的晶胞如图所示,Ga原子与N原子半径分别为apm和bpm,阿伏加德罗常数的值为NA,晶胞密度为cg/cm3,则该晶胞的空间利用率为___________(已知空间利用率为晶胞内原子体积占晶胞体积的百分比)。
6.(安徽铜陵市2023届高三1月模拟)铜、锌、铁及其化合物在日常生产生活中有着广泛的应用。回答下列问题:
(1)在元素周期表的分区中,铜属于_______区,比较元素铜和锌的第二电离能:I2(Cu)_______I2(Zn)(选填“>”、“<”或“=”),写出基态Fe原子的核外电子排布:_____________。
(2)下列现代分析手段中,可用于检验水中痕量锌元素的是_______(填标号)。
A.X射线衍射 B.原子光谱 C.质谱 D.红外光谱
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物称为螯合物。FeCl3可与多种有机配体形成螯合物,如图所示结构为其中一种。该配合物分子中N原子的杂化类型为_______,1mol该螯合物中通过螯合作用形成的配位键有_______mol。
(4)Fe催化芳香烃硝化反应时会产生亚硝酰正离子NO2+。试比较亚硝酰正离子NO2+与亚硝酸根NO2-的键角大小:NO2+_______NO2-(选填“>”、“<”或“=”),并利用价层电子对互斥理论(VSEPR)简要解释原因:_______。
(5)近期我国科学家合成了一种电化学性能优异的铜硒化合物,其晶胞结构如图所示。其中铜元素以Cu+和Cu2+存在,则_______(选填“①”或“②”)为Cu2+。该晶体的密度为_______g/cm3(用代数式表示,设NA为阿伏伽德罗常数的值)。
8.(2023年1月浙江省选考仿真模拟卷B)碳族化合物在研究和生产中有许多重要用途,请回答下列问题:
(1)已知SiH4中硅元素为+4价,则H、Si、O、C的电负性由大到小的顺序为_______。
(2)基态锗原子(Ge)价层电子的轨道表示式为_______。
(3)邻羟基苯甲酸的沸点比对羟基苯甲酸的沸点低;请解释其原因___________________。
(4)氮化硅(Si3N4)是一种耐磨损、耐高温的结构陶瓷材料,其部分空间结构如图所示,其结构中每个原子杂化类型相同且均达到8电子稳定结构,请比较晶体结构中键角大小:N-Si-N_______Si-N-Si(填“>”“<”“=”)。
(5)某锂电池的负极材料是将锂原子嵌入到两层石墨烯层中间,其晶体结构如图。已知该晶体中最近的两个碳原子核间距离为anm,石墨烯层间距离为bnm,则该晶体的密度为_______g·cm-3(用NA表示阿伏加德罗常数,列式即可)。
9.(2023年内蒙古赤峰高三1月模拟)金属镍及其化合物在合成材料以及催化剂等方面应用广泛。请回答下列问题:
(1)基态Ni原子的原子结构示意图为_________________。
(2)NiO、FeO晶体类型与晶胞与NaCl相同,则NiO晶胞结构中Ni2+的配位数为_____;又知Ni2+、Fe2+的离子半径分别为69pm、78pm,则NiO熔点_____FeO(填“>”、“<”、“=”)。
(3)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图甲所示,则该沉淀中Ni2+的配位数为_____;元素H、C、N、O、Ni电负性由大到小的顺序为________________。
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图及晶胞参数如图乙所示。该晶体的化学式为_________________;晶体密度为_________________g•cm-3(列出含a、b、NA计算表达式,NA表示阿伏加德罗常数的值)。
10.(2023年山西临汾市高三1月模拟)铬是不锈钢的合金元素之一,目前被广泛应用于冶金、化工等领域。
(1)基态Cr原子价层电子的电子排布式为_______。
(2)金属铬的第二电离能I2(Cr)和锰的第二电离能I2(Mn)分别为1590.6kJ/mol、1509.0kJ/mol,I2(Cr)>I2(Mn)的原因是___________________。
(3)CrCl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为_______。
(4)Cr的一种配合物结构如图所示,该配合物阳离子中Cr的配位数为_______,阴离子ClO4-的空间构型为_____________。
(5)氮化铬晶体的晶胞结构如图所示,若N与Cr核间距离为apm(1pm=1×10-10cm),则氮化铬的密度为_______g·cm-3。
11.(宁波市2023学年第一学期选考模拟)牙齿表面釉质层主要成分为羟基磷灰石[Ca5(PO4)3OH],含氟牙膏中添入一氟磷酸钠(Na2PO3F)、氟化钠(NaF)等,可将羟基磷灰石转化为氟磷灰石[Ca5(PO4)3F],有效预防龋齿。
(1)表中是Na2PO3F中一种组成元素逐级失去电子的电离能:
I1
I2
I3
I4
I5
I6
I7
I8
电离能/(kJ•mol-1)
1012
1903
2912
4956
6273
21268
25397
29854
该元素在Na2PO3F中的化合价为____价,其基态原子的简化电子排布式为_______。
(2)①磷酸盐在微生物作用下可转化为PH3,PH3的中心原子的杂化方式为____。
②PH3键角为93.6°,小于VSEPR模型的预测值,原因为________________。
③HF的热稳定性比PH3强,原因为___________________。
(3)含氟牙膏中的F-在一定条件下可与摩擦剂CaCO3发生反应生成CaF2。CO32-的空间构型为_______。CaF2晶胞结构如图所示,晶胞中代表钙离子的是____(填“A”或“B”),在该晶体中与B最近且等距离的B的数目为__________。
12.(云南楚雄2023届高三1月模拟)北宋画家王希孟的绝世之作--《千里江山图》。它之所以能够流传千年依旧色彩艳丽,璀璨夺目,与其绘制方法和所用颜料有关。
(1)绘制时,第一遍先用水墨画好山水画,第二遍上红色(赭石色),赭石主含Fe2O3,为后面的绿色做铺垫,冷暖对比,使其更鲜亮。基态氧原子核外电子的运动状态有______种,三价铁离子的价电子排布式为______________。
(2)第三遍上石绿(孔雀石或绿松石),孔雀石主要成分是碱式碳酸铜,化学式为:Cu(OH)2·CuCO3。碳酸根离子的空间构型为______________。
(3)绿松石是一种含水的铜铝酸盐矿物,属于磷酸盐矿物,化学式为CuAl6(PO4)4(OH)8·5H2O。直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为__________________。
(4)第四遍还要再叠加一层绿,第五遍上青色,石青(蓝铜矿或青金石),蓝铜矿化学式为Cu3(CO3)2(OH)2,青金石是碱性铝硅酸盐矿物,化学式为(Na,Ca)7~8(Al,Si)12(O,S)24[SO4,Cl2(OH)2]。
①Cu2+与OH-结合能生成[Cu(OH)4]2-,[Cu(OH)4]2-中配位原子为______(用元素符号表示)。
②根据价层电子对互斥理论,H2O、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是____________。S8的熔沸点比SO2高很多,主要原因是___________________________。
(5)《千里江山图》中还用到了黄色的颜料䧳黄,雌黄的主要成分是As2S3,有剧毒。
①NH3、PH3、AsH3的键角由小到大的顺序为_______________。
②砷化镓晶胞如图所示,若两个镓原子之间的最近距离为dpm,NA代表阿伏加德罗常数的值,则砷化镓晶体的密度=____________g·cm-3。(用含d,NA的代数式表示)
1.(2022·全国甲卷)2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(CH2=CH2)与四氟乙烯(CF2=CF2)的共聚物(ETFE)制成。回答下列问题:
(1)基态F原子的价电子排布图(轨道表示式)为_________________。
(2)图a、b、c分别表示C、N、O和F的逐级电离能Ⅰ变化趋势(纵坐标的标度不同)。第一电离能的变化图是_______(填标号),判断的根据是_______________________________________________;第三电离能的变化图是_______(填标号)。
(3)固态氟化氢中存在(HF)n形式,画出(HF)3的链状结构_______。
(4)CF2=CF2和ETFE分子中C的杂化轨道类型分别为_______和_______;聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因_________________________。
(5)萤石(CaF2)是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是_______;若该立方晶胞参数为apm,正负离子的核间距最小为_______pm。
2.(2022·全国乙卷)卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)氟原子激发态的电子排布式有_______,其中能量较高的是_______。(填标号)
a.1s22s22p43s1 b.1s22s22p43d2 c.1s22s12p2 d.1s22s22p33p2
(2)①一氯乙烯(C2H3Cl)分子中,C的一个_______杂化轨道与Cl的3px轨道形成C-Cl_______键,并且Cl的3pz轨道与C的2pz轨道形成3中心4电子的大π键(Π)。
②一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C-Cl键长的顺序是_______,理由:(ⅰ)C的杂化轨道中s成分越多,形成的C-Cl键越强;(ⅱ)_______。
(3)卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为_______。解释X的熔点比Y高的原因___________________________。
(4)-AgI晶体中I-离子作体心立方堆积(如图所示),Ag+主要分布在由I-构成的四面体、八面体等空隙中。在电场作用下,Ag+不需要克服太大的阻力即可发生迁移。因此,-AgI晶体在电池中可作为_______________。
已知阿伏加德罗常数为NA,则-AgI晶体的摩尔体积Vm=_______ m3/mol(列出算式)。
3.(2021·全国甲卷)我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为________;单晶硅的晶体类型为_________。SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为_______。SiCl4可发生水解反应,机理如下:
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为________(填标号)。
(2)CO2分子中存在_______个键和______个键。
(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是________。
(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是________,晶胞参数为a pm、a pm、c pm,该晶体密度为____________g·cm-3(写出表达式)。在ZrO2中掺杂少量ZrO后形成的催化剂,化学式可表示为ZnxZr1-xOy,则y=________(用x表达)。
4.(2021·全国乙卷)过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(1)对于基态Cr原子,下列叙述正确的是_______(填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d54s1
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。Cu(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子是_______,中心离子的配位数为_______。[
(3)Cu(NH3)3(H2O)2Cl]2+中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如图所示。
PH3中P的杂化类型是_______。NH3的沸点比PH3的_______,原因是_______,H2O的键角小于NH3的,分析原因_______。
(4)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是_______原子。设Cr和Al原子半径分别为rCr和rAl,则金属原子空间占有率为_______%(列出计算表达式)。
5.(2020·全国Ⅰ卷)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为________________。
(2)Li及周期表中相邻元素的第一电离能(I1)如表所示。
I1/(kJ·mol-1)
Li 520
Be 900
B 801
Na 496
Mg 738
Al 578
I1(Li)>I1(Na),原因是________。I1(Be)>I1(B)>I1(Li),原因是________________。
(3)磷酸根离子的空间构型为___________,其中P的价层电子对数为_____、杂化轨道类型为______。
(4)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有________个。
电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4,结构示意图如(b)所示,则x=________,n(Fe2+)∶n(Fe3+)=________________。
6.(2020·全国Ⅱ卷)钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为____________________。
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是________________________________________。
化合物
TiF4
TiCl4
TiBr4
TiI4
熔点/℃
377
-24.12
38.3
155
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是_________;金属离子与氧离子间的作用力为________________,Ca2+的配位数是________。
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子CH3NH3+,其晶胞如图(b)所示。其中Pb2+与图(a)中________的空间位置相同,有机碱CH3NH3+中,N原子的杂化轨道类型是________________;若晶胞参数为anm,则晶体密度为________g·cm-3(列出计算式)。
(5)用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图(c)所示,用离子方程式表示该原理________________________、________________。
7.(2020·全国Ⅲ卷)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是________________。根据对角线规则,B的一些化学性质与元素________的相似。
(2)NH3BH3分子中,N-B化学键称为________键,其电子对由________提供。氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O3NH4++B3O63-+9H2,B3O63-的结构为。在该反应中,B原子的杂化轨道类型由________变为________。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是________________。与NH3BH3原子总数相等的等电子体是________________(写分子式),其熔点比NH3BH3________(填“高”或“低”),原因是在NH3BH3分子之间,存在________________________________,也称“双氢键”。
(4)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为apm、bpm、cpm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。
氨硼烷晶体的密度ρ=________g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
预测卷02-【大题精做】冲刺2024年高考化学大题突破+限时集训(浙江专用): 这是一份预测卷02-【大题精做】冲刺2024年高考化学大题突破+限时集训(浙江专用),文件包含预测卷02原卷版docx、预测卷02解析版docx等2份试卷配套教学资源,其中试卷共22页, 欢迎下载使用。
预测卷02-【大题精做】冲刺2023年高考化学大题突破+限时集训(浙江专用): 这是一份预测卷02-【大题精做】冲刺2023年高考化学大题突破+限时集训(浙江专用),文件包含预测卷02解析版docx、预测卷02原卷版docx等2份试卷配套教学资源,其中试卷共20页, 欢迎下载使用。
预测卷02-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用): 这是一份预测卷02-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用),文件包含预测卷02-大题精做冲刺2023年高考化学大题突破+限时集训新高考专用解析版docx、预测卷02-大题精做冲刺2023年高考化学大题突破+限时集训新高考专用原卷版docx等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。












